PROCEDIMIENTO PARA LA PRODUCCIÓN BIOLÓGICA DE 1,3-PROPANODIOL CON ELEVADO RENDIMIENTO.
Una cepa de E. coli que comprende: •a) un sistema endógeno alterado de fosfotransferasa fosfoenolpiruvato-glucosa que evita la expresión de las proteínas activas del sistema de la fosfotransferasa PEP-glucosa que comprende uno o varios entre:
-i) un gen endógeno alterado ptsH que evita la expresión de una proteína fosfotransportadora activa; -ii) un gen endógeno alterado ptsl que evita la expresión de una fosfotransferasa fosfoenolpiruvatoproteína activa; y -iii) un gen endógeno alterado crr que evita la expresión de un componente activo IIA específico de glucosa; •b) un gen endógeno galP regulado por aumento que codifica un simportador activo galactosa-protón, dando como resultado dicha regulación por aumento una actividad incrementada del simportador galactosa-protón; •c) un gen endógeno glk regulado por aumento que codifica una glucocinasa activa, dando como resultado dicha regulación por aumento una actividad glucocinasa incrementada; •d) un gen endógeno gapA regulado por disminución que codifica una deshidrogenasa de glicerolaldehído-3fosfato activa, dando como resultado dicha regulación por disminución una actividad deshidrogenasa de glicerolaldehído-3-fosfato reducida; •e) una deshidrogenasa de glicerol-3-fosfato; •f) una glicerol-3-fosfatasa; •g) una deshidratasa; y •h) un factor de reactivación de la deshidratasa; en donde dicha cepa de E. coli es capaz de bioconvertir una fuente adecuada de carbono en glicerol, 1,3propanodiol o glicerol y 1,3-propanodiol. entre:
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2003/031805.
Solicitante: E.I. DU PONT DE NEMOURS AND COMPANY
GENENCOR INTERNATIONAL, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 1007 MARKET STREET WILMINGTON, DE 19898 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CERVIN,Marguerite,A, SOUCAILLE,Phillipe, VALLE,Fernando.
Fecha de Publicación: .
Fecha Solicitud PCT: 6 de Octubre de 2003.
Clasificación Internacional de Patentes:
- C12P7/18 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 7/00 Preparación de compuestos orgánicos que contienen oxígeno. › Polioles.
- C12P7/20 C12P 7/00 […] › Glicerol.
Clasificación PCT:
- C12N1/20 C12 […] › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 1/00 Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo. › Bacterias; Sus medios de cultivo.
- C12P7/00 C12P […] › Preparación de compuestos orgánicos que contienen oxígeno.
- C12P7/18 C12P 7/00 […] › Polioles.
Clasificación antigua:
- C12N1/00 C12N […] › Microorganismos, p.ej. protozoos; Composiciones que los contienen (preparaciones de uso médico que contienen material de protozoos, bacterias o virus A61K 35/66, de algas A61K 36/02, de hongos A61K 36/06; preparación de composiciones de uso médico que contienen antígenos o anticuerpos bacterianos, p. ej. vacunas bacterianas, A61K 39/00 ); Procesos de cultivo o conservación de microorganismos, o de composiciones que los contienen; Procesos de preparación o aislamiento de una composición que contiene un microorganismo; Sus medios de cultivo.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356526_T3.pdf
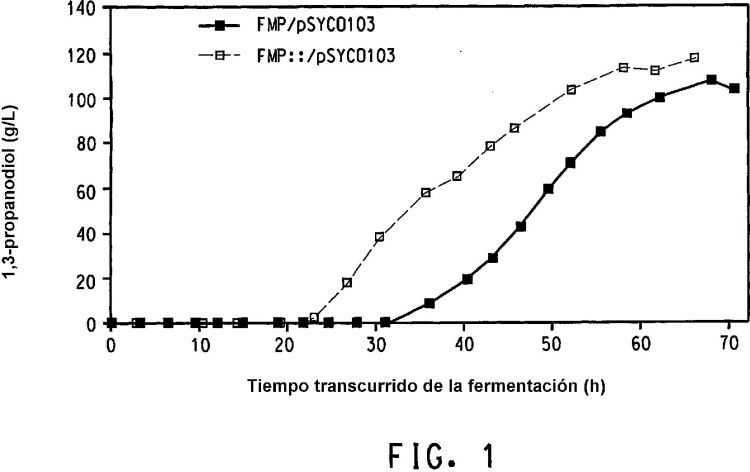
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
Esta invención comprende un procedimiento para la bioconversión de una fuente de carbono fermentable en 1,3-propanodiol a través de un solo microorganismo.
ANTECEDENTES 5
1,3-Propanodiol es un monómero que tiene una utilidad potencial en la producción de fibras de poliéster y en la fabricación de poliuretanos y de compuestos cíclicos.
Se conoce una variedad de rutas químicas para el 1,3-propanodiol. Por ejemplo, el óxido de etileno se puede convertir en 1,3-propanodiol sobre un catalizador, en presencia de fosfina, agua, monóxido de carbono, hidrógeno y un ácido, mediante la hidratación catalítica de la fase de solución de acroleína, seguida por reducción, o partir 10 de compuestos tales como glicerol, hecho reaccionar en presencia de monóxido de carbono y de hidrógeno sobre catalizadores que tienen átomos procedentes del grupo VlIl de la tabla periódica. Aunque es posible generar 1,3-propanodiol por estos métodos, son costosos y generan corrientes residuales que contienen contaminantes ambientales.
Desde hace un siglo se conoce que el 1,3-propanodiol se puede producir a partir de la fermentación de glicerol. Las cepas bacterianas capaces de producir 1,3-propanodiol se han encontrado, por ejemplo, en los grupos Citrobacter, Clostridium, Enterobacter, Ilyobacter, Klebsiella, Lactobacillus y Pelobacter. En cada caso estudiado, el glicerol se convierte en 1,3-propanodiol en una secuencia en dos etapas de reacción catalizada con enzimas. En la primera etapa, una deshidratasa cataliza la conversión de glicerol a 3-hidroxipropionaldehído (3-HPA) y agua, Ecuación 1. En la segunda etapa, 3-HPA se reduce a 1,3-propanodiol a través de una oxidorreductasa ligada a NAD+, 20 Ecuación 2. El 1,3-propanodiol no se metaboliza adicionalmente y, consecuentemente,
Glicerol → 3-HPA + H20 (Ecuación 1)
3-HPA + NADH + H+ → 1,3-Propanodiol + NAD+ (Ecuación 2)
se acumula en el medio. La reacción global consume un equivalente reductor en forma de cofactor, dinucleótido de β-nicotinamida y adenina reducido (NADH), que se oxida a dinucleótido de nicotinamida y adenina (NAD+). 25
En Klebsiella pneumonia, Citrobacter freundii y Clostridium pasteurianum, los genes que codifican las tres subunidades estructurales de la deshidratasa de glicerol (dhaB1-3 o dhaB, C y E) están situadas adyacentes a un gen que codifica una oxidorreductasa de 1,3-propanodiol (dhaT). Aunque la organización genética difiere algo entre estos microorganismos, estos genes están reunidos en un grupo que también comprende orfX y orfZ (genes que codifican un factor para la reactivación de la deshidratasa para la deshidratasa de glicerol), así como orfY y orfW 30 (genes de función desconocida). Las oxidorreductasas específicas de 1,3-propanodiol (dhaTs) de estos microorganismos se sabe que pertenecen a la familia de las deshidrogenasas de alcohol de tipo III; cada una muestra un motivo conservado que se une a hierro y tiene preferencia hacia la interconversión ligada a NAD+/NADH, de 1,3-propanodiol y 3-HPA. Sin embargo, la interconversión ligada a NAD+/NADH, de 1,3-propanodiol y 3-HPA también está catalizada por deshidrogenasas de alcohol que no están ligadas específicamente a enzimas deshidratasas (por 35 ejemplo, las deshidrogenasas de alcohol del hígado de caballo y de la levadura de Baker (E.C. 1.1.1.1)), no obstante con parámetros cinéticos menos eficaces. La deshidratasa de glicerol (E.C. 4.2.1.30) y la deshidratasa de diol[1,2-propanodiol] (E.C. 4.2.1.28) son enzimas relacionadas pero diferentes que están codificadas por distintos genes. Los genes de la deshidratasa de diol procedentes de Klebsiella oxytoca y Salmonella typhimurium, son similares a los genes de la deshidratasa de glicerol y están agrupados en un grupo que comprende genes análogos a orfX y orfZ 40 (Daniel y otros, FEMS Microbiol. Rev. 22, 553 (1999); Toraya y Mori, J. Biol. Chem. 274, 3372 (1999); GenBank AF026270).
La producción de 1,3-propanodiol a partir de glicerol se realiza generalmente bajo condiciones anaerobias usando glicerol como la única fuente de carbono y en ausencia de otros aceptores exógenos reductores equivalentes. Bajo estas condiciones, p. ej., en las cepas de Citrobacter, Clostridium y Klebsiella, una ruta paralela para el 45 glicerol actúa de forma que en primer lugar implica la oxidación de glicerol a dihidroxiacetona (DHA) a través de una deshidrogenasa de glicerol ligada a NAD+ (o a NADP+), Ecuación 3. La DHA, después de la fosforilación a fosfato de dihidroxiacetona (DHAP) a través de una cinasa de DHA (Ecuación 4),
Glicerol + NAD+- DHA + NADH + H+ (Ecuación 3)
DHA + ATP- DHAP + ADP (Ecuación 4) 50
está disponible para la biosíntesis y para auxiliar en la generación de ATP a través de, p. ej., la glicolisis. En contraposición con la ruta del 1,3-propanodiol, esta ruta puede proporcionar carbono y energía a la célula y produce más NADH del que consume.
En Klebsiella pneumoniae y Citrobacter freundii, los genes que codifican las actividades ligadas funcionalmente de la deshidratasa de glicerol (dhaB), oxidorreductasa de 1,3-propanodiol (dhaT), deshidrogenasa de glicerol 55
(dhaD) y cinasa de dihidroxiacetona (dhaK), están incluidos en el regulón dha. El regulón dha, en Klebsiella pneumoniae y Citrobacter freundii también incluye un gen que codifica una proteína activadora de la transcripción (dhaR). Los regulones dha procedentes de Citrobacter y Klebsiella se han expresado en Escherichia coli y se ha observado que convierten el glicerol en 1,3-propanodiol.
Ni los métodos químicos ni los biológicos descritos anteriormente para la producción de 1,3-propanodiol, 5 están bien adecuados para la producción a escala industrial ya que los procesos químicos requieren mucho gasto de energía y los procesos biológicos están limitados a títulos relativamente bajos, a partir de un material de partida costoso, el glicerol. Estos inconvenientes se podrían superar con un método que requiera un bajo aporte de energía y un material de partida económico, tal como hidratos de carbono o azúcares, o aumentando la eficacia metabólica de un proceso con glicerol. El desarrollo de cualquier método requerirá la capacidad de manipular la maquinaria 10 genética responsable de la conversión de azúcares en glicerol y de glicerol en 1,3-propanodiol.
Los procesos biológicos para la preparación de glicerol son conocidos. La inmensa mayoría de productores de glicerol son levaduras, pero también se conocen algunas bacterias u hongos, y algas. Las bacterias y las levaduras producen glicerol convirtiendo la glucosa u otros hidratos de carbono a través de la ruta de la fructosa-1,6-bifosfato en la glicolisis, o la ruta de Embden Meyerhof Parnas. El fosfato de dihidroxiacetona se convierte en glicerol-3-fosfato por la acción de la deshidrogenasa de glicerol-3-fosfato, y el glicerol-3-fosfato se convierte en glicerol por la acción de la glicerol-3-fosfatasa.
El gen que codifica la deshidrogenasa del glicerol-3-fosfato (DAR1, GPD1) se ha clonado y secuenciado a partir de S. diastaticus (Wang y otros, J. Bact. 176, 7091-7095 (1994)). El gen DAR1 se clonó en un vector transportador y se utilizó para transformar E. coli, en donde la expresión producía la enzima activa. Wang y otros (supra) 20 reconocieron que DAR1 está regulado por el entorno osmótico celular pero no sugirieron cómo se podía utilizar el gen para mejorar la producción de 1,3-propanodiol en un microorganismo recombinante.
Se han aislado otras enzimas deshidrogenasas del glicerol-3-fosfato: por ejemplo, la deshidrogenasa de sn-glicerol-3-fosfato se ha clonado y secuenciado a partir de Saccharomyces cerevisiae (Larason y otros, Mol. Microbiol. 10, 1101 (1993)) y Albertyn y otros. (Mol. Cell. Biol. 14, 4135 (1994)) instruyen sobre la clonación de GPD1 que 25 codifica una deshidrogenasa de glicerol-3-fosfato procedente de Saccharomyces cerevisiae. Como Wang y otros. (supra), tanto Albertyn y otros como Larason y otros, reconocen la osmosensibilidad de la regulación de este gen, pero no sugieren cómo se podría utilizar el gen en la producción de 1,3-propanodiol en un microorganismo recombinante.
Igual que con G3PDH, la glicerol-3-fosfatasa se ha aislado a partir de Saccharomyces cerevisiae y se ha 30 identificado que la proteína está codificada por los genes GPP1 y GPP2 (Norbeck y otros, J. Biol. Chem. 271, 13875 (1996)). De forma similar a los genes que codifican G3PDH, parece que GPP2 es... [Seguir leyendo]
Reivindicaciones:
1. Una cepa de E. coli que comprende:
a) un sistema endógeno alterado de fosfotransferasa fosfoenolpiruvato-glucosa que evita la expresión de las proteínas activas del sistema de la fosfotransferasa PEP-glucosa que comprende uno o varios entre:
i) un gen endógeno alterado ptsH que evita la expresión de una proteína fosfotransportadora activa; 5
ii) un gen endógeno alterado ptsl que evita la expresión de una fosfotransferasa fosfoenolpiruvato-proteína activa; y
iii) un gen endógeno alterado crr que evita la expresión de un componente activo IIA específico de glucosa;
b) un gen endógeno galP regulado por aumento que codifica un simportador activo galactosa-protón, dando 10 como resultado dicha regulación por aumento una actividad incrementada del simportador galactosa-protón;
c) un gen endógeno glk regulado por aumento que codifica una glucocinasa activa, dando como resultado dicha regulación por aumento una actividad glucocinasa incrementada;
d) un gen endógeno gapA regulado por disminución que codifica una deshidrogenasa de glicerolaldehído-3-fosfato activa, dando como resultado dicha regulación por disminución una actividad deshidrogenasa de glicerolal-dehído-3-fosfato reducida;
e) una deshidrogenasa de glicerol-3-fosfato;
f) una glicerol-3-fosfatasa;
g) una deshidratasa; y
h) un factor de reactivación de la deshidratasa; 20
en donde dicha cepa de E. coli es capaz de bioconvertir una fuente adecuada de carbono en glicerol, 1,3-propanodiol o glicerol y 1,3-propanodiol.
2. La cepa de E. coli de acuerdo con la reivindicación 1, que comprende adicionalmente uno o varios entre:
i) un gen endógeno alterado arcA que evita la expresión de una proteína activa para el control de la respiración aerobia;
j) un gen endógeno ppc regulado por aumento que codifica una carboxilasa de fosfoenolpiruvato activa;
k) un gen endógeno btuR regulado por aumento que codifica una adenosiltransferasa de cob(I)alamina activa; y
l) un gen yqhD regulado por aumento que codifica una deshidrogenasa de alcohol activa. 30
3. La cepa de E. coli de acuerdo con las reivindicaciones 1 ó 2, que comprende adicionalmente uno o varios entre:
m) un gen endógeno alterado mgsA que evita la expresión de una sintasa de metilglioxal activa;
n) un gen endógeno alterado ackA que evita la expresión de una cinasa de acetato activa;
o) un gen endógeno alterado pta que evita la expresión de una fosfotransacetilasa activa; 35
p) un gen endógeno alterado aldA que evita la expresión de una deshidrogenasa A de aldehído activa; y
q) un gen endógeno alterado aldB que evita la expresión de una deshidrogenasa B de aldehído activa.
4. La cepa de E. coli de acuerdo con las reivindicaciones 1, 2 ó 3, que comprende adicionalmente uno o varios entre:
r) un gen endógeno alterado edd que evita la expresión de una deshidratasa de fosfogluconato activa; 40
s) un gen endógeno alterado glpK que evita la expresión de una cinasa de glicerol activa; y
t) un gen endógeno alterado gIdA que evita la expresión de una deshidrogenasa de glicerol activa dependiente de NADH.
5. Un método para la bioproducción de 1,3-propanodiol que comprende poner en contacto la cepa de
E. coli de acuerdo con las reivindicaciones 1, 2, 3 ó 4, con un sustrato de carbono adecuado bajo condiciones adecuadas.
6. Una cepa de E. coli que comprende
a) un sistema endógeno alterado de fosfotransferasa fosfoenolpiruvato-glucosa que comprende uno o varios entre: 5
i) un gen endógeno alterado ptsH que evita la expresión de una proteína fosfotransportadora activa;
ii) un gen endógeno alterado ptsl que evita la expresión de una fosfotransferasa fosfoenolpiruvato-proteína activa; y
iii) un gen endógeno alterado crr que evita la expresión de un componente activo IIA específico de glucosa; 10
b) un gen endógeno galP regulado por aumento que codifica un simportador activo galactosa-protón, dando como resultado dicha regulación por aumento una actividad incrementada del simportador galactosa-protón;
c) un gen endógeno glk regulado por aumento que codifica una glucocinasa activa, dando como resultado dicha regulación por aumento una actividad glucocinasa incrementada;
d) un gen endógeno gapA regulado por disminución que codifica una deshidrogenasa de glicerolaldehído-3-fosfato activa, dando como resultado dicha regulación por disminución una actividad deshidrogenasa de glicerolaldehído-3-fosfato reducida;
e) un gen endógeno alterado arcA que evita la expresión de una proteína activa para el control de la respiración aerobia;
f) un gen endógeno ppc regulado por aumento que codifica una carboxilasa de fosfoenolpiruvato activa, 20 dando como resultado dicha regulación por aumento una actividad carboxilasa de fosfoenolpiruvato incrementada;
g) un gen endógeno btuR regulado por aumento que codifica una adenosiltransferasa de cob(I)alamina activa, dando como resultado dicha regulación por aumento una actividad adenosiltransferasa de co-b(I)alamina incrementada; 25
h) un gen yqhD regulado por aumento que codifica una deshidrogenasa de alcohol activa, dando como resultado dicha regulación por aumento una actividad deshidrogenasa de alcohol incrementada;
i) un gen endógeno alterado mgsA que evita la expresión de una sintasa de metilglioxal activa;
j) un gen endógeno alterado ackA que evita la expresión de una cinasa de acetato activa;
k) un gen endógeno alterado pta que evita la expresión de una fosfotransacetilasa activa; 30
I) un gen endógeno alterado aldA que evita la expresión de una deshidrogenasa A de aldehído activa;
m) un gen endógeno alterado aldB que evita la expresión de una deshidrogenasa B de aldehído activa;
n) un gen endógeno alterado edd que evita la expresión de una deshidratasa de fosfogluconato activa;
o) un gen endógeno alterado glpK que evita la expresión de una cinasa de glicerol activa;
p) un gen endógeno alterado gIdA que evita la expresión de una deshidrogenasa de glicerol activa dependiente de NADH; y
q) una cualquiera de las secuencias de nucleótidos para una estructura artificial pSYCO, SEQ ID NOs:65, 66, 67 ó 68;
r) una deshidrogenasa de glicerol-3-fosfato;
s) una glicerol-3-fosfatasa; 40
t) una deshidratasa; y
u) un factor de reactivación de la deshidratasa;
en donde dicha cepa de E. coli es capaz de bioconvertir una fuente adecuada de carbono en glicerol, 1,3-propanodiol o en glicerol y 1,3-propanodiol.
Patentes similares o relacionadas:
Proceso de fermentación para la producción y control de productos derivados de piruvato, del 8 de Julio de 2020, de Lanzatech New Zealand Limited: Un método para aumentar la producción de al menos un producto derivado de piruvato durante la fermentación microbiana, comprendiendo el método: a) proporcionar […]
Proceso para obtener derivados de azúcar, del 10 de Junio de 2020, de Annikki GmbH: Proceso para obtener ácido arabónico de un material que contiene hemicelulosa, en donde a) el material que contiene hemicelulosa se hidroliza de forma enzimática o no […]
Métodos para la degradación o la conversión de polisacáridos de la pared celular vegetal, del 6 de Mayo de 2020, de NOVOZYMES, INC.: Metodo para degradar o convertir los polisacaridos de la pared celular vegetal en uno o mas azucares, que comprende: tratar los polisacaridos de la pared celular vegetal con […]
Composición que comprende un extracto y 1,3-propanediol de origen biológico como disolvente no irritante, del 29 de Abril de 2020, de DuPont Tate & Lyle Bio Products Company, LLC: Una composición que comprende 1,3-propanodiol y un producto de extracción, en donde el 1,3-propanodiol se deriva biológicamente, tiene un nivel […]
3-Hidroxibutirato deshidrogenasa mutante de Rhodobacter sphaeroides, así como procedimientos y usos que implican la misma, del 29 de Enero de 2020, de F. HOFFMANN-LA ROCHE AG: Una 3-hidroxibutirato deshidrogenasa (3-HBDH) mutante de Rhodobacter sphaeroides con un rendimiento mejorado en relación con la 3-HBDH natural en la que la enzima mutante […]
PROCEDIMIENTO DE SÍNTESIS ENZIMÁTICA DE MONOÉSTERES DE COMPUESTOS POLIHIDROXILADOS, del 26 de Diciembre de 2019, de UNIVERSIDAD DE MURCIA: La presente invención se refiere a un procedimiento de síntesis enzimática de monoésteres de compuestos polihidroxilados pudiéndose aislar […]
 Cepas de microorganismo para la producción de 2,3-butanodiol, del 25 de Diciembre de 2019, de Alderys: Una levadura recombinante que tiene una actividad piruvato descarboxilasa reducida, en cuyo genoma se ha insertado:
- uno o más ácidos nucleicos que codifican una […]
Cepas de microorganismo para la producción de 2,3-butanodiol, del 25 de Diciembre de 2019, de Alderys: Una levadura recombinante que tiene una actividad piruvato descarboxilasa reducida, en cuyo genoma se ha insertado:
- uno o más ácidos nucleicos que codifican una […]
Procedimiento de síntesis enzimática de monoésteres de compuestos polihidroxilados, del 19 de Diciembre de 2019, de UNIVERSIDAD DE MURCIA: Procedimiento de síntesis enzimática de monoésteres de compuestos polihidroxilados. La presente invención se refiere a un procedimiento de […]