PROCEDIMIENTO PARA PREPARAR UN MUESTRA QUE INCORPORA UN CHOQUE ALCALINO.
Procedimiento de tratamiento de una muestra biológica, que comprende las etapas que consisten en:
(a) combinar dicha muestra biológica con un tampón pH y un detergente, creándose una primera composición líquida que presenta un primer pH en el intervalo de pH 6,5 a pH 8,0; (b) mezclar con dicha primera composición líquida una composición alcalina, creándose una segunda composición líquida que presenta un segundo pH en el intervalo de pH 8,0 a pH 9,2, en el que dicho segundo pH es por lo menos 0,2 unidades pH superior a dicho primer pH; (c) capturar uno o más ácidos nucleicos a partir de dicha segunda composición líquida sobre un soporte sólido; y (d) aislar el soporte sólido que se presenta capturados en el mismo de dichos uno o más ácidos nucleicos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/005725.
Solicitante: GEN-PROBE INCORPORATED.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: PATENT DEPT. 10210 GENETIC CENTER DRIVE SAN DIEGO, CA 92121-4362 ESTADOS UNIDOS DE AMERICA.
Inventor/es: BECKER, MICHAEL, M., LINNEN, JEFFREY M., WU,WEN, GAO,Kui.
Fecha de Publicación: .
Fecha Solicitud PCT: 17 de Febrero de 2006.
Clasificación PCT:
- C12N15/10 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Procedimientos para el aislamiento, la preparación o la purificación de ADN o ARN (preparación química de ADN o ARN C07H 21/00; preparación de polinucleótidos no estructurales a partir de microorganismos o con la ayuda de enzimas C12P 19/34).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357146_T3.pdf




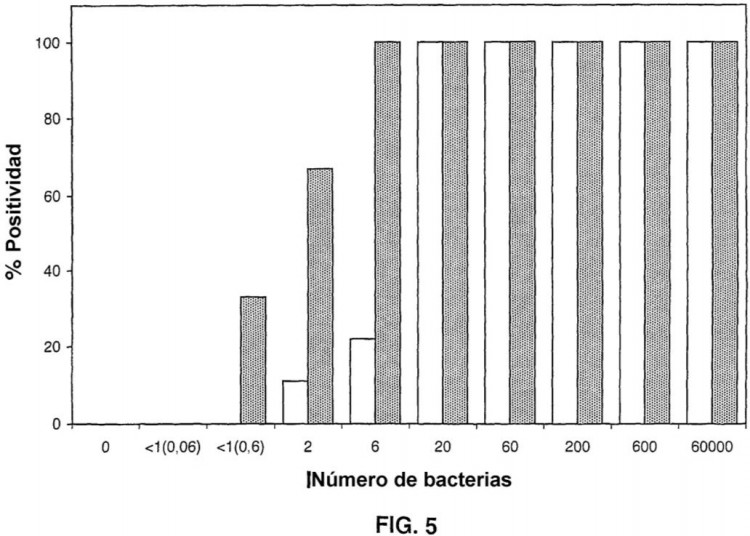
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a una tecnología de amplificación de ácido nucleico. Más específicamente, la invención se refiere a un procedimiento de preparación de una muestra de manera preliminar a la realización de una reacción de amplificación de ácido nucleico in vitro. 5
ANTECEDENTES DE LA INVENCIÓN
Las técnicas de amplificación de ácido nucleico in vitro se utilizan actualmente para sintetizar y quizás para detectar pequeñas cantidades evanescentes de una diana ácido nucleica. Estas técnicas utilizan convencionalmente uno o más cebadores oligonucleótidos y una enzima polimerizante del ácido nucleico para sintetizar copias de una o de las dos cadenas de una matriz del ácido nucleico. Antes de llevar a cabo el 10 procedimiento de amplificación, se han utilizado muchos procedimientos distintos para preparar las muestras biológicas.
Los ensayos múltiples, que pueden amplificar cualquiera de entre una pluralidad de distintas dianas ácido nucleicas a partir de una muestra de ensayo en una reacción única, presentan retos especiales de diseño. Por ejemplo, las dianas que pueden amplificarse en un ensayo múltiple, pueden ser dianas de ARN, dianas de ADN, o 15 incluso una combinación de dianas ARN y ADN. Una dificultad proviene de que los ácidos nucleicos ARN y ADN muestran distintas estabilidades químicas. Otra dificultad proviene de un deseo habitual de detectar, con una sensibilidad máxima, cualquiera de las variedades de los subtipos relacionados con una especie única de diana. Incluso cuando se utilizan en las reacciones cebadores específicos de subtipos, puede ser difícil alcanzar una sensibilidad detectora sustancialmente similar para los distintos subtipos de un único tipo de organismo. 20
De acuerdo con esto, es necesaria una técnica general que pueda potenciar la capacidad de detección de dianas particulares en las reacciones de amplificación ácido nucleicas. Existe una necesidad posterior de potenciar la capacidad de detección de una o más dianas en reacciones múltiples de amplificación, sin sacrificar sustancialmente la capacidad de detección de otras dianas en la misma reacción. La presente invención se refiere a estos requerimientos. 25
En verdad, la invención que se da a conocer en la presente memoria, proporciona un procedimiento conveniente para preparar muestras biológicas para que puedan ensayarse en cuanto a la presencia de dianas ácido nucleicas, utilizando una amplificación ácido nucleica in vitro. Este procedimiento proporciona ventajosamente resultados fiables con distintas muestras biológicas que contienen ácidos nucleicos, mientras se mejora de forma importante la capacidad de detección de dianas que contienen ciertos ácidos nucleicos. 30
SUMARIO DE LA INVENCIÓN
Hablando en general, la invención se refiere a un procedimiento para tratar una muestra biológica. Este procedimiento empieza con una etapa que consiste en combinar la muestra biológica con un tampón de pH y un detergente, para dar lugar a una primera composición líquida que presenta un primer pH del orden de 6,5 a 8,0. Para simplificar la etapa combinatoria, es conveniente que el tampón de pH y el detergente se encuentren en forma 35 líquida. A continuación, existe una etapa que consiste en mezclar, con la primera composición líquida, una composición alcalina, que dará lugar a una segunda composición líquida que tendrá un segundo pH en el intervalo de entre 8,0 y 9,2, donde este segundo pH es superior en por lo menos, 0,2 unidades, al primero, debiéndose esto al álcali añadido. Esto es seguido por una etapa de captura de uno o más ácidos nucleicos, a partir de la segunda composición líquida, en un soporte sólido. Finalmente, existe una etapa de aislamiento del soporte sólido, que 40 captura cualquiera o más ácidos nucleicos. Esto puede, por ejemplo, implicar la aspiración de materiales que no estén unidos (y) que permanecen en la fase líquida, aislando físicamente de esa manera el soporte sólido y cualquiera de los ácidos nucleicos en él capturados.
En una forma de realización, el tampón de pH y el detergente que se utiliza en la etapa de combinación, constituyen cada uno componentes de una solución de detergente tamponada, y la etapa de combinación, implica 45 la combinación de la muestra biológica con una alícuota de la solución de detergente tamponada.
Preferentemente, cuando el segundo pH está comprendido entre 8,0 y 9,2, la etapa de captura implica la captura de una o más especies de ARN o la de una o más especies de ADN sobre el soporte sólido. En otra forma de realización preferida, cuando el segundo pH está comprendido entre 8,0 y 9,2, el primer pH se encuentra en el intervalo de 6,5 a 8,0. 50
En aún otra forma de realización preferida, cuando el segundo pH está comprendido entre 8,0 y 9,2, la etapa de captura puede implicar la hibridación de uno o más ácidos nucleicos de la segunda composición líquida a uno o más oligonucleótidos inmovilizados o inmovilizables complementarios. Más preferentemente, el tampón de pH y el detergente en la etapa de combinación, son componentes cada uno de una solución de detergente tamponada, y la etapa de combinación implica la combinación de la muestra biológica con una alícuota de la solución de 55 detergente tamponada. Todavía más preferentemente, la solución de detergente tamponada que incluye el tampón de pH y el detergente, incluye además los oligonucleótidos inmovilizables o inmovilizados que pueden utilizarse para hibridizar y captar los ácidos nucleicos de la segunda composición líquida, procedente de la etapa de la
mezcla.
Preferentemente, cuando el primer pH, que hace referencia al pH de la combinación de la muestra biológica, del tampón y del detergente, se encuentra en el intervalo de 6,5 a 8,0, la etapa de captura implica la hibridación de uno o más ácidos nucleicos que van a ser capturados por uno o más oligonucleótidos inmovilizados o inmovilizables complementarios a los mismos. Más preferentemente, el tampón pH y el detergente que se utilizan 5 en la etapa de combinación, constituyen cada uno componentes de una solución de detergente tamponada, y la etapa de combinación implica la combinación de la muestra biológica con una alícuota de la solución de detergente tamponada. Más preferentemente todavía, la solución de detergente tamponada incluye además los oligonucleótidos inmovilizables o inmovilizados que se utilizan para capturar los ácidos nucleicos de la segunda composición líquida. Todavía más preferentemente, la etapa de aislamiento implica la separación del soporte sólido 10 del material que no se ha capturado, lavando entonces el soporte sólido en el que haya quedado capturado algún ácido nucleico. Más preferentemente todavía incluso, la totalidad de las etapas anteriormente descritas se llevan a cabo en un recipiente de reacción único.
En otra forma de realización preferida, la etapa de captura implica la hibridación del o de los ácidos nucleicos que van a ser capturados, a uno o a los oligonucleótidos inmovilizados o inmovilizables, que sean 15 complementarios. Cuando es el caso, resulta preferido que el tampón de pH y el detergente que se utilizan en la etapa combinatoria, constituyan cada uno componentes de una solución de detergente tamponada, y que la etapa de combinación implique la de la muestra biológica con una alícuota de la solución de detergente tamponada. Más preferentemente, la solución de detergente tamponada incluye además los oligonucleótidos inmovilizados o inmovilizables que pueden utilizarse para capturar ácidos nucleicos a partir de la segunda composición líquida. 20
En otra forma de realización preferida, el detergente utilizado en la etapa de combinación es un detergente aniónico o un detergente no iónico. Cuando este es el caso, la composición alcalina que se utiliza en la etapa de mezcla, es preferentemente una base fuerte, tal como NaOH o LiOH.
En otra forma de realización, la totalidad de las etapas de combinación, mezcla, captura y aislamiento, se llevan a cabo en un recipiente de reacción único. Cuando esto ocurre, la etapa de mezcla implica preferentemente 25 la agitación mediante sacudida orbital o sagitación vertical.
En otra forma de realización, el soporte sólido en la etapa de captura incluye una perla, tal como una perla magnética.
En otra forma de realización, el pKa del tampón de pH que se utiliza... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de tratamiento de una muestra biológica, que comprende las etapas que consisten en:
(a) combinar dicha muestra biológica con un tampón pH y un detergente, creándose una primera composición líquida que presenta un primer pH en el intervalo de pH 6,5 a pH 8,0;
(b) mezclar con dicha primera composición líquida una composición alcalina, creándose una segunda composición líquida que presenta un segundo pH en el intervalo de pH 8,0 a pH 9,2, 5
en el que dicho segundo pH es por lo menos 0,2 unidades pH superior a dicho primer pH;
(c) capturar uno o más ácidos nucleicos a partir de dicha segunda composición líquida sobre un soporte sólido; y
(d) aislar el soporte sólido que se presenta capturados en el mismo de dichos uno o más ácidos nucleicos.
2. Procedimiento según la reivindicación 1, en el que dicho tampón pH y dicho detergente en la etapa 10 (a) son cada uno componentes de una solución de detergente tamponada, y en el que la etapa de combinación comprende la combinación de dicha muestra biológica con una alícuota de dicha solución de detergente tamponada.
3. Procedimiento según la reivindicación 1, en el que la etapa (c) comprende la hibridación de dichos uno o más ácidos nucleicos a uno o más oligonucleótidos inmovilizados o inmovilizables complementarios a los 15 mismos.
4. Procedimiento según la reivindicación 3, en el que dicho tampón pH y dicho detergente en la etapa (a), son cada uno componentes de una solución de detergente tamponada, y en el que la etapa de combinación comprende combinar dicha muestra biológica con una alícuota de dicha solución de detergente tamponada.
5. Procedimiento según la reivindicación 4, en el que dicha solución de detergente tamponada 20 comprende además dichos uno o más oligonucleótidos inmovilizables o inmovilizados.
6. Procedimiento según la reivindicación 5, en el que la etapa (d) comprende la separación del soporte sólido del material no capturado en el mismo, lavando entonces el soporte sólido que presenta capturado en el mismo cualesquiera de dichos uno o más ácidos nucleicos.
7. Procedimiento según la reivindicación 6, en el que cada una de las etapas (a)-(d) se lleva a cabo en 25 un recipiente de reacción único.
8. Procedimiento según la reivindicación 1, en el que dicho detergente es seleccionado de entre el grupo constituido por un detergente aniónico y un detergente no iónico.
9. Procedimiento según la reivindicación 8, en el que dicha composición alcalina comprende una base fuerte seleccionada de entre el grupo constituido por NaOH y LiOH. 30
10. Procedimiento según la reivindicación 1, en el que cada una de las etapas (a)-(d) se lleva a cabo en un recipiente de reacción único.
11. Procedimiento según la reivindicación 10, en el que la etapa (b) comprende la agitación (i) mediante sacudida orbital o por agitación vorticial (ii).
12. Procedimiento según la reivindicación 1, en el que dicho soporte sólido comprende una perla. 35
13. Procedimiento según la reivindicación 12, en el que dicha perla es una perla magnética.
14. Procedimiento según la reivindicación 1, en el que el pKa de dicho tampón de pH se encuentra entre 6,0 y 9,0.
15. Procedimiento según la reivindicación 1, en el que por lo menos uno de dichos uno o más ácidos nucleicos capturados en la etapa (c) comprende una molécula de ARN. 40
16. Procedimiento según la reivindicación 1, en el que por lo menos uno de dichos uno o más ácidos nucleicos capturados en la etapa (c), comprende una molécula de ADN.
17. Procedimiento según la reivindicación 1, en el que dicho segundo pH está comprendido en el intervalo de pH 8,2 a pH 9,2.
18. Procedimiento según la reivindicación 1, que comprende además la etapa que consiste en: 45
(e) llevar a cabo una reacción de amplificación de ácido nucleico in vitro, utilizando como matriz por lo menos uno de dichos uno o más ácidos nucleicos capturados sobre el soporte sólido aislado en la etapa (d).
19. Procedimiento según la reivindicación 18, en el que dicho segundo pH está comprendido en el
intervalo de pH 8,2 a pH 9,2.
20. Procedimiento según la reivindicación 18, en el que dicha reacción de amplificación de ácido nucleico in vitro es una reacción múltiple.
21. Procedimiento según la reivindicación 20, en el que dichos uno o más ácidos nucleicos capturados en la etapa (c), comprenden dos o más ácidos nucleicos capturados, en el que dichos uno o más ácidos nucleicos 5 aislados en la etapa (d), comprenden dos o más ácidos nucleicos aislados y en el que dicha reacción múltiple utiliza como matrices dos de dichos dos o más ácidos nucleicos que fueron capturados en la etapa (c) y aislados a continuación en la etapa (d).
22. Procedimiento según la reivindicación 21, en el que dichos dos ácidos nucleicos que se utilizan como matrices en dicha reacción múltiple comprenden una molécula de ARN y una molécula de ADN. 10
23. Procedimiento según la reivindicación 18, en el que cada una de las etapas (a)-(e) se lleva a cabo en un recipiente de reacción único.
24. Procedimiento según la reivindicación 23, en el que dicha etapa (b) comprende la agitación (i) mediante sacudida orbital o (ii) por agitación vorticial.
Patentes similares o relacionadas:
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Vacuna subunitaria contra Mycoplasma spp., del 1 de Julio de 2020, de Agricultural Technology Research Institute: Una composición para prevenir una infección por Mycoplasma spp., que comprende: un principio activo, que comprende una proteína de PdhA; y un adyuvante […]
Método para romper un ácido nucleico y añadir un adaptador por medio de transposasa y reactivo, del 1 de Julio de 2020, de MGI Tech Co., Ltd: Un metodo para romper un acido nucleico y anadir un adaptador por medio de una transposasa, que comprende las siguientes etapas: interrumpir […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Etiquetado y evaluación de una secuencia diana, del 13 de Mayo de 2020, de RhoDx, Inc: Un método para modificar un ácido nucleico, que comprende: (a) poner en contacto un ácido nucleico de cadena sencilla con una actividad de transferasa […]
Preparación de bibliotecas de ácido nucleico marcado usando protocolo de adición en un solo tubo, del 13 de Mayo de 2020, de ILLUMINA, INC: Un método para preparar una biblioteca de fragmentos de ácido nucleico marcados que comprende: (a) poner en contacto una célula individual […]
Proteínas de captura de la superficie celular recombinantes, del 13 de Mayo de 2020, de REGENERON PHARMACEUTICALS, INC.: Un método para detectar y aislar células que producen altos niveles de una proteína heterodimérica que tiene una primera subunidad y una segunda subunidad, […]