PROCEDIMIENTO PARA SINTETIZAR AMINOADAMANTANOS.
Procedimiento para sintetizar aminoadamantanos o sus sales de adición de fórmula I
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06113681.
Solicitante: A.M.S.A. ANONIMA MATERIE SINTETICHE E AFFINI S.P.A.
Nacionalidad solicitante: Italia.
Dirección: VIA A. ALGARDI 4,20148 MILANO.
Inventor/es: VIGANO, ENRICO, LANFRANCONI,SIMONA, MOLTENI,RENATO, LANDONIO,ERNESTO.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Mayo de 2006.
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- C07C209/62 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 209/00 Preparación de compuestos que contienen grupos amino unidos a una estructura carbonada. › por rotura de enlaces carbono-nitrógeno, azufre-nitrógeno o fósforo-nitrógeno, p. ej. hidrólisis de amidas, N-desalquilación de aminas o de compuestos de amonio cuaternario (C07C 209/24 tiene prioridad).
- C07C231/08 C07C […] › C07C 231/00 Preparación de amidas de ácidos carboxílicos. › a partir de amidas por reacción sobre los átomos de nitrógeno de grupos carboxamido.
- C07C231/10 C07C 231/00 […] › a partir de compuestos no previstos en los grupos C07C 231/02 - C07C 231/08.
Clasificación PCT:
- C07C209/62 C07C 209/00 […] › por rotura de enlaces carbono-nitrógeno, azufre-nitrógeno o fósforo-nitrógeno, p. ej. hidrólisis de amidas, N-desalquilación de aminas o de compuestos de amonio cuaternario (C07C 209/24 tiene prioridad).
- C07C231/08 C07C 231/00 […] › a partir de amidas por reacción sobre los átomos de nitrógeno de grupos carboxamido.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
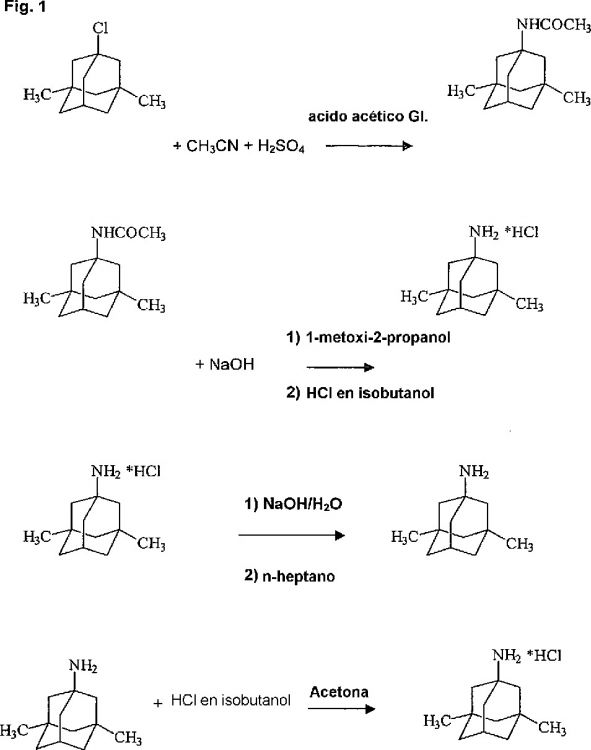
Fragmento de la descripción:
Procedimiento para sintetizar aminoadamantanos.
Campo de la invención
La presente invención se refiere a un nuevo procedimiento para sintetizar aminoadamantanos de fórmula (I)
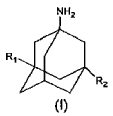
en la que R1 y R2 son idénticos o diferentes y son H o un grupo alquilo lineal o ramificado que comprende entre 1 y 6 átomos de carbono
y sus sales de adición con ácidos inorgánicos u orgánicos, en particular clorhidrato de memantina (clorhidrato de 1-amino-3,5-dimetiladamantano). Se conocen muchos adamantanos tri y tetrasustituidos por tener actividad sobre el sistema nervioso central, siendo efectivos en particular para tratar la Enfermedad de Parkinson.
Entre estos, clorhidrato de memantina es un conocido antagonista del receptor del ácido N-metil-D-aspártico (NDMA), y como tal, se usa para preparar fármacos patentados para tratar diversas enfermedades mentales.
Antecedentes de la técnica
Se ha descrito en el documento US 3.391.142 una síntesis temprana de los aminoadamantanos sustituidos anteriormente mencionados, en particular clorhidrato de memantina, comenzando a partir de su precursor 1-bromo-3,5-dimetiladamantano y grandes excesos de acetonitrilo y ácido sulfúrico concentrado, para proporcionar 1-acetamido-3,5-dimetiladamantano por medio de la así denominada reacción de Ritter. En Revue Romaine de Chemie (1993), 38(9), 1073-82 se lleva a cabo una reinvestigación de la reacción de Ritter entre isobutileno y acrilonitrilo en ácido acético anhidro en exceso y ácido sulfúrico como catalizador.
Esta reacción, que procede mediante el ataque de un acetonitrilo sobre un carbocatión que se forma en un entorno ácido seguido por la formación de una amida, es fuertemente exotérmica, con los consiguientes problemas de cambio de escala ya que los reactores normalmente usados para sintetizar principios farmacéuticamente activos no se diseñan para disipar dicho calor desarrollado. Esto es debido a que tienen en realidad que ser adecuadamente sobredimensionados con el fin de ser capaces de manipular sin graves peligros puntas extremas eventuales de liberación de calor producidas por acumulaciones potenciales de reactivos en el sistema. En el caso del documento US 3.391.142, también la segunda etapa de síntesis descrita en la anterior que conduce al 1-acetamido -3,5-dimetiladamantano como producto final, ha mostrado ser problemática, en que la hidrólisis del 1-acetamido-3,5-dimetiladamantano se lleva a cabo en presencia de hidróxido de sodio en dietilen glicol calentado a reflujo, es decir, a temperaturas que exceden 245º a 250ºC durante al menos 6 horas, después de las cuales, el producto de reacción se vierte sobre hielo. También, estas condiciones, dadas las elevadas temperaturas necesarias, no solo requieren plantas especiales, no usadas comúnmente en la síntesis de fármacos patentados, sino que también son muy severas - con el consiguiente riesgo de formación de impurezas que se deben eliminar, a menudo mediante laboriosas purificaciones. Específicamente en referencia al documento US 3.391.142, se extrajo la base libre obtenida tras la hidrólisis con benceno, capturada en éter, y a continuación se añadió HCl para proporcionar la sal de adición, que a continuación se volvió a precipitar a partir de una mezcla de alcohol y éter.
En el documento CN1335299 se describe un procedimiento para la síntesis de clorhidrato de memantina. Dicho procedimiento comprende acetilaminar 1-bromo-3,5-dimetiladamantano con acetonitrilo en presencia de H2SO4, verterlo en hielo/agua durante 10-14 horas para obtener 1-acetilamino-3,5-dimetiladamantano y tratar con 1,2-etanodiol en presencia de NaOH. Se obtuvo a continuación memantina mediante extracción con cloroformo y se acidificó finalmente con ácido clorhídrico y cloroformo recristalizado para obtener clorhidrato de memantina.
A continuación se describió en el documento US 4.122.193 una síntesis más moderna de clorhidrato de memantina, esta vez partiendo de 1-cloro-3,5-dimetiladamantano. El protocolo de síntesis implica, en l primera etapa, la reacción entre 1-cloro-3,5-dimetiladamantano y urea en un recipiente a presión a 220ºC. Estas son también condiciones muy severas, y, si la reacción se lleva a cabo a escala industrial, requieren también plantas especiales y disposiciones de seguridad, dichos recipientes de presión calentables mediante aceites diatérmicos, no usados normalmente para la síntesis de principios farmacéuticamente activos. Adicionalmente, las condiciones descritas pueden conducir también a la degradación in situ de la urea usada (cuya descomposición térmica en condiciones atmosféricas tiene lugar ya a temperaturas mayores de 132ºC, que conducen a la formación de biuret, amoníaco y ácido cianhídrico), dando como resultado considerables dificultades en la purificación del producto final, que tendrán que se de conformidad posteriormente con las especificaciones muy estrictas requeridas para las materias primas farmacéu- ticas.
Adicionalmente al 1-acetamido-3,5-dimetiladamantano conocido del documento US 3.391.142, el análogo 1-formamida-3,5-dimetiladamantano podría ser un intermedio hipotético en la ruta sintética del 1-halógeno-3,5-dimetiladamantano a HCL de memantina. Por tanto, el documento US 5.061.703, en los respectivos ejemplos 6F, 7D, 8E y 9E propone la síntesis de diferentes derivados de N-formilo de diferentes alquiladamantanos mediante la reacción entre formamida y el respectivo derivado de halógeno en condiciones de formamida a reflujo. Aquí, también, las condiciones necesarias son muy severas y requieren, para el cambio de escala, inversiones y expedientes considerables en la planta a una escala industrial. Esto es debido, a que a presión atmosférica, la formamida ebulle a 210ºC pero según los datos de la ficha de seguridad, su descomposición, a monóxido de carbono y amoníaco, comienza a aproximadamente 180ºC. por tanto, dentro de la esfera de los experimentos llevados a cabo por los inventores de la presente solicitud, en los que se hace reaccionar 1-halógeno-3,5-dimetiladamantano con formamida en las condiciones preferidas del documento US 5.061.703, se observó, de hecho, la formación de un sublimado coloreado de oscuro sobre las paredes frías del contenedor de reacción, y la mezcla completa de reacción apareció, tras las 12 horas prescritas a reflujo, como un punto oscuro que licuificó tras calentamiento. Y por tanto, la presencia de impurezas formadas durante la síntesis del intermedio de formamida continuó hasta que se obtuvo el producto final de clorhidrato que - si se obtiene por esta ruta - es menos puro.
Con el fin de evitar lo inconvenientes de la síntesis descrita en el documento US 3.339.142, se ha propuesto un procedimiento en la Solicitud Internacional WO 2005/062774 para preparar adamantanos que comprende una primera etapa de preparar un 1-hidroxi-adamantano, una segunda etapa de convertir el 1-hidroxi-adamantano a 1-acetamino-adamantano que a continuación se desacetila en una tercera etapa a 1-aminoadamantano, que está comprendido en el estado de la técnica relevante a efectos de lo novedoso de conformidad con el Art (54(3) de la EPC.
Se describe un intento adicional en la solicitud internacional WO 2006/010362 que es el estado de la técnica de conformidad con el Art. 54(3) de la EPC, en el que se obtienen adamantanos 1-amino-3,5-sustituidos mediante un procedimiento que evita el uso de halogenoadamantanos con el fin de producir 1-acetamido-adamantano obtenidos de esta manera en 1-aminoadamantanos con HCl.
A partir de lo anterior, parece por tanto que en el estado actual de la técnica no existe solución sintética libre de las desventajas anteriormente mencionadas, es decir, una ruta de síntesis para aminoadamantanos y sus sales de adición, en particular HCl de memantina, comenzando a partir de sus precursores halogenados correspondientes, que se pueda llevar a cabo a una escala industrial en condiciones suaves sin necesidad de equipo especial - diseñado tanto para operar a elevadas temperaturas como para disipar puntas de desarrollo de calor inusuales - lo que proporciona un producto final fácilmente purificable con niveles de pureza tradicionales para los productos farmacéuticos y no sustancialmente contaminado con los productos de la descomposición de los reactivos usados corriente arriba. De lo anterior, parece también que en el estado actual de la técnica no existe solución sintética mejorada a partir de un aspecto de seguridad, es decir, que también se evita, adicionalmente...
Reivindicaciones:
1. Procedimiento para sintetizar aminoadamantanos o sus sales de adición de fórmula I
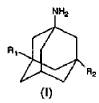
en la que R1 y R2 son idénticos o diferentes y son H o un grupo alquilo lineal o ramificado que comprende entre 1 y 6 átomos de carbono, a partir del acetamido adamantano de fórmula II
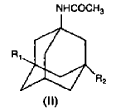
en la que R1 y R2 son como se ha establecido anteriormente, lo que comprende las siguientes etapas:
etapa 1) sintetizar acetamido adamantanos de fórmula II a partir de un halógeno adamantano de fórmula III
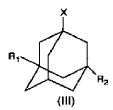
en la que R1 y R2 son como anteriormente, y en el que X es F, Cl, Br o I, a través de las siguientes etapas:
etapa 2) sintetizar aminoadamantanos de Fórmula I a partir del acetamido adamantano de fórmula II de la etapa 1 a través de las siguientes etapas:
2. Procedimiento según la reivindicación 1, en el que en la etapa 1) se usan 6-8 equivalentes de acetonitrilo, 6-8 equivalentes de ácido acético glacial y 3-5 equivalentes de ácido sulfúrico concentrado, con referencia al halógeno adamantano de fórmula III.
3. Procedimiento según la reivindicación 1 ó 2, en el que se mantiene una temperatura de reacción de 70
4. Procedimiento según una cualquiera de las reivindicaciones 1-3, en el que el halógeno adamantano usado en la etapa (a1) o (a2) es 1-halógeno-3,5-dimetiladamantano, en el que se escoge el residuo de halógeno entre el grupo constituido por F, Cl, Br e I, para dar 1-acetamido-3,5-dimetiladamantano en la etapa (c).
5. Procedimiento según una cualquiera de las reivindicaciones 1-4, en el que el disolvente de la etapa (a) es 1-metoxi-2-propanol.
6. Procedimiento según la reivindicación 5, en el que en la etapa (a) se usan al menos 4 equivalentes, pero preferiblemente 4-20 equivalentes de disolvente.
7. Procedimiento según una cualquiera de las reivindicaciones 1-6, en el que en la etapa (a) se usan al menos 6 pero preferiblemente 9 equivalentes de hidróxido de metal alcalino.
8. Procedimiento según una cualquiera de las reivindicaciones 1-7, en el que el hidróxido de metal alcalino usado en la etapa (a) es hidróxido de sodio.
9. Procedimiento según una cualquiera de las reivindicaciones 1-8, en el que el hidróxido de metal alcalino se usa en la etapa (a) como perlas de 1-3 mm de diámetro.
10. Procedimiento según una cualquiera de las reivindicaciones 1-9, en el que en la etapa (b) se elimina inicialmente mediante destilación 1/7-1/5 del volumen del disolvente usado.
11. Procedimiento según una cualquiera de las reivindicaciones 1-10, en el que la etapa de aislamiento (c) de la etapa 2) se lleva a cabo mediante conversión en una sal de adición de la misma.
12. Procedimiento según una cualquiera de las reivindicaciones 1-11, en el que la propia etapa (c) de la etapa 2) comprende las siguientes etapas:
13. Procedimiento según la reivindicación 12 en el que la extracción de la etapa (c1) se lleva a cabo a una temperatura de 80
14. Procedimiento según la reivindicación 12 ó 13, en el que tras la descartación en la etapa (c2) se elimina mediante destilación al menos la mitad de la fase orgánica y se descarta el destilado.
15. Procedimiento según una cualquiera de las reivindicaciones 12-14, en el que la reprecipitación de la etapa (c4) comprende por sí misma las siguientes etapas:
16. Procedimiento según la reivindicación 15, en el que el disolvente alifático usado en la etapa (c41) es n-heptano.
17. Procedimiento según la reivindicación 15 ó 16, en el que el disolvente usado en la etapa (c45) es acetona.
18. Procedimiento según una cualquiera de las reivindicaciones 1-17, en el que el aminoadamantano es clorhidrato de memantina.
Patentes similares o relacionadas:
Procedimiento para la preparación de 2,2-difluoroetilamina partiendo de un compuesto de bencilamina, del 10 de Mayo de 2017, de Bayer Intellectual Property GmbH: Un procedimiento para la preparación de 2,2-difluoroetilamina de fórmula (I) CHF2CH2NH2 (I) que comprende las etapas (i) y (ii): etapa (i): reacción de 2,2-difluoro-1-haloetano […]
Procedimiento para la preparación de 2,2-difluoroetilamina a partir de 2,2-difluoro-1-cloroetano, del 16 de Noviembre de 2016, de Bayer Intellectual Property GmbH: Un procedimiento para la preparación de 2,2-difluoroetilamina que comprende las siguientes etapas: etapa (i): reacción de 2,2-difluoro-1-cloroetano de […]
Procedimiento para la preparación de aminoalquilfenoles ópticamente activos, del 18 de Marzo de 2016, de BASF SE: Procedimiento para la preparación de compuestos ópticamente activos de fórmulas I-S y/o I-R**Fórmula** en las que n representa 0, 1 o 2 y m representa 0, 1 o 2, […]
Procedimiento para la preparación de 2,2-difluoroetilamina partiendo de prop-2-en-1-amina, del 2 de Julio de 2014, de Bayer Intellectual Property GmbH: Un procedimiento para la preparación de 2,2-difluoroetilamina de fórmula (I) CHF2CH2NH2 (I) que comprende las etapas (i) y (ii): etapa (i): reacción […]
Método para preparar 1-hidroxi-1,3,3,5,5-pentametilciclohexano, del 12 de Marzo de 2014, de MERZ PHARMA GMBH & CO. KGAA: Método para preparar 1-hidroxi-1,3,3,5,5-pentametilciclohexano que comprende la etapa (ii): (ii) convertir 3,3,5,5-tetrametilciclohexanona en 1-hidroxi-1,3,3,5,5-pentametilciclohexano […]
 Síntesis de trietilentetraminas, del 25 de Diciembre de 2013, de PhilERA New Zealand Limited: Proceso para la preparación de trietilentetramina o sales de trietilentetramina, que comprende hidrolizar enpresencia de un ácido un compuesto seleccionado […]
Síntesis de trietilentetraminas, del 25 de Diciembre de 2013, de PhilERA New Zealand Limited: Proceso para la preparación de trietilentetramina o sales de trietilentetramina, que comprende hidrolizar enpresencia de un ácido un compuesto seleccionado […]
Catalizador de paladio soportado y proceso para producir el mismo, del 27 de Septiembre de 2013, de EVONIK DEGUSSA GMBH: Proceso para producir un catalizador de metal noble soportado, en el cual se ha aplicado al soporte clorurode paladio, que está envuelto […]
Procedimiento de preparación de neramexane, del 18 de Septiembre de 2013, de MERZ PHARMA GMBH & CO. KGAA: Procedimiento de preparación de 1-amino-1,3,3,5,5-pentametilciclohexano o una sal farmacéuticamente aceptabledel mismo, que comprende al menos […]