PROCEDIMIENTO PARA FIJAR MOLÉCULAS EFECTORAS A PROTEÍNAS.
Un procedimiento para fijar una o varias moléculas efectoras a una o a varias cisteínas en una proteína que comprende:
a) activar una o varias cisteínas en la proteína mediante diafiltración de la proteína frente a un agente reductor monotiol o un agente reductor multitiol que es incapaz de formar puentes disulfuro intramoleculares y b) hacer reaccionar la proteína tratada con una molécula efectora
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2006/002416.
Solicitante: UCB PHARMA, S.A..
Nacionalidad solicitante: Bélgica.
Dirección: 60, ALLÉE DE LA RECHERCHE 1070 BRUSSELS BELGICA.
Inventor/es: HEYWOOD,Sam Philip,UCB Celltech.
Fecha de Publicación: .
Fecha Solicitud PCT: 29 de Junio de 2006.
Clasificación Internacional de Patentes:
- A61K47/48H4P
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61K47/48
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2361096_T3.pdf





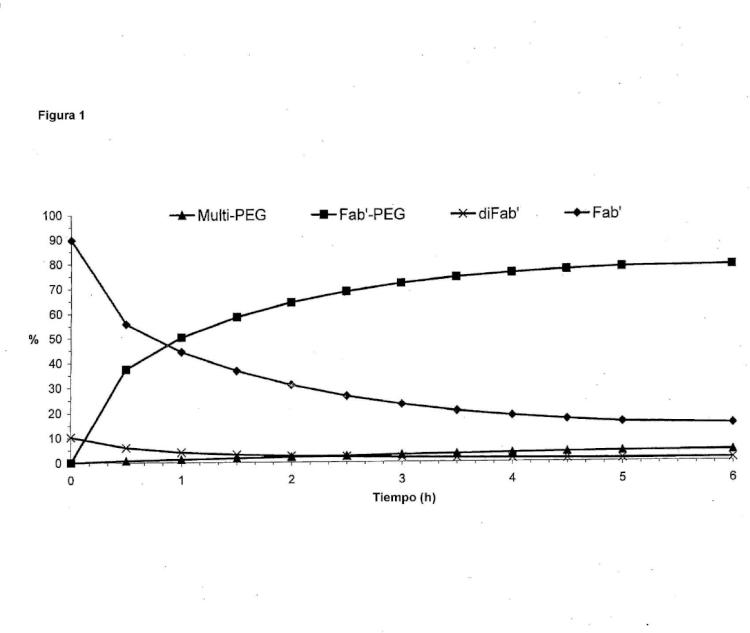
Fragmento de la descripción:
40
45
50
55
La presente invención se refiere a procedimientos para fijar moléculas efectoras a proteínas y más específicamente proporciona un procedimiento mejorado para la fijación específica del sitio de una o varias moléculas efectoras a una o a varias cisteínas en una proteína.
Las proteínas con moléculas efectoras fijadas se utilizan para una variedad de fines diferentes que incluyen los usos de diagnóstico y terapéuticos. La alta especificidad y afinidad, por ejemplo, de las regiones variables de un anticuerpo, las convierte en agentes ideales de diagnóstico y terapéuticos, particularmente para modular interacciones proteína:proteína. La función de dirigir hacia una diana, codificada en los fragmentos Fv, Fab, Fab', F(ab)2 y en otros fragmentos de anticuerpo, se puede conjugar con una o varias moléculas efectoras, tales como fármacos citotóxicos, toxinas o moléculas poliméricas para incrementar la eficacia. Por ejemplo, puesto que estos fragmentos carecen de una región Fc, tienen una semivida en la circulación corta en animales, pero esto se puede mejorar mediante la conjugación con ciertos tipos de polímero, tal como polietilenglicol (PEG). El incremento del tamaño del PEG conjugado se ha observado que incrementa la semivida en la circulación desde minutos hasta muchas horas y se ha mostrado la modificación de un Fab' con PEG en el intervalo de 5 kDa hasta 100 kDa (Chapman y col., 1999, Nature Biotechnology, 17,780-783; Leong y col., 2001, Cytokine, 16,106-119; Chapman, 2002, Advanced Drug Delivery Reviews, 54, 531-545). Los fragmentos de anticuerpo PEGilados, tales como CDP870, se están utilizando actualmente en ensayos clínicos, en donde el efecto del PEG conjugado es conseguir que la semivida en la circulación llegue a niveles que sean aceptables para terapia.
Las moléculas efectoras se pueden fijar a una proteína a través de un grupo reactivo en la proteína que puede tener lugar de forma natural en la proteína o se introduce artificialmente mediante modificación de la proteína. Tales grupos incluyen aminas (lisina), tioles (cisteína, metionina), fenoles (tirosina), ácidos carboxílicos (ácido aspártico, ácido glutámico) u otras cadenas laterales de aminoácidos. El sitio de la fijación de las moléculas efectoras puede ser al azar
o específico del sitio, aunque la fijación específica del sitio se prefiere generalmente.
El residuo de tiol procedente del aminoácido cisteína que contiene azufre, es un grupo reactivo empleado generalmente que se puede utilizar para el acoplamiento selectivo de moléculas efectoras a proteínas. La fijación específica del sitio, por ejemplo, de moléculas efectoras a anticuerpos se consigue, en general, mediante la fijación de residuos de cisteína, puesto que tales residuos son relativamente poco comunes en fragmentos de anticuerpo. Las regiones bisagra de los anticuerpos son regiones comunes para la fijación específica del sitio, puesto que contienen residuos de cisteína y están alejadas de otras regiones del anticuerpo que probablemente están implicadas en la unión al antígeno. Las regiones bisagra adecuadas están presentes de forma natural o se pueden crear empleando técnicas de ADN recombinante (véanse, por ejemplo, los documentos US 5.677.425; WO98/25971; Leong y col., 2001 Cytokine, 16,106-119; Chapman y col., 1999 Nature Biotechnology, 17, 780-783). Alternativamente, las cisteínas específicas del sitio se pueden modificar en el fragmento de anticuerpo, por ejemplo, para crear cisteína(s) expuesta(s) a la superficie (documento US 5.219.996).
Cuando las moléculas efectoras se tienen que fijar de forma específica del sitio, a través de una cisteína, el tiol diana en la proteína está recubierto frecuentemente con un producto peptídico pequeño relacionado con la fermentación, tal como glutatión o está recubierto deliberadamente con un aditivo químico empleado durante la extracción de la proteína
(p. ej., un fragmento de anticuerpo) y la purificación, tal como 5,5'-ditiobis (ácido 2-nitrobenzoico) (DTNB). Los agentes de recubrimiento se tienen que eliminar para activar el tiol diana, antes de que se pueda fijar una molécula efectora. En muchos casos, es deseable activar selectivamente una o varias cisteínas diana para fijar la molécula efectora, sin reducir otras cisteínas dentro de la proteína. Por ejemplo, los fragmentos de anticuerpo Fab' tienen un enlace disulfuro intercatenario natural, entre las regiones constantes de la cadena pesada y ligera (CH1 y CL) y de este modo reducen selectivamente una cisteína diana en otro lugar en el anticuerpo, p. ej., la región bisagra, la reducción se tiene que realizar con mucho cuidado para que el disulfuro entre CL:CH1 permanezca intacto y se evite la fijación de moléculas efectoras en las cisteínas intercatenarias. Por consiguiente, se emplean convencionalmente condiciones de reducción 'suaves' para eliminar el agente de recubrimiento del tiol y activar los tioles diana, antes de la reacción con una molécula efectora. Esta reducción suave se consigue generalmente incubando el fragmento de anticuerpo con un reductor a base de tiol, tal como º-mercaptoetanol (º-ME), º-mercaptoetilamina (º-MA) o ditiotreitol (DTT) (véase, por ejemplo, el documento EP0948544). Después de la reducción y la reacción con las moléculas efectoras (bajo esas condiciones), una gran parte de los fragmentos de anticuerpo no tienen ninguna molécula efectora fijada y éstas se tienen que purificar de forma aparte a los fragmentos de anticuerpo que tienen el número correcto de moléculas efectoras fijadas. Esta baja eficacia de la fijación de moléculas efectoras puede ser una desventaja durante la producción a gran escala de fragmentos de anticuerpo terapéuticos modificados, en donde es importante conseguir una eficacia de producción máxima.
La presente invención proporciona un procedimiento mejorado para la fijación selectiva de una o varias moléculas efectoras a una o a varias cisteínas en una proteína. En el procedimiento de la presente invención, una gran proporción de proteína está modificada correctamente, comparada con los métodos de la técnica anterior, incrementado de forma significativa la eficacia de la fijación de moléculas efectoras.
40
45
50
55
Por lo tanto, la presente invención proporciona un procedimiento para fijar una o varias moléculas efectoras a una o a varias cisteínas en una proteína que comprende:
a) activar una o varias cisteínas en una proteínas mediante la diafiltración de la proteína frente a un agente reductor monotiol o un agente reductor multitiol que es incapaz de formar puentes disulfuro intramoleculares y
b) hacer reaccionar la proteína tratada con una molécula efectora.
El término 'proteína' tal y como se emplea en esta memoria, incluye proteínas, polipéptidos y fragmentos de los mismos que contienen una o varias cisteínas que se pueden utilizar para la fijación de moléculas efectoras. Las proteínas se pueden modificar, p. ej., para producir variantes y fragmentos de los mismos, mientras que se conserve cuando sea necesario, la propiedad biológica deseada (p. ej., la capacidad de unirse a un sitio diana). Las proteínas se pueden modificar empleando diversas técnicas de ingeniería genética o proteica, por ejemplo, para introducir cisteínas en la proteína para emplear como sitios para la fijación de las moléculas efectoras. Por tanto, las cisteínas empleadas para la fijación de las moléculas efectoras pueden estar presentes de forma natural en la proteína y/o se pueden modificar en la proteína mediante técnicas de ADN recombinante. Por ello, el número y la posición de las cisteínas disponibles para la fijación de las moléculas efectoras, se pueden controlar específicamente dependiendo del uso destinado a la proteína y el número de moléculas efectoras necesarias.
Ejemplos de proteínas adecuadas incluyen, pero no están limitados a los mismos, enzimas, hormonas, anticuerpos, receptores, factores de crecimiento, proteínas séricas, tales como albúmina, lipoproteínas y fibrinógeno, enzimas fibrinolíticas, tales como activador tisular del plasminógeno (t-PA), estreptocinasa y urocinasa, modificadores de la respuesta biológica, tales como interleucinas, interferones y factores estimuladores de las colonias, eritropoyetina y hormonas peptídicas, tales como la hormona luteinizante, la hormona del crecimiento, gastrina, hormona estimuladora del folículo, TSH, ACTH, proteínas... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para fijar una o varias moléculas efectoras a una o a varias cisteínas en una proteína que comprende:
a) activar una o varias cisteínas en la proteína mediante diafiltración de la proteína frente a un agente reductor 5 monotiol o un agente reductor multitiol que es incapaz de formar puentes disulfuro intramoleculares y
b) hacer reaccionar la proteína tratada con una molécula efectora.
2. El procedimiento de acuerdo con la reivindicación 1, en donde un agente reductor monotiol o un agente reductor multitiol que es incapaz de formar puentes disulfuro intramoleculares, está presente en la muestra de proteína antes de la etapa (a).
10 3. El procedimiento de acuerdo con la reivindicación 2, en el que la concentración de agente reductor en la muestra de proteína está entre 0,5 y 1,5 veces la concentración de agente reductor en el tampón de diafiltración.
4. El procedimiento de acuerdo con la reivindicación 3, en el que la concentración de partida de agente reductor en la muestra de proteína es la misma que la concentración de agente reductor en el tampón de diafiltración.
5. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-4, en el que la concentración de 15 agente reductor es 1 mM.
6. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-5, en el que el agente reductor se retira de la muestra de proteína entre la etapa (a) y la etapa (b).
7. El procedimiento de acuerdo con la reivindicación 6, en el que el agente reductor se elimina por filtración en gel.
20 8. El procedimiento de acuerdo con la reivindicación 6, en el que el agente reductor se elimina por diafiltración.
9. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-8, en el que el agente reductor se selecciona entre º-mercaptoetilamina, º-mercaptoetanol, glutatión o cisteína.
10. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-9, que comprende adicionalmente la etapa (c) en la que la proteína con el número deseado de moléculas efectoras fijadas.
25 11. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-10, en el que se purifica la proteína es un anticuerpo o un fragmento del mismo.
12. El procedimiento de acuerdo con la reivindicación 11, en el que la proteína es un fragmento de anticuerpo Fab'.
13. El procedimiento de acuerdo con la reivindicación 11 o la reivindicación 12, en el que al menos una cisteína a la que se ha fijado una molécula efectora está presente en la región bisagra del anticuerpo.
30 14. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 11-13, en el que cada cisteína a la que se ha fijado una molécula efectora está presente en la región bisagra del anticuerpo.
15. El procedimiento de acuerdo con una cualquiera de las reivindicaciones 1-14, en el que la molécula efectora es PEG.
16. El procedimiento de acuerdo con la reivindicación 15, en el que la molécula efectora es PEG-maleimida 40.000.
Patentes similares o relacionadas:
INTERLEUCINA-10 PEGILADA, del 10 de Noviembre de 2011, de SCHERING CORPORATION: Una interleucina-10 monopegilada (mono-PEG-IL-10) que comprende una o varias moléculas de polietilenglicol (PEG) unidas covalentemente mediante un conector a un resto […]
COPOLÍMERO DE BLOQUES PARA CONJUGADOS DE FÁRMACO Y SUS COMPOSICIONES FARMACÉUTICAS, del 20 de Septiembre de 2011, de NANOCARRIER CO., LTD: Un copolímero de bloques para un conjugado de fármaco, comprendiendo dicho copolímero una región de polímero soluble en agua que consiste en polietilenglicol y una […]
NUEVAS COMPOSICIONES QUÍMICAMENTE MODIFICADAS DE PROTEÍNA QUE ESTIMULAN ERITROPOYETINA Y MÉTODOS, del 20 de Septiembre de 2011, de AMGEN INC.: Una preparación de nueva proteína estimulante de eritropoyetina químicamente modificada (NESP), opcionalmente en un diluyente, portador o […]
ANTAGONISTAS DE LEPTINA, del 18 de Julio de 2011, de YISSUM RESEARCH DEVELOPMENT COMPANY OF THE HEBREW UNIVERSITY OF JERUSALEM LTD. INSTITUT NATIONAL DE LA RECHERCHE AGRONOMIQUE (INRA) UNIVERSITÉ PIERRE ET MARIE CURIE (PARIS VI): Un antagonista de leptina sintético que consiste en: (a) un polipéptido de leptina de mamífero en el que el sitio de unión hidrófobo LDFI en las posiciones correspondientes […]
 INHIBIDORES DUALES ANTITROMBÓTICOS ANTICOAGULANTES QUE COMPRENDEN UNA MARCA DE BIOTINA, del 27 de Junio de 2011, de N. V. ORGANON: Un compuesto antitrombótico de fórmula I oligosacárido-espaciador-antagonista de GpIIb/IIIa (I), donde el oligosacárido es un residuo de pentasacárido cargado […]
INHIBIDORES DUALES ANTITROMBÓTICOS ANTICOAGULANTES QUE COMPRENDEN UNA MARCA DE BIOTINA, del 27 de Junio de 2011, de N. V. ORGANON: Un compuesto antitrombótico de fórmula I oligosacárido-espaciador-antagonista de GpIIb/IIIa (I), donde el oligosacárido es un residuo de pentasacárido cargado […]
 CONJUGADOS DE ERITROPOYETINA (EPO) CON POLIETILENGLICOL (PEG), del 22 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Conjugado, comprendiendo dicho conjugado una glucoproteína eritropoyetina que presenta un grupo α-amino Nterminal y que presenta la actividad biológica in […]
CONJUGADOS DE ERITROPOYETINA (EPO) CON POLIETILENGLICOL (PEG), del 22 de Junio de 2011, de F. HOFFMANN-LA ROCHE AG: Conjugado, comprendiendo dicho conjugado una glucoproteína eritropoyetina que presenta un grupo α-amino Nterminal y que presenta la actividad biológica in […]
 CONJUGADOS DE PEG-OXIDASA DE URATO Y SU USO, del 14 de Junio de 2011, de MOUNTAIN VIEW PHARMACEUTICALS, INC. DUKE UNIVERSITY: Un conjugado compuesto por una uricasa purificada conjugada a un poli(etilenglicol) (PEG), en la que al menos el 90% de dicha uricasa se halle en una forma tetramérica
CONJUGADOS DE PEG-OXIDASA DE URATO Y SU USO, del 14 de Junio de 2011, de MOUNTAIN VIEW PHARMACEUTICALS, INC. DUKE UNIVERSITY: Un conjugado compuesto por una uricasa purificada conjugada a un poli(etilenglicol) (PEG), en la que al menos el 90% de dicha uricasa se halle en una forma tetramérica
Formulaciones estabilizadas que contienen anticuerpos anti-receptor de interleucina 4 (IL-4R), del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Una jeringuilla precargada que contiene una formulación farmacéutica líquida estable, en la que la formulación farmacéutica líquida comprende: […]