PROCEDIMIENTO PARA FABRICAR IOHEXOL.
Un procedimiento para producir iohexol, cuyo procedimiento comprende alquilar la 5-acetamido-N,
N'-bis(2,3dihidroxipropil)-2,4,6-triyodoisoftalamida usando 2-(2-metoxietoxi)etanol como disolvente, en presencia de una base, y opcionalmente aislar el iohexol bruto de la mezcla de reacción.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2006/000768.
Solicitante: HOVIONE INTER AG.
Nacionalidad solicitante: Suiza.
Dirección: BAHNHOFSTRASSE 21 6000 LUCERNE 7 SUIZA.
Inventor/es: HEGGIE, WILLIAM, GALINDRO, JOSE, MARTO,Susana, BANDARRA,João António Moínho.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C233/69 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 233/00 Amidas de ácidos carboxílicos. › de una estructura carbonada acíclica saturada.
PDF original: ES-2375494_T3.pdf
Fragmento de la descripción:
Procedimiento para fabricar iohexol.
La presente invención se refiere a un procedimiento para fabricar iohexol, 5-[N- (2, 3-dihidroxipropil) -acetamido]-N, N'bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida.
El iohexol es uno de los agentes de contraste yodados no iónicos para rayos X usado con más frecuencia. En la fabricación del iohexol está implicada una síntesis de múltiples etapas.
Se han descrito varios métodos en la bibliografía para la síntesis del iohexol. Dado que la dosis de iohexol que se administra en un periodo de tiempo corto, puede ser de hasta o incluso más de 100 g, es de gran importancia el uso de disolventes de baja toxicidad en la última etapa, ya que se espera que quede siempre algo de disolvente residual, incluso en niveles bajos, en el producto final. Desde un punto de vista industrial, cuando se lleva a cabo la última etapa del procedimiento se prefieren disolventes tanto fácilmente disponibles como de baja toxicidad. Se requiere una etapa de purificación y cristalización eficaz e industrialmente viable, no solo para obtener un producto en el que se mantengan las impurezas a un nivel mínimo sino también en el que los niveles de disolventes residuales sean muy bajos. El uso de 2-metoxietanol y mezclas de 2-metoxietanol/isopropanol y un disolvente elegido de un éter monoalquilico C1-C5 de un alquilenglicol C3-C10, se describen respectivamente en los documentos WO 98/08804 y WO 2005/003080 como disolventes de reacción en los que se lleva a cabo la N-alquilación del átomo de nitrógeno de la 5-acetamido-N, N'- bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida.
De acuerdo con procedimientos definidos en la técnica anterior, después de completarse la reacción, el iohexol bruto se aísla por eliminación del disolvente de alto punto de ebullición tal como el 2-metoxietanol, normalmente por destilación, seguido de purificación del producto bruto por métodos conocidos, y finalmente por cristalización en un alcohol adecuado como se describe en el documento US-6.469.208 y referencias citadas en el mismo, o en mezclas de disolventes que incluyen disolventes de reacción de alto punto de ebullición y alcoholes tales como metanol como se describe en el documento WO 2005/003080 o 1-metoxi-2-propanol solo o mezclado con otros disolventes tales como isopropanol como se reivindica en el documento US-6.897.339.
Industrialmente, la eliminación de disolventes de alto punto de ebullición es una operación que requiere tiempo y energía. También hay un mayor riesgo de que se degrade el producto si están implicadas altas temperaturas durante esta etapa de concentración. Además, desde un punto de vista medioambiental, debe eliminarse tanto la corriente acuosa como la orgánica del procedimiento, aumentando los costes considerablemente.
Se prefiere el uso de un disolvente más conveniente en la etapa de reacción, que se elimine fácilmente y que permita aislar el iohexol bruto de una forma sencilla, preferiblemente por precipitación de la mezcla de reacción con un no disolvente que se elimine fácilmente mediante un tratamiento posterior. De acuerdo con el procedimiento de la presente invención, el iohexol bruto se aísla por precipitación. El resto de las etapas del procedimiento, hasta la cristalización final son esencialmente en medio acuoso, lo cual es más deseable tanto industrial como medioambientalmente. Una ventaja adicional es que se reduce el coste general del procedimiento de fabricación.
Habiendo valorado las necesidades anteriores, los autores de la invención ahora han encontrado que, sorprendentemente, el 2- (2-metoxietoxi) etanol satisface los requisitos señalados antes.
Por consiguiente, la presente invención proporciona un procedimiento para producir iohexanol, cuyo procedimiento comprende alquilar la 5-acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida usando 2- (2metoxietoxi) etanol como disolvente en presencia de una base, y opcionalmente aislar el iohexanol bruto de la mezcla de reacción.
Cuando se usa el 2- (2-metoxietoxi) etanol junto con un no disolvente de menor punto de ebullición como acetona, 4metilpentan-2-ona, 2-metilpropan-1-ol, propan-2-ol o acetato de isopropiolo en la etapa de aislamiento, el iohexol bruto puede precipitar directamente de la mezcla de reacción. Después, el 2- (2-metoxietoxi) etanol se puede separar eficazmente del sólido por filtración seguido de lavado de la torta de filtración con el disolvente de bajo punto de ebullición elegido. Los disolventes conocidos de la técnica anterior, tales como el 2-metoxietanol estructuralmente similar, no se pueden usar en este procedimiento debido a la formación de sólidos gomosos. Por lo tanto, el iohexol bruto se filtra, se lava con el no disolvente para eliminar el resto del disolvente de reacción y otras impurezas de la reacción. Una ventaja añadida es que el rendimiento del iohexol recuperado es casi cuantitativo. Después, la torta de filtración se disuelve en agua y se eliminan las sales formadas durante la reacción, usando las resinas de intercambio iónico. Después de purificación adicional, si es necesario, se elimina el agua y el iohexol se puede cristalizar en etanol usando las condiciones descritas en el documento US-6.469.208.
Otra ventaja inesperada que confiere el uso de 2- (2-metoxietoxi) etanol en el procedimiento, es que es sorprendentemente muy eficaz como disolvente de reacción para la producción de iohexol. Algunos de los beneficios son: la reacción se puede llevar a cabo en una concentración alta; la reacción se puede llevar a cabo a temperaturas más bajas reduciendo así la descomposición y formación de subproductos; es necesario menos disolvente y por lo tanto se reducen significativamente las corrientes residuales. El 2- (2-metoxietoxi) etanol es un disolvente excelente para la 5-acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida basificada, y la disolución se logra después de 1 ó 2 horas de agitación en las condiciones descritas a continuación. Esta es una mejora importante frente a la técnica anterior, porque el método de la presente invención reduce el tiempo que la 5-acetamido-N, N'bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida está en contacto con la base a altas temperaturas antes de añadir el agente de alquilación, reduciendo por lo tanto la potencial formación de impurezas. Normalmente, en la técnica anterior (véase los ejemplos descritos en el documento WO 2005/003080) , la 5-acetamido-N, N'-bis (2, 3dihidroxipropil) -2, 4, 6-triyodoisoftalamida se agita a 45º C durante una noche. La fase inicial prolongada de la reacción implica tiempos de procesamiento más largos. El procedimiento de la presente invención requiere tiempos mucho más cortos y el punto final típico para que se complete la reacción, momento en el que se inactiva la reacción, tarda menos de 24 horas. Esto da como resultado una reducción de las impurezas que resultan de las reacciones de Oalquilación y otras impurezas de diversos procesos.
En el procedimiento de la presente invención, se deja reaccionar la 5-acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6triyodoisoftalamida con un agente de alquilación, que es preferiblemente el 3-cloropropano-1, 2-diol, en 2- (2metoxietoxi) etanol (el disolvente de reacción) , preferiblemente en una concentración de 25% a 40% (p/p) con respecto al disolvente, adecuadamente de 25º C a 33º C, durante preferiblemente de 18 a 24 horas. Por lo tanto, la 5acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida se suspende en 2- (2-metoxietoxi) etanol y se añade una base, que preferiblemente es una disolución acuosa concentrada de un hidróxido de metal alcalino, más preferiblemente hidróxido sódico, adecuadamente a una temperatura de 40 a 60º C, preferiblemente de 50 a 55º C, para producir la disolución. La concentración de la base, por ejemplo disolución de hidróxido sódico, es preferiblemente entre 59 y 73% en peso/volumen de agua, más preferiblemente entre 65 y 67%. La disolución se logra típicamente después de aproximadamente 1 a 2 horas de agitación a temperaturas entre 40 y 60º C. Después de enfriar preferiblemente a una temperatura de 25 a 35º C, se añade el agente alquilante, por ejemplo 3cloropropano-1, 2-diol, y se deja que la reacción avance, adecuadamente a una temperatura de 25 a 35º C, preferiblemente de 29 a 31º C, hasta lograr el nivel de conversión deseado.
Tras completarse la reacción, el pH de la mezcla se ajusta normalmente a menos de 7, preferiblemente de 5 a 6, por adición de un ácido adecuado, por ejemplo ácido clorhídrico o ácido... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para producir iohexol, cuyo procedimiento comprende alquilar la 5-acetamido-N, N'-bis (2, 3dihidroxipropil) -2, 4, 6-triyodoisoftalamida usando 2- (2-metoxietoxi) etanol como disolvente, en presencia de una base, y opcionalmente aislar el iohexol bruto de la mezcla de reacción.
2. Un procedimiento de acuerdo con la reivindicación 1, en el que al agente alquilante es el 1-cloro-2, 3propanodiol.
3. Un procedimiento de acuerdo con la reivindicación 1 ó 2, en el que el disolvente se usa en una relación de 1 ml a 3 ml por gramo de 5-acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida.
4. Un procedimiento de acuerdo con la reivindicación 1, 2 ó 3, en el que la base es un hidróxido de metal alcalino, tal como hidróxido sódico o hidróxido potásico.
5. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 4, en el que se añade una disolución acuosa de la base a una suspensión de 5-acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida en el disolvente.
6. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en el que la concentración de base es de 59 a 73%, expresada como peso por volumen.
7. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que la cantidad de base añadida es de 71 mg a 78, 5 mg por gramo de 5-acetamido-N, N'-bis (2, 3-dihidroxipropil) -2, 4, 6-triyodoisoftalamida.
8. Un procedimiento de acuerdo con la reivindicación 5, 6 ó 7, en el que la temperatura de la mezcla de reacción se ajusta de 40 a 60º C y se agita hasta alcanzar la disolución.
9. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 8, en el que la reacción de alquilación se lleva a cabo de 25º C a 35º C.
10. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 9, en el que el pH de la mezcla de reacción después de completarse la reacción se ajusta de 5 a 7 con un ácido.
11. Un procedimiento de acuerdo con la reivindicación 10, en el que el ácido es ácido clorhídrico o ácido acético.
12. Un procedimiento de acuerdo con la reivindicación 10 u 11, en el que el contenido de agua se ajusta por debajo de 1% por destilación a vacío o azeotrópica.
13. Un procedimiento de acuerdo con una cualquiera de las reivindicaciones 1 a 12, que además comprende aislar el iohexol bruto por precipitación con un no disolvente que es acetona, 4-metilpentan-2-ona, 2-metilpropan-1-ol, propan-2-ol o acetato de isopropilo.
14. Un procedimiento de acuerdo con la reivindicación 13, en el que dicho no disolvente comprende acetona, 2metilpropan-1-ol o propan-2-ol.
15. Un procedimiento de acuerdo con la reivindicación 13 ó 14, en el que la mezcla de reacción se añade al no disolvente a una temperatura de 50º C a 75º C.
16. Un procedimiento de acuerdo con la reivindicación 13, 14 ó 15, en el que el iohexol bruto se separa del disolvente por filtración y lavado con el no disolvente.
17. Un procedimiento de acuerdo con la reivindicación 13, 14, 15 ó 16, que además comprende recuperar el no disolvente por destilación y volver a usarlo en el procedimiento.
Patentes similares o relacionadas:
Componente de formulación, del 21 de Marzo de 2018, de SYNGENTA LIMITED: Uso de un compuesto de fórmula (I) como un adyuvante en una composición agroquímica que comprende un principio activo agroquímico**Fórmula** donde m es 1; […]
Agente preventivo o mejorador para la pigmentación, del 31 de Agosto de 2016, de POLA CHEMICAL INDUSTRIES, INC.: Uso de un compuesto representado por la siguiente fórmula general , un estereoisómero del mismo, y/o una sal farmacológicamente aceptable del mismo, para […]
Proceso para la yodación de compuestos aromáticos, del 22 de Junio de 2016, de BRACCO IMAGING S.P.A.: Un proceso para la preparación de 2,4,6-triyodofenoles 3,5-disustituidos de fórmula , proceso que comprende: (a) generar electroquímicamente cationes I+ a partir […]
Moduladores de receptores de cannabinoides, del 22 de Agosto de 2013, de UCL BUSINESS PLC: Compuesto de fórmula I, o una sal farmacéuticamente aceptable del mismo, **Fórmula** en la que: Z es NR1R2 en el que cada uno de R1 y R2 es […]
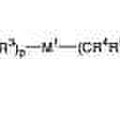 Tioamidas y sus sales e inhibidores de la producción de citoquinas que contienen ambos, del 2 de Mayo de 2012, de ISHIHARA SANGYO KAISHA, LTD.: Un compuesto tioamida representado por la fórmula (I) o una sal del mismo:
donde A es un átomo de nitrógeno, N-óxido, C-NO2 O C-CN; Hal […]
Tioamidas y sus sales e inhibidores de la producción de citoquinas que contienen ambos, del 2 de Mayo de 2012, de ISHIHARA SANGYO KAISHA, LTD.: Un compuesto tioamida representado por la fórmula (I) o una sal del mismo:
donde A es un átomo de nitrógeno, N-óxido, C-NO2 O C-CN; Hal […]
 MODULADORES DE RECEPTORES CANNABINOIDES, del 9 de Marzo de 2010, de UCL BUSINESS PLC: Compuesto que se selecciona de entre las siguientes fórmulas:
MODULADORES DE RECEPTORES CANNABINOIDES, del 9 de Marzo de 2010, de UCL BUSINESS PLC: Compuesto que se selecciona de entre las siguientes fórmulas:
PROCEDIMIENTO PARA LA PREPARACION DE BETA-HIDROXIALQUILAMIDAS, del 25 de Febrero de 2010, de EMS CHEMIE AG: Procedimiento para la preparación de ß-hidroxialquilamidas de la fórmula general I **(Ver fórmula)** en la que R1 es H o un alquilo C1 a C10 lineal o ramificado […]
COMPUESTOS DE AMIDA Y SU USO, del 17 de Noviembre de 2009, de SUMITOMO CHEMICAL COMPANY, LIMITED: Un compuesto de amida representado por la fórmula **(Ver fórmula)** en la que X1 representa un átomo de flúor o un grupo metoxi, X2 representa un átomo de hidrógeno, […]