PROCEDIMIENTO PARA DETERMINAR ÁCIDOS NUCLEICOS MEDIANTE FLUORESCENCIA.
Un procedimiento para determinar la cantidad de ácido nucleico presente en una muestra,
en el que: - se añade un fluoróforo a la muestra, - se miden las intensidades de fluorescencia emitidas por el fluoróforo en al menos dos longitudes de onda de emisión en respuesta a las estimulaciones lumínicas en al menos dos longitudes de onda de excitación, y - se deduce la cantidad de ácido nucleico presente en la muestra a partir de al menos dos intensidades de fluorescencia medidas
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2007/002316.
Solicitante: BIOQUANTA
ASSISTANCE PUBLIQUE - HÔPITAUX DE PARIS
BIOQUANTA CORP.
Nacionalidad solicitante: Francia.
Dirección: 5 RUE L'ABBE DE L'EPEE 75005 PARIS FRANCIA.
Inventor/es: SACKO,Mory, DELACOTTE,Nicolas, BAH,Mamadou saliou, CONTI,Marc.
Fecha de Publicación: .
Fecha Solicitud PCT: 10 de Agosto de 2007.
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
- C12Q1/68B2
- G01J3/44B
- G01N21/64H
Clasificación PCT:
- C12Q1/68 C12Q 1/00 […] › en los que intervienen ácidos nucleicos.
- G01N21/64 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 21/00 Investigación o análisis de los materiales por la utilización de medios ópticos, es decir, utilizando rayos infrarrojos, visibles o ultravioletas (G01N 3/00 - G01N 19/00 tienen prioridad). › Fluorescencia; Fosforescencia.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358480_T3.pdf




Fragmento de la descripción:
La presente invención se refiere a un procedimiento fluorimétrico para determinar la cantidad de ácido nucleico presente en una muestra, a un fluorímetro adecuado para la realización de dicho procedimiento y a una cubeta para un ensayo de fluorescencia de un compuesto.
Es conocida la existencia de ácidos nucleicos libres circulando en la sangre desde hace varios años [Mandel y Métais; 1947; Tan y col., 1966]. Desde ese momento, se ha encontrado usando procesos como el RIA (inmunoensayo radiactivo) que los pacientes que sufren cáncer tienen un elevado nivel de ADN en circulación en relación con aquellos que sufren tumores benignos o en relación con sujetos sanos [Leon y col., 1977; Shapiro y col., 1983].
Sin embargo, en estos últimos años, con el desarrollo de procesos de biología molecular muy eficaces, como la PCR en tiempo real, se ha observado un interés creciente en los fragmentos de ADN circulante con miras a su uso como un marcador biológico clínico.
El ADN extraído del plasma de pacientes con cáncer normalmente tiene características de ADN tumoral [Anker
P. y col., 1999], tal como inestabilidad de cadena, la presencia de oncogenes específicos, genes supresores de tumores y alteraciones de microsatélites. La idea de que este ADN circulante se origina en las células tumorales fue asumida por Kok y col. [De Kok y col., 1997] quienes publicaron que el ADN que deriva de los tumores, caracterizado por alteraciones específicas, podría estar en el suero de los pacientes que sufren un tumor colorrectal. Así, estos autores detectaron determinadas mutaciones puntuales K-ras en el ADN del suero que previamente se habían identificado en el tumor principal. Es por esto que la mayoría de los estudios de ADN circulante se centraron en la detección de mutaciones, pérdida de heterocigosidad, mutaciones de microsatélites y la metilación del ADN extraído de los tumores (tejidos) o suero de pacientes que sufrían diversos tipos de cánceres. Las mutaciones de microsatélites y las inestabilidades detectadas en el ADN genómico libre del suero sugieren que este podría ser un posible nuevo marcador, con una especificidad considerable para el seguimiento de tumores.
Más recientemente, un gran número de estudios han intentado utilizar el mero aumento de la concentración de ADN circulante genómico o no genómico como marcador diagnóstico o un marcador del desarrollo precoz de cáncer de mama y de pulmón y también para el control e inspección de pacientes que ya han recibido tratamiento con quimioterapia [Sozzi y col., 2001]. Esta determinación podría eliminar, o al menos reducir, la necesidad de procedimientos más invasivos, tales como biopsias. También podría ser útil en la selección de cánceres específicos en estadio inicial, tales como cánceres de pulmón [Sozzi y col., 2003], mama [Gal y col., 2004] o próstata [Boddy y col., 2005; Jung y col., 2004]. Finalmente, también podría usarse como complemento del análisis de marcadores utilizados frecuentemente para controlar pacientes que sufren cánceres o se someten a quimioterapia, o pacientes que se han sometido a una intervención quirúrgica, han sufrido un traumatismo [Lam y col., 2003] o un infarto de miocardio [Chang y col., 2003].
Hay básicamente dos tipos de ADN circulante en la sangre:
- ADN asociado con las células nucleadas en circulación y
- ADN circulante libre en el plasma.
El ADN genómico en el suero está fragmentado en pacientes que sufren cáncer o han tenido un infarto de miocardio, con la presencia de fragmentos de aproximadamente 100 pares de bases en el caso de carcinomas [Wu y col., 2002] y de aproximadamente 200 pares de bases en el caso del infarto de miocardio [Chang y col., 2003]. Estos fragmentos no se encuentran en la sangre de controles sin patología en los que, además, el ADN en circulación se encuentra a concentraciones muy bajas. Incluso ahora, se sabe muy poco sobre el mecanismo por el cual el ADN se libera al torrente circulatorio. Jahr y col. [Jahr y col., 2001] han propuesto la hipótesis de que las fuentes principales de este ADN son células apoptóticas y necróticas.
Actualmente no existe valor límite de referencia que defina la concentración de este ADN circulante en sujetos sanos. Diversos estudios han intentado aproximarse a este umbral, pero es muy difícil comparar estos como metodologías, y los resultados obtenidos difieren en muchos niveles. Además, las unidades utilizadas varían de un estudio a otro: ng/ml; número de copias/ml; equivalente de genoma/ml (la cantidad de ADN contenido en una célula diploide se estima en 6,6 picogramos/ml), etc.
Muchos grupos de investigación han determinado el nivel de ADN circulante buscando una posible aplicación en el pronóstico, en particular intentando establecer correlaciones con los marcadores diagnósticos convencionales. Hasta la fecha, todos los estudios han coincidido en que los niveles medios de ADN son sustancialmente más elevados en pacientes con cáncer que en controles sanos, independientemente del suero o plasma utilizado. Sin embargo, las cantidades absolutas medidas varían entre estudios. Esta diferencia podría estar ligada al tipo de cáncer analizado y a las diversas metodologías utilizadas. Los niveles de ADN medidos en el plasma son menores que los medidos en el suero, como confirman los mayores volúmenes de datos publicados [Thijssen y col., 2002]. Con respecto al significado clínico, al menos dos publicaciones describen una correlación entre los niveles de ADN y factores pronósticos conocidos. En cánceres pulmonares (microcíticos y no microcíticos), existe una estrecha correlación entre los niveles de ADN en plasma y la actividad de la LDH del suero y de la enolasa específica de neuronas (NSE), con relaciones similares entre cada marcador y la supervivencia del paciente [Fournié y col., 1995]. De modo similar, los niveles de ADN se han correlacionado con el estadio clínico en el caso de metástasis de los ganglios linfáticos y el tamaño del tumor en pacientes que sufren cáncer de mama [Shao y col., 2001]. Finalmente, es importante recordar que la fracción de ADN circulante debido a la contribución de los tumores varía considerablemente de un paciente a otro [Jahr y col., 2001].
Un gran número de procesos para determinar ácidos nucleicos en solución están disponibles hoy en día y permiten, dependiendo del procedimiento, la adaptación a las diversas necesidades de médicos e investigadores. Estos procesos incluyen, principalmente, espectrofotometría [Greenstock y col., 1975]: un procedimiento utilizado con mucha frecuencia en todos los laboratorios de investigación y que presenta la ventaja de ser barato pero el inconveniente, importante en la práctica clínica, de ser extremadamente insensible no permite medir las cantidades de ADN circulante en los pacientes.
Hay otros procesos más sensibles, aunque todos ellos tienen características que hacen que sea más o menos difícil utilizarlos de forma rutinaria, en parte debido a que tienen una fase común la cual es que se extrae el ADN del entorno biológico antes de la determinación:
• Los procesos de radioinmunoensayo [Leon y col., 1975] necesitan un tiempo relativamente largo (varios horas para las series de análisis), tienen que realizarse en una serie de determinaciones y no esporádicamente y, sobre todo, requiere estructuras especializadas y personal autorizado para la manipulación de elementos radiactivos.
• La PCR competitiva [Siebert y col., 1992; Yap y col., 1992], basada en muestras comparativas relativas a patrones conocidos, es la adición de varios procesos en serie que proporcionan sensibilidad y especificidad de detección. Estos procesos son poco prácticos y relativamente confidenciales, por tanto, su uso rutinario en los laboratorios de análisis clínicos es inconcebible en el futuro
• La PCR cuantitativa en tiempo real [Mulder y col., 1994] es el proceso preferido en las diversas publicaciones interesadas en este problema de medir el ADN circulante. Sus ventajas son dobles: es específico del ADN diana que se va a mostrar (en este caso, el ADN humano) y, hoy en día, ya no está reservado a laboratorios de investigación, ya que el equipo puede encontrarse en un gran número de hospitales. Sin embargo, no está libre de inconvenientes: extracción obligatoria, costes de manejo relativamente elevados, equipo específico el cual no puede usarse para análisis rutinarios a gran escala y sensibilidad insuficiente.
• Fluorimetría cuantitativa [Greenstock y col., 1975]. Aunque este no evita la etapa de extracción, permite medir más rápida y directamente... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para determinar la cantidad de ácido nucleico presente en una muestra, en el que:
- se añade un fluoróforo a la muestra,
- se miden las intensidades de fluorescencia emitidas por el fluoróforo en al menos dos longitudes de onda de emisión en respuesta a las estimulaciones lumínicas en al menos dos longitudes de onda de excitación, y
- se deduce la cantidad de ácido nucleico presente en la muestra a partir de al menos dos intensidades de fluorescencia medidas.
2. El procedimiento según la reivindicación 1, en el que el ácido nucleico es de origen natural o sintético.
3. El procedimiento según la reivindicación 1 o la reivindicación 2, en el que el ácido nucleido es ADN o ARN.
4. El procedimiento según una cualquiera de las reivindicaciones 1 a 3, en el que la muestra es de origen natural
o sintético.
5. El procedimiento según una cualquiera de las reivindicaciones 1 a 4, en el que la muestra es una muestra biológica o un derivado de una muestra biológica.
6. El procedimiento según la reivindicación 5, en el que la muestra se deriva de una muestra biológica por dilución.
7. El procedimiento según una cualquiera de las reivindicaciones 1 a 6, en el que la muestra se origina a partir de un paciente que está sufriendo una situación fisiopatológica en la que puede producirse una rotura celular.
8. El procedimiento según cualquiera de las reivindicaciones 5 a 7, en el que la cantidad de ácidos nucleicos que se ha determinado es utilizado en el contexto de la caracterización de la muerte celular.
9. El procedimiento según una cualquiera de las reivindicaciones 1 a 8, en el que el fluoróforo es un agente intercalante de ácidos nucleicos.
10. El procedimiento según una cualquiera de las reivindicaciones 1 a 9, en el que el fluoróforo es Picogreen® ([Nbis-(3-dimetilaminopropil)-amino]-4-[2,3-dihidro-3-metil-(benzo-1,3-tiazol-2-il)-metiliden]-1-fenil-quinolinium]+).
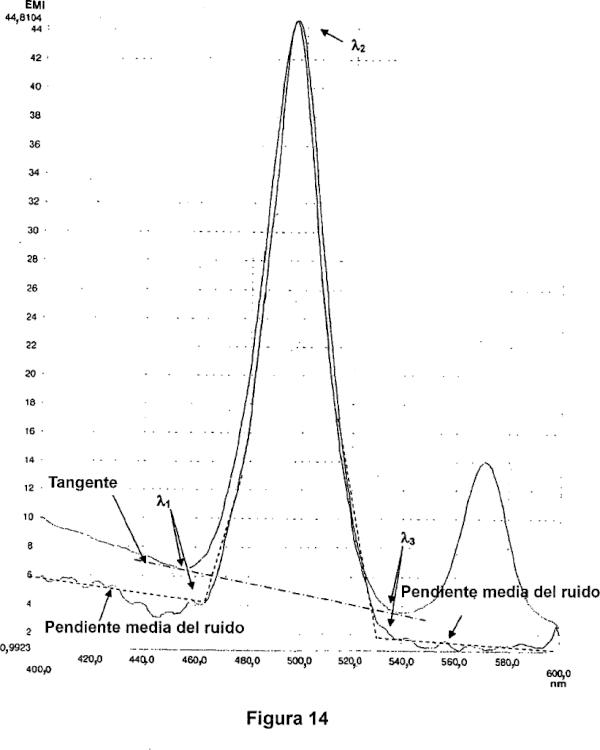
11. El procedimiento según una cualquiera de las reivindicaciones 1 a 10, en el que se miden las intensidades de fluorescencia (I1, I2 e I3), emitidas por el fluoróforo en tres longitudes de onda de emisión λ1, λ2 y λ3 en respuesta a las estimulaciones de luz en tres longitudes de onda de emisión λ′1, λ′2 y λ′3, respectivamente, con λ1<λ2<λ3 y estando predeterminadas λ1, λ2 y λ3.
12. El procedimiento según la reivindicación 11, en el que la cantidad de ácido nucleico se deduce del siguiente valor de F:
I I I I
13 1331
F I
2 2
13 13
13 El procedimiento según la reivindicación 11 o la reivindicación 12, en el que el fluoróforo es Picogreen® y las longitudes de onda son las siguientes:
λ′1=472±10 nm λ1=502±10 nm
λ′2=496±10 nm λ2=526±10 nm
λ′3=538±10 nm λ3=568±10 nm
14. El procedimiento según una cualquiera de las reivindicaciones 1 a 10, en el que se miden respectivamente las intensidades de fluorescencia I1 e I2, emitidas por el fluoróforo en dos longitudes de onda de emisión λ1 y λ2 en respuesta a las estimulaciones lumínicas en dos longitudes de onda de excitación λ′1 y λ′2, respectivamente, estando predeterminadas λ1 y λ2.
15. El procedimiento según la reivindicación 14, en el que la cantidad de ácido nucleico se deduce preferiblemente a partir del valor absoluto de la diferencia entre I1 e I2, es decir, el siguiente valor de F:
F=|I2−I1|
16. El procedimiento según la reivindicación 14 o la reivindicación 15, en el que el fluoróforo es Picogreen® y las longitudes de onda son las siguientes: λ′1=472±10 nm λ1=502±10 nm y λ′2=496±10 nm λ2=526±10 nm o
λ′1=496±10 nm λ1=526±10 nm y λ′2=538±10 nm λ2=568±10 nm.
17. El procedimiento según la reivindicación 12 o la reivindicación 15, en el que la cantidad de ácido nucleico en la muestra se deduce a partir del valor de F usando una curva de calibración.
18. Fluorímetro adecuado para realizar un procedimiento como se define en cualquiera de las reivindicaciones 10 a 17, caracterizado porque comprende:
- uno o más sistemas para la excitación lumínica a dos y/o tres longitudes de onda de excitación λ′1, λ′2 y, opcionalmente, λ′3;
- uno o más sistemas para medir las intensidades de fluorescencia I1, I2 y, opcionalmente I3, emitidas a tres longitudes de onda de emisión λ1, λ2 y, opcionalmente λ3;
- una calculadora que permite el cálculo del siguiente valor de F:
I I I I
13 1331
F = [I2-I1] y/o F I
2 2
13 13
19. Fluorímetro según la reivindicación 18, en el que las longitudes de onda de excitación y emisión son las siguientes: λ′1=472±10 nm λ1=502±10 nm
λ′2=496±10 nm λ2=526±10 nm λ′3=538±10 nm λ3=568±10 nm.
20. Fluorímetro según la reivindicación 18, en el que las longitudes de onda de excitación y emisión son las siguientes: λ′1=472±10 nm λ1=502±10 nm y λ′2=496±10 nm λ2=526±10 nm, o
λ′1=496±10 nm λ1=526±10 nm y λ′2=538±10 nm λ2=568±10 nm.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]