PROCEDIMIENTO PARA LA OBTENCION DE LA FORMA POLIMORFICA I DE FINASTERIDA.
El procedimiento comprende ((i) disolver finasterida en un disolvente orgánico sustancialmente anhídrido,
seleccionado entre acetato de n-butilo, acetato de iso-butilo, acetato de sec-butilo, acetato de tert-butilo, acetato de alquilo C5, y sus mezclas, a una temperatura igual o inferior al punto de ebullición de dicho disolvente orgánico; (ii) enfriar lentamente dicha disolución de finasterida hasta una temperatura de enfriamiento determinada en función del disolvente elegido; (iii) mantener la suspensión resultante a la temperatura de enfriamiento durante un periodo de tiempo igual o inferior a 16 horas; y (iv) recuperar la fase sólida que contiene los cristales de la Forma I de finasterida, por ejemplo, mediante filtración, y retirar del disolvente, por ejemplo, mediante secado de dichos cristales. El procedimiento permite obtener de forma única y pura la Forma I de finasterida
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/ES03/00556.
Solicitante: RAGACTIVES, S.L..
Nacionalidad solicitante: España.
Provincia: VALLADOLID.
Inventor/es: MARTIN JUAREZ,JORGE, SILVA GUISASOLA, LUIS OCTAVIO, LADERAS MUÑOZ,MARIO.
Fecha de Publicación: .
Fecha Concesión Europea: 10 de Febrero de 2010.
Clasificación Internacional de Patentes:
- A61K31/58 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que contienen heterociclos, p. ej. aldosterona, danazol, estanozolol, pancuronium, digitogenina (digitoxina A61K 31/704).
- C07J73/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07J ESTEROIDES (seco-steroides C07C). › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por sustitución de uno o dos átomos de carbono por heteroátomos.
Clasificación PCT:
- A61K31/58 A61K 31/00 […] › que contienen heterociclos, p. ej. aldosterona, danazol, estanozolol, pancuronium, digitogenina (digitoxina A61K 31/704).
- C07J73/00 C07J […] › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por sustitución de uno o dos átomos de carbono por heteroátomos.
Clasificación antigua:
- A61K31/58 A61K 31/00 […] › que contienen heterociclos, p. ej. aldosterona, danazol, estanozolol, pancuronium, digitogenina (digitoxina A61K 31/704).
- C07J73/00 C07J […] › Esteroides teniendo la estructura del ciclopenta [a] hidrofenantreno modificada por sustitución de uno o dos átomos de carbono por heteroátomos.
Fragmento de la descripción:
Procedimiento para la obtención de la forma polimórfica I de finasterida.
Campo de la invención
La invención se relaciona con un procedimiento para la obtención de la forma polimórfica pura de finasterida denominada Forma I.
Antecedentes de la invención
La finasterida [(5a,17ß)-N-(1,1-dimetiletil)-3-oxo-4-aza-androst-1-eno-17-carboxamida] es un inhibidor de la 5-a-reductasa, enzima que reduce la testosterona a dihidrotestosterona (DHT) que es el mediador principal de la actividad androgénica en algunos órganos. La finasterida puede evitar o reducir los síntomas de la estimulación hiperandrogénica y se utiliza como principio activo en múltiples aplicaciones terapéuticas, por ejemplo, en el tratamiento de la hiperplasia prostática benigna y de la alopecia androgénica.
Se conocen varios procedimientos para la obtención de finasterida [véanse, por ejemplo, las patentes norteamericanas US 4.377.584, US 4.760.071, US 5.084.574, US 5.116.983 o la solicitud de patente WO 01/02422].
La finasterida puede existir en varias formas polimórficas distintas [véanse, por ejemplo, la patente europea EP 0 599 376 B1, la solicitud de patente WO 02/20553 A1 o la publicación científica Journal of Molecular Structure, 474, (1999), 157-166], entre las que se encuentran las denominadas Forma I y Forma II, las cuales difieren entre sí en su estructura cristalina. Las diferentes estructuras cristalinas que puede presentar un compuesto conducen a una variación en sus parámetros físico-químicos, tales como por ejemplo, estabilidad, velocidad de disolución, solubilidad, punto de fusión, etc. Esta variación en las propiedades del compuesto se traduce en una diferente biodisponibilidad del mismo, especialmente en aquellos casos en los que el principio activo se suministra de forma sólida.
Desde el punto de vista farmacéutico es muy importante disponer de formas cristalinas únicas y puras para la elaboración de formas farmacéuticas puras que cumplan las especificaciones requeridas de producto farmacéutico puro. La obtención de formas cristalinas únicas soluciona los problemas de falta de reproducibilidad y de biodisponibilidad diferente que presentan las formas farmacéuticas cuando se utilizan mezclas de polimorfos. Las diferentes formas polimórficas pueden obtenerse controlando las condiciones de cristalización.
En el caso particular de la finasterida, la forma polimórfica comercializada es la Forma I, que constituye el principio activo de la especialidad farmacéutica denominada Proscar®.
En las patentes US 5.652.365 y EP 0 599 376 B1 se describe la preparación de las formas polimórficas Forma I y Forma II de finasterida. En particular, EP 0 599 376 B1 reivindica un procedimiento para la obtención de la Forma I de finasterida que comprende la cristalización de dicha Forma I a partir de acetato de etilo con un contenido en agua de hasta 3,5 mg/mL o bien a partir de acetato de isopropilo con un contenido en agua de hasta 1,6 mg/mL a temperatura ambiente.
La patente GB 2.338.234 describe un procedimiento para la preparación de la Forma I de finasterida que comprende formar inicialmente un complejo substancialmente insoluble formado por finasterida y una sal de un metal del Grupo I o Grupo II de la tabla periódica de elementos, tal como el bromuro de litio, en presencia de un disolvente hidroxílico, seguido de disociación del complejo por disolución con agua acidificada y recuperación de la Forma I cristalina de finasterida.
Compendio de la invención
Es, por tanto, objeto de la presente invención, proporcionar un procedimiento alternativo para la obtención de finasterida en su forma farmacéuticamente deseable, es decir, en su forma polimórfica I (Forma I).
El procedimiento de obtención de la Forma I de finasterida proporcionado por la presente invención se basa en que los inventores han observado que disolviendo finasterida, en caliente, en un disolvente orgánico sustancialmente anhidro, seleccionado entre acetato de n-butilo, acetato de iso-butilo, acetato de sec-butilo, acetato de tert-butilo, acetato de alquilo C5, a una temperatura igual o inferior al punto de ebullición de dicho disolvente orgánico, enfriando lentamente dicha disolución hasta una temperatura determinada en función del disolvente elegido y manteniendo la temperatura alcanzada durante un periodo de tiempo determinado, se obtienen cristales de dicha Forma I de finasterida que pueden ser recuperados fácilmente de las aguas madres de cristalización.
El procedimiento proporcionado por esta invención permite obtener de forma única y pura la Forma I de finasterida sin aparecer señales cuantificables de Forma II y con un rendimiento elevado.
Descripción detallada de la invención
La invención proporciona un procedimiento para la obtención de la forma polimórfica de finasterida denominada Forma I que comprende las siguiente etapas:
De acuerdo con la presente invención, la finasterida, que puede obtenerse mediante cualquiera de los procedimientos conocidos [véanse los Antecedentes de la Invención], se disuelve en un disolvente orgánico seleccionado entre acetato de n-butilo, acetato de iso-butilo, acetato de sec-butilo, acetato de tert-butilo, acetato de alquilo C5. El término "alquilo C5", tal como se utiliza en esta descripción, se refiere a un grupo alquilo, lineal o ramificado, de 5 átomos de carbono, por ejemplo, isoamilo.
Dicho disolvente orgánico es sustancialmente anhidro, es decir, su contenido en agua es igual o inferior a 0,08% (p/p). Preferentemente, dicho disolvente carece completamente de agua o tiene un contenido en agua mínimo ya que la presencia de agua favorece la formación de la forma polimórfica de finasterida conocida como Forma II.
La disolución de finasterida en el disolvente seleccionado se favorece calentando la finasterida en dicho disolvente hasta el punto de ebullición del disolvente, generalmente, entre 80ºC y 140ºC. En una realización particular, cuando el disolvente elegido es el acetato de n-butilo o el acetato de iso-butilo, la disolución de finasterida en dicho disolvente se favorece calentando la mezcla a una temperatura comprendida entre 100ºC y 120ºC. En otra realización particular, cuando el disolvente elegido es el acetato de tert-butilo, dicha disolución se favorece calentando la mezcla a una temperatura comprendida entre 90ºC y 100ºC. En otra realización particular, cuando el disolvente elegido es el acetato de isoamilo, la disolución de finasterida en dicho disolvente se favorece calentando la mezcla a una temperatura comprendida entre 125ºC y 140ºC.
Dependiendo del disolvente elegido, la disolución de finasterida caliente se enfría lentamente hasta:
Reivindicaciones:
1. Un procedimiento para la obtención de la forma polimórfica de finasterida denominada Forma I que comprende las siguiente etapas:
2. Procedimiento según la reivindicación 1, en el que la finasterida se disuelve en caliente a una temperatura comprendida entre 80ºC y 140ºC.
3. Procedimiento según la reivindicación 1, en el que la velocidad de enfriamiento de la disolución de finasterida está comprendida entre 0,2ºC/min y 1,3ºC/min.
4. Procedimiento según la reivindicación 1, en el que dicho disolvente es acetato de n-butilo, acetato de iso-butilo, acetato de sec-butilo o acetato de tert-butilo, y la velocidad de enfriamiento de la disolución de finasterida está comprendida entre 0,3ºC/min y 0,5ºC/min.
5. Procedimiento según la reivindicación 1, en el que el enfriamiento de la disolución de finasterida caliente obtenida en la etapa a) se realiza con agitación.
6. Procedimiento según la reivindicación 1, en el que la suspensión de finasterida obtenida en la etapa b) se mantiene a la temperatura de enfriamiento durante un periodo de tiempo comprendido entre 1 y 6 horas.
7. Procedimiento según la reivindicación 1, en el que la finasterida se disuelve en un disolvente seleccionado entre acetato de n-butilo y acetato de iso-butilo, a una temperatura comprendida entre 100ºC y 120ºC, dicha disolución se deja enfriar con una velocidad de enfriamiento comprendida entre 0,2ºC/minuto y 1,3ºC/minuto hasta una temperatura de enfriamiento comprendida entre 20ºC y 45ºC, y se mantiene a dicha temperatura durante un periodo de tiempo comprendido entre 1 y 3 horas.
8. Procedimiento según la reivindicación 1, en el que la finasterida se disuelve en acetato de tert-butilo a una temperatura comprendida entre 90ºC y 100ºC, dicha disolución se deja enfriar con una velocidad de enfriamiento comprendida entre 0,2ºC/minuto y 1,3ºC/minuto, hasta una temperatura de enfriamiento comprendida entre 20ºC y 45ºC, y se mantiene a dicha temperatura durante un periodo de tiempo comprendido entre 1 y 16 horas.
9. Procedimiento según la reivindicación 1, en el que la finasterida se disuelve en acetato de isoamilo a una temperatura comprendida entre 120ºC y 140ºC, dicha disolución se deja enfriar con una velocidad de enfriamiento comprendida entre 0,2ºC/minuto y 1,3ºC/minuto, hasta una temperatura de enfriamiento comprendida entre 0ºC y 45ºC, y se mantiene a dicha temperatura durante un periodo de tiempo comprendido entre 1 y 3 horas.
10. Procedimiento según la reivindicación 1, en el que la fase sólida que contiene los cristales de Forma I de finasterida se recupera por filtración.
11. Procedimiento según la reivindicación 1, en el que los cristales de la Forma I de finasterida recuperados se someten a un proceso de secado.
12. Procedimiento según la reivindicación 1, que comprende, además, una etapa de concentración de la disolución de finasterida obtenida en la etapa a) antes de recuperar la fase sólida que contiene los cristales de la Forma I de finasterida.
13. Procedimiento según la reivindicación 12, en el que la etapa de concentración de la disolución de finasterida se realiza en caliente, a vacío, antes de proceder a su enfriamiento.
Patentes similares o relacionadas:
Ésteres de lactama esteroidea y derivados de ácido bis(2-cloroetil) aminofenoxi propanoico, del 13 de Mayo de 2019, de Galenica S.A: Un compuesto de fórmula (I) o una sal farmacéuticamente aceptable del mismo**Fórmula** en la que R1 se selecciona del grupo que consiste en**Fórmula** […]
Separación de ácido 4-aza-androst-1-en-17-oico a partir de ácido 4-aza-androstan-17-oico, del 5 de Marzo de 2014, de PHF SA: Proceso para la separación de ácido 4-aza-androstan-17-oico a partir de ácido 4-aza-androst-1-en-17-oico, que comprende las etapas de tratar ácido 4-aza-androst-1-en-17-oico […]
METODO PARA LA INDUCCION DE RESISTENCIA A ENFERMEDADES EN PLANTAS, del 7 de Septiembre de 2012, de CENTRO DE INGENIERIA GENETICA Y BIOTECNOLOGIA: La presente invención describe un método para la estimulación de la defensa natural y la inducción de resistencia a enfermedades en plantas, mediante la activación simultánea […]
Derivados de oxa-esteroides como moduladores selectivos del receptor de progesterona, del 27 de Junio de 2012, de JANSSEN PHARMACEUTICA N.V.: Un compuesto de fórmula (I) **Fórmula** en la que R1 está seleccionado entre el grupo que consiste en alquilo C1-6, alquenilo C2-4, alquinilo C2-4, arilo, heteroarilo,aralquilo […]
Control de las características de sabor e indicador de la frescura de un zumo de frutas, del 30 de Mayo de 2012, de TROPICANA PRODUCTS, INC.: Un procedimiento para determinar la cantidad de estrés térmico que se ha infligido a un zumo de frutas,comprendiendo dicho procedimiento determinar la proporción […]
PROCEDIMIENTO PARA LA DESHIDROGENACION DE COMPUESTOS AZAANDROSTANO., del 16 de Marzo de 2007, de RICHTER GEDEON VEGYESZETI GYAR R.T.: Procedimiento para la preparación de compuestos de fórmula I (I) en la que R1 es un grupo -NH-tert-butilo o 4-metilpiperidino, por bioconversión de los compuestos de fórmula […]
METILENO-4-AZASTEROIDES., del 1 de Diciembre de 2006, de JENAPHARM GMBH & CO. KG: 17-Metileno-4-azasteroides sustituidos con halógeno y pseudohalógeno de la fórmula general I (Ver fórmula) R20 y R20a representan por separado grupos fluoro, […]
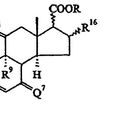 PROCEDIMIENTO PARA LA PREPARACION DE 4-AZA-ESTEROIDES, del 5 de Junio de 2009, de LONZA AG: Un procedimiento para la preparación de 4-azaesteroides de la fórmula** ver fórmula** en el que R 1 y R 2 se seleccionan independientemente del grupo que consiste en hidrógeno, […]
PROCEDIMIENTO PARA LA PREPARACION DE 4-AZA-ESTEROIDES, del 5 de Junio de 2009, de LONZA AG: Un procedimiento para la preparación de 4-azaesteroides de la fórmula** ver fórmula** en el que R 1 y R 2 se seleccionan independientemente del grupo que consiste en hidrógeno, […]