PROCEDIMIENTO DE OBTENCIÓN DE AMINO ALCOHOLES Y DIAMINAS QUIRALES.
Procedimiento de obtención de amino alcoholes y diaminas quirales.
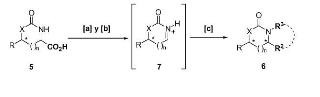
La presente invención se refiere a un procedimiento secuencial de conversión de un sustrato de fórmula general (5), donde X= O ó NH, R = alquilo o arilo y n = 0 ó 1, en un producto de fórmula general (6), donde R2 = alquilo, alilo, arilo o heteroarilo, y R3= H, alquilo; o R2 y R3 pueden estar conectados formando un ciclo, caracterizado porque dicho procedimiento comprende las etapas de: [a] descarboxilación radicalaria del sustrato (5); [b] oxidación del intermedio formado en la etapa [a] para dar un intermedio (7); y [c] adición estereoselectiva de un nucleófilo al ión aciliminio (7) formado en la etapa [b]; obteniéndose productos (6) que tienen una alta pureza óptica.
****IMAGEN****
La presente invención también se refiere a la utilización del procedimiento descrito para preparar bibliotecas de derivados nuevos de los compuestos de fórmula (6), que podrían usarse como tales o derivatizarse para obtener productos bioactivos como alcaloides o iminoazúcares, o bien para obtener ligandos quirales.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201130678.
Solicitante: CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC).
Nacionalidad solicitante: España.
Inventor/es: BOTO CASTRO,ALICIA, ROMERO ESTUDILLO,Iván Omar.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/42 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Oxazoles.
- C07D263/20 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 263/00 Compuestos heterocíclicos que contienen ciclos de oxazol-1,3 u oxazol-1,3 hidrogenado. › unidos en posición 2.
- C07D263/52 C07D 263/00 […] › condensados con sistemas cíclicos o ciclos carbocíclicos.
Fragmento de la descripción:
PROCEDIMIENTO DE OBTENCION DE AMINO ALCOHOLES Y DIAMINAS QUIRALES
Sector de la Tecnica
La sintesis de amino alcoholes y diaminas quirales ha despertado mucho interes, ya que estos compuestos se encuentran en productos bioactivos, como alcaloides e iminoazucares, en farmacos sinteticos y en ligandos quirales (catalizador de Corey, ligandos salen, etc) . En la industria quimica, muchas hidroxi aminas y diaminas quirales son reactivos comerciales de alto valor; sus aplicaciones en la industria farmaceutica son tambien muy importantes.
Estado de la tecnica
Entre los metodos para la sintesis de amino alcoholes y diaminas quirales, se encuentran la hidroxiaminación asimetrica de dobles enlaces, la reducción selectiva de amino cetonas o hidroxiiminas, la adición asimetrica de nucle6filos a aldehidos o iminas, etc. (Chiral Reagents for Asymmetric Synthesis, en Handbook of Reagents for Organic Synthesis, Ed: Leo A. Paquette, 2003, Wiley-VCH, Chichester) . Dentro de la adición asimetrica, uno de los metodos mas empleados es la adición de enolatos de glicina a aldehidos en condiciones de transferencia de fase (conversión 1º2, Esq. 1) . Este metodo permite obtener º-hidroxi-amino acidos con buenos rendimientos y alta pureza óptica. Este procedimiento esta descrito, por ejemplo, en T. Hashimoto, K. Maruoka, Chem. Rev. 2007, 107, 5656-5682. B. Lygo, B. I. Andrews, Acc. Chem. Res. 2004, 37, 518-525. T. Ooi, M. Kameda, M. Taniguchi, K. Maruoka, J. Am. Chem. Soc. 2004, 126, 9685-9694. De forma similar, la adición de los enolatos de glicina a iminas (conversión 1º3) da q acidos, tambien con muy buenos rendimientos y
, º-diamino buena estereoselectividad.
OCat (2 mol%) , 1% NaOH aq,
HO
1N HClNH4Cl (10%) , Tol, 0 oC R
CO2tBuH
R Ar
NH2THF
Br−
Cat =
N anti/sin 96:4 R = (CH2) 2Ph, (CH2) 4Me, Ph
Ph CH2OTIPS, Me, c-Hex
Ar
N
73−82%, 97−99% ee -hidroxi amino acido
CO2tBu
NBocCat (10 mol%) , CsOH H2O,
BocHN
CH2Cl2, −50ºCa 26 oC Ar
H
CO2tBu
Ar
4. F-C6H4
C6H4-4-Me N
N
CPh2
O +
C6H4-4-Me
Cat =
+
C6H4-4-Me 3O N
Ar = Ph-4-OMe
C6H4-4-Me
4. F-C6H4
95%, sin/anti, 82% ee (sin)
α, , , , β -diamino acido
Esquema 1.
La alquilación de enolatos de glicina es una reacción versatil que ha permitido obtener
tambien y-hidroxi amino acidos (conversión 1º 4, Esquema 2) y q, y-diamino acidos. Todos estos procedimientos estan descritos, por ejemplo, en R. Lepine, A. C. Carbonnelle, J. Zhu, Synlett 2003, 1455-1458. A. Okada, T. Shibuguchi, T. Ohshima,
H. Masu, K. Yamaguchi, M. Shibasaki, Angew. Chem. Int. Ed. 2005, 44, 4564-4567.
I
NCbz
Ph Cat (10 mol%) , CsOH H2O, Ph O
CO2tBuCH2Cl2, −50 oC a 26 oC ac. citrico º N
CbzN
O NH2 CO2tBu
1M, THF
1 Cat =
2R/2S 7:3, 68%
-hidroxi amino acido
Esquema 2
Los hidroxi amino acidos o diamino acidos quirales, como los compuestos 2−4, pueden 15 ser transformados facilmente en derivados ciclicos de fórmula general 5 (ver esquema 3) . Estos derivados ciclicos serviran como sustratos para el proceso secuencial descrito en la presente invención, compuesto de descarboxilación radicalaria acoplada a oxidación y a la adición de un nucle6filo, que reemplaza el grupo carboxilo CO2H por otras cadenas laterales R2.
Distintas variantes de dicho procedimiento secuencial ya se han descrito anteriormente. Sin embargo, en los documentos del estado de la tecnica el procedimiento se aplica a sustratos diferentes, los derivados ciclicos (5) , para dar productos diferentes (6) . Asimismo, en los procesos secuenciales ya descritos hay
pocos ejemplos de procesos estereoselectivos, y no se habia determinado la influencia del sustituyente R en la estereoselectividad del proceso.
O O
R3
X
NH X
N
R
ººn CO2H R
ºº n R2
56 X = O 6 NH R2, = alquil, alil, R = alquil, aril aril, heteroaril R3 = H, alquilo
n = 0, 1
Esquema 3: Procedimiento secuencial para la conversión directa de (5) en (6) .
En los precedentes (Esquema 4) , el documento A. Boto, Y. de Le6n, J. A. Gallardo, R. Hernandez, Eur. J. Org. Chem. 2005, 3461-3468 divulga la transformación de qaminoacido (I) , donde Z = acilo o carbamoilo y n = 1−2, en un heterociclo q-sustituido
(II) , donde Nu = OH, O-alquilo, N-acilo y alquilo, por reacción de
descarboxilación/oxidación y posterior alquilación del intermedio iminio (IV) con un nucle6filo. La reacción tiene lugar "one pot", sin aislamiento de intermedios, y da lugar a una mezcla racemica.
Tambien describe una variante del procedimiento para obtener un sistema policiclico
combinando la reacción de descarboxilación/oxidación con la reacción de aza-Diels-Alder, como en el caso anterior sin aislamiento de intermedios. [Para otros ejemplos de aza-Diels-Alder: P. Buonora, J. C. Olsen, T. Oh, Tetrahedron 2001, 57, 6099−6138;
K. A. Jorgensen, Angew. Chem. Int. Ed. 2000, 39, 3558−3588]. Los procesos descritos
en el documento de Boto, Hernandez et al no son estereoselectivos, y dan mezclas de los dos posibles is6meros. En cambio, en la invención el proceso es estereoselectivo, y se obtienen productos ópticamente puros, lo que es clave para su interes comercial. Ademas, los productos en el documento y en la invención son distintos: en el documento son pirrolidinas y piperidinas no quirales, mientras que en la invención son aminoalcoholes o diaminas quirales.
(CH 2) n
(CH 2) n
PhI (OAc) 2, CO2H I2, hν, NuN
N ZZ luego Nu−
I II
CO2
(CH 2) n (CH 2) n
N N
+ ZZ
III IV
Esquema 4
Por otro lado, C. Saavedra, R. Hernandez, A. Boto, E. Alvarez, J. Org. Chem. 2009, 74, 4655-4665 divulga la transformación de un q-aminoacido (V) en un º-aminoester
(VI) por reacción de descarboxilación-oxidación y posterior reacción del intermedio aciliminio con una silil cetena. La reacción tiene lugar "one-pot", sin aislamiento de
intermedios. En el caso que Z sea una cadena peptidica, esta puede actuar como auxiliar quiral, dando lugar a una reacción estereoselectiva (ver Esquema 5) . Sin embargo, en el documento la estereoselectividad es moderada, mientras que en la invención es muy alta, debido a que en vez de usar un auxiliar quiral sobre el nitrógeno, se parte de derivados ciclicos de los aminoacidos de partida.
PhI (OAc) 2, I2, hν,
R' R'
luego 0 oC, acido de Lewis, ZHN
ZHN COOH
CO2Me R R' OTMS R
VI
V
R' OMe
Esquema 5
C. H. Larsen, B. H. Ridgway, J. T. Shaw, K. A. Woerpel, J. Am. Chem. Soc. 1999, 121, 12208-12209 y C. H. Larsen, B. H. Ridgway, J. T. Shaw, D. M. Smith, K. A. Woerpel,
J. Am. Chem. Soc. 2005, 127, 10879-10884 describen la adición de un nucle6filo al doble enlace de un ión oxicarbenio, donde $ = O, o iminio ciclico, donde $ = N-acilo, con sustituyentes (R) en posición...
Reivindicaciones:
1. Procedimiento secuencial de conversión de un sustrato de fórmula general (5) , donde $ = O 6 NH, R = alquilo o arilo y n = 0 6 1, en un producto de fórmula general 5 (6) , donde R2 = alquilo, alilo, arilo o heteroarilo, y R3 = H, alquilo; o R2 y R3 pueden estar conectados formando un ciclo, caracterizado porque dicho procedimiento comprende las etapas de: [a] descarboxilación radicalaria del sustrato (5) ; [b] oxidación del intermedio formado en la etapa [a] para dar un intermedio (7) ; y [c] adición estereoselectiva de un nucle6filo al ión aciliminio (7) formado en la etapa [b];
obteniendose productos (6) que tienen una alta pureza óptica.
OO
O
H
R3
NH [a] y [b]
[c]
$
N$ $+
N R
( ) n
( ) n CO2H R R ( ) n R2
65 7
2. Procedimiento de conversión de un sustrato de fórmula general (5) segun la
reivindicación 1, en el que la etapa [c] comprende la reacción del intermedio aciliminio con un nucleofilo, obteniendose un compuesto de fórmula general (6a) donde $ = O 6 NH, R = alquilo o arilo, n = 0 6 1, R2 = alquilo, alilo, arilo o heteroarilo y R3 = H.
OO
O
H
NH [a] y [b]
[c] $
$ N$
NH
+ R
( ) n R ( ) n R2
( ) n CO2H R
6a5 7
3. Procedimiento segun la reivindicación 2, en el que $ es O, n es 0, R es alquilo C1-C20, R3 = H y R2 se elige entre alquilo C1-C20, cicloalquilo C3-C10, alilo, arilo de fórmula Ph-Y o heteroarilo.
4. Procedimiento segun la reividicación 3, en el que el heteroarilo es un derivado de furano o pirrol.
5. Procedimiento de conversión de un sustrato de fórmula general (5) segun la reivindicación 1, caracterizado porque la etapa [c] comprende una cicloadición en que el intermedio aciliminio reacciona con un dieno, obteniendose un compuesto de fórmula general (6b) donde $ = O 6 NH, R = alquilo o arilo, n = 0 6 1 y A, B, C y D son independientemente hidr6geno, alquilo o arilo.
O A
H
O
O
B
NH [a] y [b]
[c] $N
$
N$
+ R
R () n
C
( ) n
( ) n CO2H R
D
6b
6. Procedimiento segun la reivindicación 5, caracterizado porque $ es O, n es 0, R es alquilo C1-C20, y A, B, C y D se eligen independientemente entre hidr6geno o alquilo.
7. Procedimiento segun una cualquiera de las reivindicaciones anteriores, caracterizado porque el procedimiento secuencial tiene lugar sin aislamiento de intermedios.
8. Procedimiento segun una cualquiera de las reivindicaciones 1 a 7, caracterizado
porque la formación del ión aciliminio (7) tiene lugar por reacción del compuesto de fórmula (5) con (diacetoxiyodo) benceno y yodo en presencia de una fuente de energia.
9. Procedimiento segun la reivindicación 8, caracterizado porque dicho aporte de energia se elige entre energia termica, radiación luminosa o de microondas.
2.
10. Procedimiento segun una cualquiera de las reivindicaciones 8 o 9, caracterizado porque la radiación luminosa es radiación visible.
11. Uso del procedimiento definido en una cualquiera de las reivindicaciones 1 a 4 y 7 a 10, para obtener bibliotecas de derivados de los compuestos (6a) .
12. Uso del procedimiento segun la reivindicación 11, caracterizado porque el 5 compuesto de fórmula (6a) se elige entre (14) , trans- (15) , cis- (15) , (19) y (22) .
O O O O O H
H H ON
O N ON ONH ONHO
H Ph HH
14 trans-15 cis-15 19 22
13. Uso del procedimiento definido en una cualquiera de las reivindicaciones 1 y de 5 a 10, para obtener bibliotecas de derivados de los compuestos (6b) .
14. Uso del procedimiento segun la reivindicación 13, caracterizado porque el compuesto de fórmula (6b) se elige entre (20) , (21) , (23) y (26) . 15 O
O O O O
ON
ON
ONON
HH
H HH
O
2326
15. Uso de las bibliotecas definidas en una cualquiera de las reivindicaciones 11 a 14, 20 para identificar productos de interes biológico, como alcaloides e iminoazucares bioactivos, o de interes como ligandos quirales.
16. Compuesto de fórmula general (6) tal como se define en la reivindicación 1, caracterizado porque el compuesto de fórmula general (6) se elige entre los compuestos (14) , trans- (15) y cis- (15) , (17) , (19) , (20) , (21) , (22) , (23) y (26) .
O O O O O H
H
H
ON ONHO N ON
O N
Ph
14 trans-15 cis-15 17 19
O
H
O OO
O
O
ON
O NH ON
O N
O N
H
HH
HH HHH
O
21 22 2326
Patentes similares o relacionadas:
Inhibidores de la replicación del virus de la inmunodeficiencia humana, del 13 de Mayo de 2020, de VIIV Healthcare UK (No.5) Limited: Un compuesto de fórmula I, incluyendo las sales farmacéuticamente aceptables del mismo: **(Ver fórmula)** en la que: cada uno de R1a y R1b se selecciona independientemente […]
Compuestos de alquilamido y usos de los mismos, del 6 de Mayo de 2020, de Nogra Pharma Limited: Compuesto de fórmula: **(Ver fórmula)** que presenta una configuración S, o una sal farmacéuticamente aceptable del mismo, para la utilización en el […]
Compuestos tricíclicos y sus usos en medicina, del 8 de Abril de 2020, de Sunshine Lake Pharma Co., Ltd (100.0%): Un compuesto que tiene la fórmula (I) o un estereoisómero, un isómero geométrico, un tautómero, un N-óxido, un hidrato, un solvato o una sal farmacéuticamente […]
Uso de una composición de isoxazolina como antiparasitario, del 11 de Marzo de 2020, de INTERVET INTERNATIONAL B.V: Un compuesto de isoxazolina, una de sal de la isoxazolina o un solvato de la isoxazolina o sal; la estructura de la isoxazolina corresponde a la Fórmula (I): **(Ver […]
Compuesto activo y composición relacionada para uso dermatológico en el campo farmacéutico o cosmético, del 25 de Octubre de 2019, de GIULIANI S.P.A.: Ácido 4-((2E,4E,6E)-octa-2,4,6-trienamid) butanoico de fórmula:**Fórmula**
Compuestos de ácido isoxazol hidroxámico como inhibidores de LpxC, del 16 de Octubre de 2019, de NOVARTIS AG: Un compuesto de Fórmula (I):**Fórmula** o una sal farmacéuticamente aceptable del mismo, en la que: X es -NH-, y R1 es -CH(OH)-Y; o X es -CH2-, y R1 es -CH(OH)-Y […]
Uso de agonistas de NMDAR para el tratamiento de disfunción de receptores glutamatérgicos autoinmune, del 2 de Octubre de 2019, de SARAH HERZOG MEMORIAL HOSPITAL, EZRAT NASHIM ASSOCIATION: Un agonista de NMDAR para su uso en un método para potenciar la neurotransmisión mediada por NMDAR en una enfermedad asociada con la producción de anticuerpos anti-NMDAR, […]
Composición y método para el tratamiento de la depresión y la psicosis en humanos, del 2 de Octubre de 2019, de Glytech LLC: Una composición para uso en el tratamiento de acatisia asociada con medicamentos administrados a un sujeto humano para el tratamiento de una enfermedad […]