Procedimiento mejorado para la preparación de fluvastatina y sales de la misma.
Procedimiento para la preparación de fluvastatina sódica amorfa,
que comprende:
a) disolución de (3R*,5S*,6E)-7-[3-(4-fluorofenil)-1-(1-metiletil)-1H-indol-2-il]-3,5-dihidroxihept-6-enoato de 1,1-dimetiletilo, también conocido como éster terc-butílico de fluvastatina, en una mezcla de tolueno y metanol;
b) adición de disolución acuosa de NaOH a la disolución obtenida de la etapa a);
c) separación de fases de la masa de reacción;
d) concentración de las capas acuosas reunidas para obtener una suspensión acuosa;
e) filtración del sólido precipitado suspendido y lavado con agua para obtener una pasta espesa;
f) disolución del sólido en THF, filtración a través de celite o un filtro de cartucho y adición de ciclohexano a ladisolución en THF transparente y agitación del producto precipitado durante aproximadamente tres horas yenfriamiento gradual hasta aproximadamente 25º-30ºC;
g) filtración y lavado del sólido, así obtenido, con ciclohexano; y
h) disolución de la torta húmeda obtenida en metanol, filtración y secado por pulverización.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/002745.
Solicitante: PHARMATHEN S.A..
Nacionalidad solicitante: Grecia.
Dirección: 6, DERVENAKION STR. 15351 PALLINI ATTIKIS GRECIA.
Inventor/es: SONI,ROHIT,RAVIKANT, LITHADIOTI,Alexandra, KOFTIS,THEOHARIS V, PANAGIOTIDIS,THEODOROS.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D209/24 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 209/00 Compuestos heterocíclicos que contienen ciclos de cinco miembros, condensados con otros ciclos, con solamente un átomo de nitrógeno como heteroátomo. › con un radical alquilo o cicloalquilo unido al átomo de nitrógeno del ciclo.
PDF original: ES-2398802_T3.pdf
Fragmento de la descripción:
Procedimiento mejorado para la preparación de fluvastatina y sales de la misma
CAMPO TÉCNICO DE LA INVENCIÓN
La presente invención se refiere a un procedimiento mejorado para la preparación de fluvastatina y sales o derivados farmacéuticamente aceptables de la misma y, en particular, a un procedimiento en un solo recipiente para la producción a gran escala de fluvastatina o sales de la misma y a preparados farmacéuticos que contienen dichos compuestos.
ANTECEDENTES DE LA INVENCIÓN
Fluvastatina pertenece a una clase de fármacos denominada estatinas que actúan como inhibidores de 3-hidroxi-3
metilglutaril-coenzima-A (HMG-CoA) reductasa. Las estatinas son eficaces para reducir partículas de lipoproteínas de baja densidad (LDL) en el torrente sanguíneo y se utilizan para el tratamiento de la hipercolesterolemia y de la hiperlipoproteinemia. Además de ello, son muy útiles para prevenir la enfermedad cardiaca coronaria (CHD) que continúa siendo un problema de salud principal en los países desarrollados.
Fluvastatina se utiliza en forma de fluvastatina sódica, que es más deseable, ya que puede formularse de manera más eficaz. Esto es importante, ya que las formulaciones necesitan cumplir determinados requisitos y especificaciones farmacéuticos. Fluvastatina sódica puede formularse fácilmente en forma de comprimidos, cápsulas, pastillas, polvos y otras formas de administración oral.
Fluvastatina sódica se designa químicamente como (3RS, 5SR, 6E) -7-[3- (4-fluorofenil) -1- (1-metiletil) -1H-indol-2-il]3, 5-dihidroxihept-6-enoato sódico. Fluvastatina es una mezcla racémica de los enantiómeros (3R, 5S) y (3S, 5R) y presenta la siguiente fórmula estructural:
ácido (3R, 5S, 6E) -7-[3- (4-fluorofenil) -1- (1-metiletil) -1H-indol-2-il]-3, 5-dihidroxihept-6-enoico ácido (3S, 5R, 6E) -7-[3- (4-fluorofenil) -1- (1-metiletil) -1H-indol-2-il]-3, 5-dihidroxihept-6-enoico A estos dos isómeros se les denomina también isómeros sin-diol y los otros isómeros de la misma estructura química se denominan anti-isómeros.
Fluvastatina y su sal sódica y métodos para su preparación se describieron por primera vez en el documento EPB-114 027, en donde fluvastatina sódica se obtiene mediante hidrólisis de éster metílico de fluvastatina con hidróxido de sodio en etanol, seguido de liofilización. Además, también se han descritos varios procedimientos para la preparación de fluvastatina sódica, que incluyen un cierto número de formas polimórficas de la misma. Sin embargo, la liofilización es un proceso costoso y laborioso a gran escala.
Los procedimientos de la técnica anterior para la preparación de fluvastatina sódica presentan la desventaja de un rendimiento no satisfactorio del producto. Además de ello, el compuesto comprende a menudo cantidades significativas de impurezas, y las reacciones químicas pueden requerir de un largo período de tiempo hasta que se completen.
También es conocido que fluvastatina sódica pura existe en forma amoría y que hidratos/solvatos de fluvastatina sódica se pueden fácilmente convertir en otras formas cristalinas durante el almacenamiento. Además, la pureza es de gran importancia con relación a los ingredientes farmacéuticos activos tales como fluvastatina, que han de considerarse sobre una base a largo plazo, dado que la impureza puede acumularse con el tiempo y puede provocar efectos secundarios indeseados. Por lo tanto, por el bien de la estabilidad y la pureza química es ventajoso fabricar fluvastatina sódica anhidra en una forma amoría esencialmente pura.
El documento WO 2006/038219 describe un procedimiento para la preparación de fluvastatina sódica amoría, en el que disoluciones en metanol de NaOH y éster terc-butílico de fluvastatina se combinan y agitan. Cuando se completa la reacción, la masa de la reacción se concentra dos veces, se disuelve en metanol y se filtra. El rendimiento de dicho procedimiento es muy bajo, menor que 50%. Además de ello, NaOH se añade en exceso, pero no se lleva a cabo un tratamiento acuoso para separar las impurezas inorgánicas.
El documento WO 2004/113292 describe un procedimiento para la preparación de fluvastatina sódica amoría, que comprende disolver éster metílico de fluvastatina en acetona, añadir una disolución de NaOH en metanol, agitar la mezcla de reacción a la temperatura ambiente durante una noche y aislar el producto mediante filtración bajo nitrógeno. El producto final se seca durante 24 horas. De acuerdo con otra realización, fluvastatina sódica se disuelve en 1, 4-dioxano a temperatura elevada y luego la disolución se enfría hasta la temperatura ambiente y se agita durante 70 horas para inducir la precipitación de fluvastatina sódica amoría. El rendimiento en ambos procedimientos es del 90%, y ambos procedimientos requieren un tiempo de reacción prolongado, y no se lleva a cabo ningún tratamiento adicional para separar las impurezas. Además, el uso de 1, 4-dioxano a gran escala y a temperatura elevada es extremadamente peligroso, ya que este disolvente se considera como un posible carcinógeno por parte de la International Agency for Research on Cancer. Estos procedimientos son obviamente no factibles para la práctica industrial.
El documento EP-A-1847529 describe un procedimiento de hidrólisis selectivo para la producción a gran escala de fluvastatina, en el que sólo se hidroliza el isómero sin deseado, y los anti-isómeros indeseados permanecen sin cambiar y pueden ser fácilmente separados mediante extracción. La pureza diastereoisomérica del compuesto resultante se controla por parte de dos factores, a saber la pureza diastereoisomérica del éster que reacciona y de las cantidades de los reactivos y disolventes. A pesar de que dicho procedimiento parece ser menos costoso para conseguir una estereoselección a gran escala, no se describe sin embargo aislamiento alguno del producto a través de filtración, más bien la destilación de disolventes hasta que se obtenga un sólido húmedo, dejando cuestionado el contenido de otras impurezas.
A pesar de que cada una de las patentes anteriores representa un intento de superar el uso de material costoso y peligroso, sigue existiendo la necesidad de un procedimiento económico y más seguro para la producción a gran escala que proporcione el mayor rendimiento con una mayor pureza.
SUMARIO DE LA INVENCIÓN
Por lo tanto, es un objeto de la presente invención proporcionar un procedimiento mejorado para la preparación de fluvastatina o sales farmacéuticamente aceptables de la misma o sus derivados, que supere las deficiencias de los procedimientos de la técnica anterior y que resulte en una producción industrial económica, sin sacrificar el rendimiento y la calidad del producto.
Otro objeto de la presente invención consiste en proporcionar un método mejorado para la preparación de fluvastatina o sales de la misma o sus derivados, seleccionando los reaccionantes, catalizadores, sistemas disolventes y condiciones apropiados utilizados durante las reacciones orgánicas, de modo que aumentan la pureza (tanto la pureza química como la pureza óptica) y el rendimiento de la reacción y se minimiza la presencia de cualesquiera contaminantes y subproductos formados.
Objeto adicional de la presente invención consiste en proporcionar un método mejorado para la preparación de fluvastatina o sales de la misma, o sus derivados, utilizando condiciones de reacción más suaves y seguras, que ayude a proteger el medio ambiente y el personal.
De acuerdo con los objetos anteriores de la presente invención, se proporciona un procedimiento para la preparación de fluvastatina o sales farmacéuticamente aceptables de la misma o sus derivados, que comprende 5 las siguientes etapas:
a) disolución de (3R*, 5S*, 6E) -7-[3- (4-fluorofenil) -1- (1-metiletil) -1H-indol-2-il]-3, 5-dihidroxihept-6-enoato de 1, 1dimetiletilo, también conocido como éster terc-butílico de fluvastatina, en una mezcla de tolueno y metanol; b) adición de disolución acuosa de NaOH a la disolución obtenida de la etapa a) ;
c) separación de fases de la masa de reacción; d) concentración de las capas acuosas reunidas para obtener una suspensión acuosa; e) filtración del sólido precipitado suspendido y lavado con agua para obtener una pasta espesa; f) disolución del sólido en THF, filtración a través de celite o un filtro de cartucho y adición de ciclohexano a la disolución en THF transparente y agitación del producto precipitado durante aproximadamente tres horas y
enfriamiento gradual hasta aproximadamente 25º-30ºC; g) filtración y lavado del sólido obtenido con ciclohexano; y h) disolución de la torta húmeda obtenida en metanol, filtración... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la preparación de fluvastatina sódica amoría, que comprende: a) disolución de (3R*, 5S*, 6E) -7-[3- (4-fluorofenil) -1- (1-metiletil) -1H-indol-2-il]-3, 5-dihidroxihept-6-enoato de 1, 1
dimetiletilo, también conocido como éster terc-butílico de fluvastatina, en una mezcla de tolueno y metanol; b) adición de disolución acuosa de NaOH a la disolución obtenida de la etapa a) ; c) separación de fases de la masa de reacción; d) concentración de las capas acuosas reunidas para obtener una suspensión acuosa; e) filtración del sólido precipitado suspendido y lavado con agua para obtener una pasta espesa;
f) disolución del sólido en THF, filtración a través de celite o un filtro de cartucho y adición de ciclohexano a la disolución en THF transparente y agitación del producto precipitado durante aproximadamente tres horas y enfriamiento gradual hasta aproximadament.
25. 30ºC; g) filtración y lavado del sólido, así obtenido, con ciclohexano; y h) disolución de la torta húmeda obtenida en metanol, filtración y secado por pulverización.
1.
2. El procedimiento de acuerdo con la reivindicación 1, en el que la concentración de la disolución de la etapa a) está en el intervalo de 4% a 10%, preferiblemente 6, 5%.
3. El procedimiento de acuerdo con la reivindicación 1, en el que la relación de tolueno a metanol está en el 20 intervalo de 5:1 a 1:5 (v/v) , preferiblemente 2:1 (v/v) .
4. El procedimiento de acuerdo con la reivindicación 1, en el que la relación molar de éster terc-butílico de fluvastatina a NaOH es ligeramente inferior a 1.
5. El procedimiento de acuerdo con la reivindicación 1, en el que la masa de reacción de la etapa b) se mantiene a aproximadament.
2. 30ºC durante aproximadamente 3 a 5 horas.
6. El procedimiento de acuerdo con la reivindicación 1, en el que durante la separación de fases, la capa acuosa se lava con tolueno y la capa orgánica se extrae con agua DM, dichas capas acuosas se reúnen y dichas capas 30 orgánicas se desechan.
7. El procedimiento de acuerdo con la reivindicación 1, en el que las capas acuosas reunidas se concentran en vacío hasta aproximadamente ¼ de su volumen y 2, 8-3, 2 veces el volumen del material de partida.
8. El procedimiento de acuerdo con la reivindicación 1, en el que la suspensión acuosa obtenida en la etapa d) se agita durante aproximadamente 3 horas y se enfría gradualmente hasta aproximadament.
15. 20ºC.
9. El procedimiento de acuerdo con la reivindicación 1, en el que la relación de THF y ciclohexano está en el intervalo de 1:5 a 1:10 (v/v) , preferiblemente 1:7, 5 (v/v) . 4.
10. El procedimiento de acuerdo con la reivindicación 1, en el que el secado por atomización se realiza a 100ºC.
Patentes similares o relacionadas:
Derivados de indol carboxamida como antagonistas del receptor P2X7, del 9 de Noviembre de 2016, de ACTELION PHARMACEUTICALS LTD.: Un compuesto de fórmula (I),**Fórmula** en la que n representa 1, 2, 3 o 4; R1 representa hidrógeno y R2 representa hidroxi; hidroxi-alquilo (C1-C3); alcoxi (C1-C3); […]
Indol- y bencimidazolcarboxamidas como insecticidas y acaricidas, del 6 de Mayo de 2015, de Bayer Intellectual Property GmbH: Compuestos de fórmula general (I) y sus diastereómeros, enantiómeros, isómeros E/Z, N-óxidos y sales, **Fórmula** en la que R1 representa halógeno, nitro, ciano, representa […]
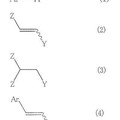 Método para producir un compuesto insaturado aromático, del 22 de Enero de 2014, de SUMITOMO CHEMICAL COMPANY, LIMITED: Un procedimiento para producir un compuesto insaturado aromático de fórmula
en donde Ar representa un grupo aromático opcionalmente […]
Método para producir un compuesto insaturado aromático, del 22 de Enero de 2014, de SUMITOMO CHEMICAL COMPANY, LIMITED: Un procedimiento para producir un compuesto insaturado aromático de fórmula
en donde Ar representa un grupo aromático opcionalmente […]
Metilación de compuestos indol utilizando carbonato de dimetilo, del 18 de Diciembre de 2013, de F. HOFFMANN-LA ROCHE AG: Un proceso para la fabricación de un compuesto indol metilado de la fórmula I**Fórmula*+ en la que R1 se selecciona del grupo que consiste de halógeno, […]
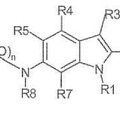 Moduladores de INDOLSUFONAMIDA de receptores de PROGESTERONA, del 25 de Marzo de 2013, de ELI LILLY & COMPANY: Un compuesto de fórmula
en la que:
n es 1 o 2;
R1 está seleccionado de: alquilo C1-C8, alquenilo C2-C6, alquinilo C2-C6, haloalquilo C1-C6, alquil C1-C6-OR9,cicloalquilo […]
Moduladores de INDOLSUFONAMIDA de receptores de PROGESTERONA, del 25 de Marzo de 2013, de ELI LILLY & COMPANY: Un compuesto de fórmula
en la que:
n es 1 o 2;
R1 está seleccionado de: alquilo C1-C8, alquenilo C2-C6, alquinilo C2-C6, haloalquilo C1-C6, alquil C1-C6-OR9,cicloalquilo […]
SOLVATOS DE FLUVASTATINA SODICA Y SU UTILIZACION COMO INTERMEDIOS EN LA OBTENCION DE FLUVASTATINA SODICA AMORFA, del 11 de Marzo de 2010, de ERCROS INDUSTRIAL, S.A.: Solvatos de fluvastatina sódica y su utilización como intermedios en la obtención de fluvastatina sódica amorfa. La presente invención […]
FORMAS CRISTALINAS DEL FLUVASTATIN SODICO., del 1 de Marzo de 2006, de CIBA SPECIALTY CHEMICALS HOLDING INC.: Una forma cristalina polimórfica de la sal monosó- dica del ácido (3R, 5S)- ó (3S, 5R)-7-(3-(4-fluorfenil)-1-(1- metiletil)-1H-indol-2-il)-3 , 5-dihidroxi-6-heptenoico […]
REACTIVOS DE MARCADO CON COLORANTES DE CIANINA, del 19 de Enero de 2012, de GE HEALTHCARE LIMITED CARNEGIE MELLON UNIVERSITY: Un compuesto de fórmula (I): en la que: los grupos R3 y R4 están unidos a la estructura de anillo Z1 y los grupos R5 y R6 están unidos a la estructura de 5 anillo […]