Procedimiento de lisis/resellado para incorporar un ingrediente activo en eritrocitos.
Procedimiento de lisis/resellado para preparar eritrocitos que contienen un ingrediente activo,
comprendiendo el procedimiento las siguientes etapas:
(1) - suspender un pelete globular en una disolución isotónica que tiene un nivel de hematocrito igual o mayor que 65%, con refrigeración entre +1 y +8ºC,
(2) - medir la fragilidad osmótica a partir de una muestra de eritrocitos de ese mismo pelete globular, pudiendo ser realizadas las etapas 1 y 2 en un orden cualquiera,
(3) - llevar a cabo un procedimiento de lisis e internalización del ingrediente activo, en el interior de la misma cámara, a una temperatura mantenida constantemente entre +1 y +8ºC, que comprende permitir que la suspensión de eritrocitos, que tiene un nivel de hematocrito igual o mayor que 65%, y una disolución de lisis hipotónica, que está refrigerada entre +1 y 8ºC, circulen en un cartucho de diálisis; ajustándose los parámetros de lisis según la fragilidad osmótica medida previamente, en el que el caudal de la suspensión de eritrocitos que pasa al cartucho de diálisis se ajusta, o la osmolaridad de la disolución de lisis se selecciona, basándose en la medida de la fragilidad osmótica; y
(4) - llevar a cabo un procedimiento de resellado en una segunda cámara a una temperatura entre +30 y +40ºC por medio de una disolución hipertónica.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2005/002323.
Solicitante: ERYTECH PHARMA.
Nacionalidad solicitante: Francia.
Dirección: 60 AVENUE ROCKEFELLER 69008 LYON FRANCIA.
Inventor/es: GODFRIN,YANN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/6615 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Compuestos que tienen varios grupos de ácido del fosforo esterificados, p. ej. trifosfato de inositol, ácido fítico.
- A61K35/18 A61K […] › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Eritrocitos (hemoglobina A61K 38/42).
- A61K38/50 A61K […] › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que actúan sobre enlaces carbono-nitrógeno distintos de los enlaces peptídicos (3.5), p. ej.: asparaginasa.
- A61K9/50 A61K […] › A61K 9/00 Preparaciones medicinales caracterizadas por un aspecto particular. › Microcápsulas (A61K 9/52 tiene prioridad).
- A61M1/36 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 1/00 Dispositivos de succión o de bombeo de uso médico; Dispositivos para extraer, tratar o transportar los líquidos del cuerpo; Sistemas de drenaje (catéteres A61M 25/00; conectores o acoplamientos para tubos, válvulas o conjuntos de derivación, especialmente concebidos para uso médico A61M 39/00; dispositivos para tomar muestras sanguíneas A61B 5/15; instrumentos para retirar la saliva para dentistas A61C 17/06; filtros para implantar en los vasos sanguíneos A61F 2/01). › Otros tratamientos de la sangre en una derivación del sistema circulatorio natural, p. ej. adaptación de la temperatura, irradiación.
- A61P35/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
PDF original: ES-2376979_T3.pdf
Fragmento de la descripción:
Procedimiento de lisis/resellado para incorporar un ingrediente activo en eritrocitos.
La presente invención se refiere a un procedimiento que permite la realización de la técnica denominada de lisis/resellado, que permite incorporar ingredientes activos en eritrocitos.
La invención se refiere asimismo a composiciones de eritrocitos que contienen asparaginasa o similar, o hexafosfato de inositol, y que se pueden obtener mediante la realización del procedimiento según la invención.
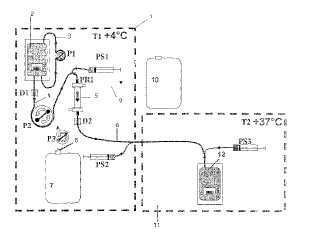
La técnica de lisis/resellado se describe en las patentes EP-A-101 341 y EP-A-679 101. Esta última describe una instalación relativamente compleja que comprende, por un lado, un alojamiento refrigerado para la porción de lisis, en el que se coloca un conjunto que comprende elementos de un solo uso, incluyendo un cartucho de diálisis, tubos, bolsas de tipo curvo o serpentines, y elementos metálicos retirables, tales como serpentín de enfriamiento, y, por otra parte, un alojamiento para el resellado, alojamiento el cual está provisto de medios de recalentamiento y en el que se coloca un conjunto de un solo uso de material plástico.
Los glóbulos rojos, que se han separado previamente del plasma y que están sometidos a fuerzas iónicas débiles (en medio hipotónico) , se hinchan hasta alcanzar un volumen crítico en el que la membrana está distendida hasta el punto de volverse permeable a los iones y a las macromoléculas. El examen con un microscopio de las membranas eritrocíticas revela entonces la aparición de poros que miden de 20 a 500 nm, por los cuales se puede escapar la hemoglobina (P. Seeman J. Cell. Biol. 1967, 32 (1) : 55-70) . La restauración de la isotonicidad del medio de suspensión conlleva el cierre de los poros, haciendo a la membrana impermeable a las macromoléculas. Sólo se mantiene una permeabilidad iónica.
El choque hipotónico se lleva a cabo haciendo circular los glóbulos rojos en el compartimiento de “sangre” de un dializador, que tiene preferentemente fibras huecas, y haciendo circular en contracorriente una disolución hipotónica en el compartimiento de “dializado”. La ventaja de esta técnica está en el confinamiento de los glóbulos rojos durante el choque hipotónico, lo que permite reducir considerablemente las pérdidas de constituyentes que son esenciales para la vida de esas células. Así, la semivida de los glóbulos rojos no se modifica significativamente in vivo.
La ventaja de usar glóbulos rojos como vehículos para medicamentos, con respecto a otras técnicas, tales como el encapsulamiento en liposomas o microesferas, está esencialmente en el hecho de que esos corpúsculos tienen una biocompatibilidad “natural”, son totalmente biodegradables según un procedimiento bien conocido, tienen una duración de vida in vivo relativamente larga (120 días aproximadamente) , y se pueden encapsular en ellos diversas moléculas químicas y terapéuticas.
El proceso de internalización por lisis y resellado de los eritrocitos es un fenómeno multifactorial complejo. Algunos parámetros físicos/químicos importantes que influyen sobre la variabilidad de los resultados son la concentración en términos de hemoglobina antes de la diálisis, el caudal de la suspensión de eritrocitos en el dializador, la osmolaridad del tampón de diálisis hipotónica, las temperaturas de diálisis y de resellado, y la presión transmembránica en el dializador. La fragilidad osmótica de los eritrocitos varía de una muestra sanguínea a otra, y podría ser un factor biológico preponderante. Así, L. Boucher et al., Biotechnoll. Appl. Biochem., 1996, 24, 73-78, han estudiado la influencia de las variaciones de la fragilidad osmótica de diferentes poblaciones de glóbulos rojos sobre la distribución y concentración final de hexafosfato de inositol. En conclusión, los autores indican que la fragilidad osmótica inicial de los glóbulos rojos tiene un papel predominante en términos del grado de lisis y las variaciones en la internalización del ingrediente activo, y que esa fragilidad osmótica depende de numerosos factores, tales como la permeabilidad de los glóbulos rojos, la relación superficie/volumen y el contenido iónico, el estado fisiológico y la edad del donante (véase también A.A. Hussain et al., Br. J. Haetmatol. 1984, 57 (4) : 716-718) , el tiempo de conservación de la sangre, la presencia de medicamentos, las enfermedades (véase también K. Kolanjiappan et al., Clin. Chim. Acta 2002, 326 (1-2) : 143-149) , y los tratamientos. Los resultados obtenidos, haciendo variar el caudal de la suspensión de eritrocitos, demostraron la extrema sensibilidad de las condiciones de operación, con un caudal que varía entre 12 y 14 ml/min, dependiendo de si los glóbulos rojos pertenecen a un grupo de un nivel de fragilidad reducido o a un grupo de un nivel de fragilidad elevado.
Estos textos dan por lo tanto una primera información sobre los diferentes factores que influyen en la fragilidad osmótica de los glóbulos rojos y sobre la efectividad de la incorporación mediante la técnica de lisis/resellado. Permiten comprender las dificultades encontradas en la práctica, que explican que esa técnica no se puede aplicar normalmente en clínica humana.
Una publicación muy reciente resume muy bien la situación actual. C. G. Millan et al. han publicado en Journal of Controlled Release 2004, 95: 27-49, un repaso general sobre el uso de los eritrocitos como vehículos farmacéuticos, en el que concluyen que, a pesar del interés que suscitan en medicina humana, su desarrollo es hoy en día muy limitado, debido a las dificultades de almacenamiento, a riesgos de contaminación y a la ausencia de procedimiento industrial válido que permita su preparación.
La asparaginasa es una enzima producida a partir de microorganismos bacterianos (E. coli o Erwinia) que hidroliza y agota la asparagina, un aminoácido indispensable para la fabricación de las proteínas necesarias para la vida celular, en particular fibroblastos. Algunas células linfoblásticas cancerosas no tienen, a diferencia de las células normales, la capacidad de sintetizar ellas mismas su asparagina, y dependen de fuentes extracelulares. El tratamiento mediante asparaginasa les priva por lo tanto de ese constituyente, lo que conduce a su muerte. Este antimitótico es selectivo con respecto de las células tumorales.
Sin embargo, en seres humanos, la asparaginasa nativa induce la producción de anticuerpos que están presentes de media en más del 70% de los pacientes, conduciendo a un aumento en el aclaramiento de la asparaginasa y de reacciones alérgicas a veces muy severas (B. Wang et al., Leukaemia 2003 17, 8:1583-1588) . De este modo, a pesar de ser muy eficaz en el tratamiento de leucemias linfoblásticas agudas, la asparaginasa es altamente tóxica y puede conllevar reacciones de hipersensibilidad, que van desde una simple reacción del tipo urticaria hasta un verdadero choque anafiláctico. Por otro lado, se observan efectos nefastos del tipo neurológico (trastornos de la conciencia) , del tipo hemostático (hipofibrinogenemia, disminución del índice sérico de antitrombina III y otros factores de la coagulación, conduciendo a complicaciones hemorrágicas y/o trombóticas) , del tipo gastrointestinal y del tipo pancreático (incluyendo pancreatitis agudas) .
El encapsulamiento de la asparaginasa en eritrocitos permite mejorar el índice terapéutico (D. Schrijvers et al., Clin. Pharmacokinet. 2003, 42 (9) : 779-791) . Por lo tanto, sería de gran interés proporcionar un procedimiento que permita encapsular asparaginasa en eritrocitos de manera reproducible e industrial.
Por otro lado, el hexafosfato de inositol se ha propuesto como sustituto del 2, 3-DPG (2, 3-difosfoglicerato) en los eritrocitos, para disminuir significativamente la afinidad del oxígeno por la hemoglobina y aumentar la liberación del oxígeno en los tejidos (documento EP-A-0 101 341) . Las patentes US 4.321.259, US 5.612.207 y US 6.610.702 describen la incorporación de ese sustituto en eritrocitos y el uso de estos en diversas aplicaciones terapéuticas. Entre ellas, se menciona una indicación como un aditivo para un tratamiento de cáncer mediante radioterapia, a fin de mejorar la oxigenación de tumores hipóxicos y su sensibilidad a la radioterapia. Sin embargo, esa indicación no está acompañada de ningún elemento de viabilidad.
Para el encapsulamiento, el documento 4.321.259 usa la fusión entre eritrocitos y liposomas que contienen hexafosfato de inositol. El documento US 5.612.207 usa una técnica por electroporación.... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento de lisis/resellado para preparar eritrocitos que contienen un ingrediente activo, comprendiendo el procedimiento las siguientes etapas: 5
(1) - suspender un pelete globular en una disolución isotónica que tiene un nivel de hematocrito igual o mayor que 65%, con refrigeración entre +1 y +8º C,
(2) - medir la fragilidad osmótica a partir de una muestra de eritrocitos de ese mismo pelete globular, pudiendo ser realizadas las etapas 1 y 2 en un orden cualquiera,
(3) - llevar a cabo un procedimiento de lisis e internalización del ingrediente activo, en el interior de la misma cámara, a una temperatura mantenida constantemente entre +1 y +8º C, que comprende permitir que la suspensión de eritrocitos, que tiene un nivel de hematocrito igual o mayor que 65%, y una disolución de lisis hipotónica, que está refrigerada entre +1 y 8º C, circulen en un cartucho de diálisis; ajustándose los parámetros de lisis según la fragilidad osmótica medida previamente, en el que el caudal de la suspensión de eritrocitos que pasa al cartucho de diálisis se ajusta, o la osmolaridad de la disolución de lisis se selecciona, basándose en la medida de la fragilidad osmótica; y (4) - llevar a cabo un procedimiento de resellado en una segunda cámara a una temperatura entre +30 y +40º C por medio de una disolución hipertónica.
2. Procedimiento según la reivindicación 1, en el que la fragilidad osmótica se mide por medio de un dispositivo de medición que se configura a fin de medir la fragilidad osmótica de una muestra de eritrocitos en menos de 15 minutos, y el resultado obtenido se usa en un breve período de tiempo a fin de ajustar los parámetros de la lisis.
3. Procedimiento según la reivindicación 1 ó 2, en el que uno o más parámetros de hemólisis de la muestra de eritrocitos se miden frente a una disolución hipotónica, que tiene una isotonicidad conocida, a través de una membrana semipermeable.
4. Procedimiento según la reivindicación 3, en el que se mide uno o más de los siguientes parámetros:
a. la osmolaridad del medio para el cual aparece la hemólisis,
b. la velocidad de la hemólisis, determinada por el gradiente de la parte lineal de la curva % de hemólisis = f (osmolaridad del medio) ,
c. el porcentaje de hemólisis para una osmolaridad dada,
d. la osmolaridad que permite obtener 50% de hemólisis, 35 e. el tiempo para obtener un cierto porcentaje de hemólisis.
5. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que se usa un módulo refrigerado provisto de un control de temperatura, se coloca en el módulo una bolsa de la suspensión de eritrocitos, que está refrigerada entre +1 y +8º C, y se conecta, o se va a conectar, a un conjunto retirable de un solo uso que comprende un cartucho de diálisis, tubos para conectar el cartucho, en un lado, a la bolsa y, en el otro lado, al matraz, comprendiendo además el módulo medios que pueden causar la circulación de la suspensión de eritrocitos y de la disolución de lisis, en el interior de cuyos módulos la temperatura se estabiliza entre +1 y +8º C.
6. Procedimiento según la reivindicación 5, en el que el procedimiento de lisis se comienza cuando la temperatura de 45 la suspensión en la bolsa está entre +1 y +8º C.
7. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que se mantiene un nivel estable de hematocrito en la suspensión durante todo el tiempo de su paso por el cartucho de diálisis.
50 8. Procedimiento según la reivindicación 7, en el que se usa una bolsa que está provista de una circulación de tipo bucle externa que puede provocar la circulación de la suspensión hacia y desde la bolsa.
9. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el ingrediente activo está presente en la bolsa de la suspensión y/o se introduce en la circulación de la suspensión antes y/o después del paso a través 55 del cartucho de diálisis.
10. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el pelete globular contiene eritrocitos que se han procesado previamente con una disolución que puede incrementar y/u homogeneizar su resistencia osmótica.
11. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que la temperatura durante las etapas 1 y 3 se mantiene entre +2 y +6º C, y es preferentemente de forma aproximada +4º C.
12. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el ingrediente activo se selecciona 65 de entre asparaginasa y hexofosfato de inositol.
13. Procedimiento según la reivindicación 12, para producir eritrocitos que incorporan asparaginasa destinados a tratar un paciente frente a leucemias linfoblásticas agudas y linfomas, o para producir eritrocitos que incorporan hexafosfato de inositol destinados a tratar tumores hipóxicos en asociación con un tratamiento de radioterapia, o tratar drepanocitosis u otros estado hipóxico.
14. Procedimiento según cualquiera de las reivindicaciones 1 a 13, en el que la fragilidad osmótica se mide en una muestra de la suspensión obtenida en la etapa (a) .
15. Procedimiento según la reivindicación 1, en el que la medida de la fragilidad osmótica llevada a cabo se usa rápidamente, es decir, el procedimiento de lisis se lleva a cabo poco tiempo después de que se toma la muestra, siendo el intervalo de tiempo entre la toma de muestra y el comienzo de la lisis menor o igual a 30 minutos, preferiblemente menor o igual a 25 minutos, más preferiblemente menor o igual a 20 minutos.
16. Procedimiento según la reivindicación 2, en el que se hace uso de un dispositivo que pone juntos, en un lado y otro de una membrana semipermeable, la muestra de la suspensión de eritrocitos a evaluar, y una disolución hipotónica, que tiene isotonicidad conocida, por ejemplo agua destilada, en un volumen adecuado, para generar una hemólisis lenta de los eritrocitos a medida que los iones de NaCl se difunden hacia la disolución, por ejemplo agua destilada, en el que el progreso de la hemólisis a lo largo del tiempo es seguido por una medida de la transmitancia por medio de un haz de láser que tiene una longitud de onda de 808 nm, y una célula fotoeléctrica mide las variaciones en la luz transmitida a través de la suspensión.
17. Procedimiento según cualquiera de las reivindicaciones 1 a 3 ó 16, en el que la medida de la fragilidad osmótica se lleva a cabo en eritrocitos, o una suspensión que los contiene, a una temperatura próxima o idéntica a la temperatura seleccionada para la lisis.
18. Procedimiento según la reivindicación 4, en el que la resistencia osmótica se caracteriza por medio de los parámetros b, d, o b y d.
19. Procedimiento según la reivindicación 14, en el que la suspensión obtenida en la etapa (1) contiene el ingrediente activo.
20. Procedimiento según la reivindicación 3, 4 ó 18, en el que se mide la concentración de NaCl, en g/l, que produce un 50% de hemólisis (parámetro d.) , y el caudal de la suspensión de eritrocitos en el cartucho de diálisis se ajusta según los valores de concentración medidos.
21. Procedimiento según la reivindicación 1, en el que el procedimiento de lisis se comienza cuando la temperatura de la suspensión de eritrocitos está entre +1 y +8º C, y la fragilidad osmótica se ha medido y se han registrado los parámetros de la lisis.
22. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que la disolución de lisis fluye a través del cartucho de diálisis a un caudal constante.
FIGURA 6
Patentes similares o relacionadas:
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Utilización de anticuerpos optimizados en ADCC para tratar a los pacientes con bajo nivel de respuesta, del 22 de Julio de 2020, de LABORATOIRE FRANCAIS DU FRACTIONNEMENT ET DES BIOTECHNOLOGIES: Utilización de una composición de anticuerpo monoclonal quimérico, humanizado o humano de isotipo IgG1 anti- Rhesus del glóbulo rojo humano cuya […]