Procedimiento para la liberación de determinadas flavanonas y dihidrochalconas por hidrólisis ácida.
Procedimiento para la liberación de
(a) hesperetina, homoeriodictiol o eriodictiol a partir de hesperidina,
neohesperidina, eriocitrina, 7-O-beta-Dglucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7,4'- di-O-beta-D-glucósido de homoeriodictiol o 7,4'-di-O-beta-D-glucósido de eriodictiol o (b) floretina, 3-hidroxifloretina o davidigenina a partir de floridzina, 2'-O-beta-D-glucósido de 3-hidroxifloretina, 2-O-beta-D-glucósido de davidigenina o 2'-(beta-D-xilosil-(1-6)-beta-D-glucósido) de floretina por hidrólisis ácida, con las siguientes etapas:
(i) suspender o disolver (a) hesperidina, neohesperidina, eriocitrina, 7-O-beta-D-glucósido de hesperetina, 7- O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7,4'-di-O-beta-D-glucósido de homoeriodictiol o 7,4'-di-O-beta-D-glucósido de eriodictiol o (b) floridzina, 2'-O-beta-D-glucósido de 3- hidroxifloretina, 2-O-beta-D-glucósido de davidigenina o 2'-(beta-D-xilosil-(1-6)-beta-D-glucósido) de floretina en un disolvente o agente de suspensión que comprende o está constituido por una cantidad de un ácido orgánico catalizadora de la hidrólisis ácida y agua;
(ii) calentar la mezcla resultante a una temperatura en el intervalo de 100 a 160ºC y mantener a esta temperatura durante un periodo de tiempo en el intervalo de 1 a 12 horas;
(iii) separar la (a) hesperetina, homoeriodictiol o eriodictiol o (b) floretina, 3-hidroxifloretina o davidigenina de la mezcla de productos resultante.
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E08156112.
Solicitante: SYMRISE GMBH & CO. KG.
Nacionalidad solicitante: Alemania.
Dirección: Mühlenfeldstrasse 1 37603 Holzminden ALEMANIA.
Inventor/es: GATFIELD, IAN, DR., Hilmer,Jens-Michael, Ley,Jakob.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D311/32 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 311/00 Compuestos heterocíclicos que contienen ciclos de seis miembros que contienen un átomo de oxígeno como único heteroátomo, condensados con otros ciclos. › 2, 3-dihidro derivados, p. ej. flavanonas.
- C07D311/40 C07D 311/00 […] › Separación, p. ej. a partir de materias naturales; Purificación.
PDF original: ES-2380870_T3.pdf
Fragmento de la descripción:
Procedimiento para la liberación de determinadas flavanonas y dihidrochalconas por hidrólisis ácida La presente invención se refiere a un procedimiento para la liberación de determinadas flavanonas y dihidrochalconas a partir de glucósidos de flavanona o glucósidos de dihidrochalcona por hidrólisis ácida.
La presente invención se refiere especialmente a un procedimiento para la liberación de (a) hesperetina a partir de hesperidina o (b) floretina a partir de floridzina por hidrólisis ácida.
Las siguientes realizaciones se refieren, a modo de ejemplo, principalmente a la liberación de (a) hesperetina a partir de hesperidina o (b) floretina a partir de floridzina por hidrólisis ácida. Pero además de estas liberaciones especialmente relevantes, la presente invención se refiere en general a la liberación de determinadas flavanonas y dihidrochalconas a partir de determinados glucósidos de flavanona o glucósidos de dihidrochalcona por hidrólisis ácida.
Las determinadas flavanonas en el sentido de la invención son hesperetina (preferiblemente, véase arriba) , homoeriodictiol y eriodictiol.
Los determinados glucósidos de flavanona en el sentido de la invención son hesperidina (preferiblemente, véase arriba) , neohesperidina, eriocitrina, 7-O-beta-D-glucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-Obeta-D-glucósido de homoeriodictiol, 7, 4'-di-O-beta-D-glucósido de homoeriodictiol y 7, 4'-di-O-beta-D-glucósido de eriodictiol.
Las determinadas dihidrochalconas en el sentido de la invención son floretina (preferiblemente, véase arriba) , 3hidroxifloretina y davidigenina.
Los determinados glucósidos de dihidrochalcona en el sentido de la invención son floridzina (preferiblemente, véase arriba) , 2'-O-beta-D-glucósido de 3-hidroxifloretina, 2-O-beta-D-glucósido de davidigenina y 2'- (beta-D-xilosil- (1-6) beta-D-glucósido) de floretina.
Las indicaciones sobre la liberación de (a) hesperetina a partir de hesperidina o (b) floretina a partir de floridzina por hidrólisis ácida son válidas, con las adaptaciones necesarias, para los otros compuestos mencionados.
Ya se conocen procedimientos para la preparación sintética de flavonoides como, por ejemplo, hesperetina y floretina, pero también, por ejemplo, quercetina a partir de los glucósidos correspondientes por hidrólisis ácida.
El documento ES 459665 describe la hidrólisis de hesperidina mediante calentamiento a reflujo en una mezcla de un alcohol de bajo peso molecular (1-3 átomos de C) y ácido clorhídrico o ácido sulfúrico 3 N durante al menos dos horas.
El documento US 4.150.038 (Wingard) describe la liberación de hesperetina a partir de hesperidina mediante calentamiento a reflujo en una mezcla de ácido mineral fuerte no oxidante y alcanol primario de bajo peso molecular. El alcanol comprende no más del 10% en peso de agua. Se indica que los ácidos minerales que contienen fósforo, el ácido sulfuroso y los ácidos orgánicos son demasiado débiles para catalizar efectivamente la reacción deseada.
J. Org. Chem. 25, 1829 (1960) (Looker y col.) da a conocer un procedimiento para la liberación de hesperetina a partir de hesperidina en el que el glucósido se calienta durante 60 a 72 horas en ácido sulfúrico del 2% en 50% de etanol.
Carbohydrate Research 328 (2000) 141-146 (Grohmann y col.) da a conocer la hidrólisis de una suspensión acuosa de hesperidina con ácido sulfúrico diluido a temperaturas en el intervalo de 100 a 180º C. El centro de las investigaciones descritas se encuentra en la hidrólisis parcial de la hesperidina con formación del 7-glucósido de hesperetina.
Otros procedimientos para la liberación de hesperetina a partir de hesperidina que no se basan en una hidrólisis ácida resultan, por ejemplo, de publicaciones de Kim y col. (Kim, Youn Chul; Higuchi, Ryuichi; Kitamura, Yoichi; Komori, Tetsuya, Thermal degradation of glycosides. IV. Degradation of flavonoid glycosides, Liebigs Annalen der Chemie (1991) , 12, 1285-1289) , así como Miyake y col. (Miyake, Yoshiaki; Minato, Kenichiro; Fukumoto, Syuichi; Yamamoto, Kanefumi; Oya-Ito, Tomoko; Kawakishi, Syunro; Osawa, Toshihiko; New potent antioxidative hidroxyflavanones produced with Aspergillus saitoi from flavanone glycoside in citrus fruit, Biosci. Biotechnol. Biochem. (2003) , 67 (7) , 1443 - 1450) .
A pesar de los procedimientos previamente mencionados y de otros procedimientos para la liberación de 2
hesperetina a partir de hesperidina (y correspondientemente para la liberación de floretina a partir de floridzina) , existe además una necesidad de procedimientos mejorados para la liberación de dichos flavonoides a partir de los glucósidos correspondientes. Los procedimientos conocidos hasta la fecha poseen concretamente respectivamente una o varias de las siguientes desventajas:
Baja productividad (baja concentración de producto de partida, bajo rendimiento, tiempo de reacción prolongado) ; baja pureza; formación de productos secundarios no deseados (por ejemplo, productos de descomposición de los azúcares liberados por la hidrólisis (ramnosa; glucosa) .
La hesperetina y la floretina poseen propiedades positivas en el marco de una alimentación sana. Por tanto, también existe un fuerte interés en procedimientos de producción técnicos en los que dichos flavonoides pueden prepararse con alto rendimiento y pureza bajo condiciones naturales.
Por tanto, el objetivo de la presente invención era especificar un procedimiento, en general, para la liberación de determinadas flavanonas y dihidrochalconas a partir de glucósidos de flavanona o glucósidos de dihidrochalcona y especialmente para la liberación de hesperetina a partir de hesperidina o para la liberación de floretina a partir de floridzina que en la utilización de altas concentraciones de producto de partida condujera a altos rendimientos. En el procedimiento que va a especificarse también será preferiblemente posible obtener los azúcares respectivamente liberados; esto es especialmente aplicable a la ramnosa que se libera a partir de hesperidina. El objetivo general planteado se alcanza mediante un procedimiento para la liberación de
(a) hesperetina, homoeriodictiol o eriodictiol a partir de hesperidina, neohesperidina, eriocitrina, 7-O-betaD-glucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7, 4'-di-O-beta-D-glucósido de homoeriodictiol o 7, 4'-di-O-beta-D-glucósido de eriodictiol o
(b) floretina, 3-hidroxifloretina o davidigenina a partir de floridzina, 2'-O-beta-D-glucósido de 3hidroxifloretina, 2-O-beta-D-glucósido de davidigenina o 2'- (beta-D-xilosil- (1-6) -beta-D-glucósido) de floretina
por hidrólisis ácida, con las siguientes etapas:
(i) suspender o disolver (a) hesperidina, neohesperidina, eriocitrina, 7-O-beta-D-glucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7, 4'-di-O-beta-D-glucósido de homoeriodictiol o 7, 4'-di-O-beta-D-glucósido de eriodictiol o (b) floridzina, 2'-O-beta-D-glucósido de 3hidroxifloretina, 2-O-beta-D-glucósido de davidigenina o 2'- (beta-D-xilosil- (1-6) -beta-D-glucósido) de floretina en un disolvente o agente de suspensión que comprende o está constituido por una cantidad de un ácido orgánico catalizadora de la hidrólisis ácida y agua;
(ii) calentar la mezcla resultante a una temperatura en el intervalo de 100 a 160º C y mantener a esta temperatura durante un periodo de tiempo en el intervalo de 1 a 12 horas;
(iii) separar la (a) hesperetina, homoeriodictiol o eriodictiol o (b) floretina, 3-hidroxifloretina o davidigenina de la mezcla de productos resultante.
Investigaciones propias fueron inicialmente, similarmente a las publicaciones anteriormente especificadas, en diferentes direcciones técnicas. Sin embargo, sorprendentemente, en vista de la suposición arriba referida de que los ácidos orgánicos no serían adecuados para la catálisis efectiva de la hidrólisis de hesperidina, se comprobó entonces que un procedimiento especial para la liberación de (a) hesperetina a partir de hesperidina o (b) floretina a partir de floridzina por hidrólisis ácida es especialmente adecuado para alcanzar el objetivo planteado, siempre y cuando comprenda las siguientes etapas:
(i) suspender o disolver (a) hesperidina o (b) floridzina en un disolvente o agente de suspensión que comprende o está constituido por una cantidad de un ácido orgánico catalizadora... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la liberación de
(a) hesperetina, homoeriodictiol o eriodictiol a partir de hesperidina, neohesperidina, eriocitrina, 7-O-beta-Dglucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7, 4'di-O-beta-D-glucósido de homoeriodictiol o 7, 4'-di-O-beta-D-glucósido de eriodictiol o
(b) floretina, 3-hidroxifloretina o davidigenina a partir de floridzina.
2. O-beta-D-glucósido de 3-hidroxifloretina, 2-O-beta-D-glucósido de davidigenina .
2. (beta-D-xilosil- (1-6) -beta-D-glucósido) de floretina
por hidrólisis ácida, con las siguientes etapas:
(i) suspender o disolver (a) hesperidina, neohesperidina, eriocitrina, 7-O-beta-D-glucósido de hesperetina.
7. beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7, 4'-di-O-beta-D-glucósido de homoeriodictiol o 7, 4'-di-O-beta-D-glucósido de eriodictiol o (b) floridzina.
2. O-beta-D-glucósido de 3hidroxifloretina, 2-O-beta-D-glucósido de davidigenina .
2. (beta-D-xilosil- (1-6) -beta-D-glucósido) de floretina en un disolvente o agente de suspensión que comprende o está constituido por una cantidad de un ácido orgánico catalizadora de la hidrólisis ácida y agua;
(ii) calentar la mezcla resultante a una temperatura en el intervalo de 100 a 160º C y mantener a esta temperatura durante un periodo de tiempo en el intervalo de 1 a 12 horas;
(iii) separar la (a) hesperetina, homoeriodictiol o eriodictiol o (b) floretina, 3-hidroxifloretina o davidigenina de la mezcla de productos resultante.
2. Procedimiento según la reivindicación 1 para la liberación de
(a) hesperetina a partir de hesperidina o (b) floretina a partir de floridzina por hidrólisis ácida, con las siguientes etapas:
(i) suspender o disolver (a) hesperidina o (b) floridzina en un disolvente o agente de suspensión que comprende o está constituido por una cantidad de un ácido orgánico catalizadora de la hidrólisis ácida y agua;
(ii) calentar la mezcla resultante a una temperatura en el intervalo de 100 a 160º C y mantener a esta temperatura durante un periodo de tiempo en el intervalo de 1 a 12 horas;
(iii) separar la (a) hesperetina o (b) floretina de la mezcla de productos resultante.
3. Procedimiento según la reivindicación 2 con las siguientes etapas:
(i) suspender o disolver del 5 al 50% en peso, preferiblemente del 10 al 30% en peso, de (a) hesperidina o
(b) floridzina en un disolvente o agente de suspensión que comprende:
- 5 a 50% en peso de acetona, metanol, etanol, n-propanol, i-propanol, n-butanol o una mezcla de estos compuestos y
- el resto agua, así como una cantidad de un ácido orgánico catalizadora de la hidrólisis ácida,
estando referidos los datos de porcentaje en peso respectivamente a la cantidad total de disolución o suspensión;
(ii) calentar la mezcla resultante a una temperatura en el intervalo de 100 a 160º C y mantener a esta temperatura durante un periodo de tiempo en el intervalo de 1 a 12 horas, (iii) precipitar la (a) hesperetina o (b) floretina de la mezcla de productos resultante.
4. Procedimiento según una de las reivindicaciones precedentes, en el que la suspensión o disolución presente después de la etapa (i) comprende:
- 5 a 30% en peso de (a) hesperidina o (b) floridzina,
- 10 a 40% en peso en total de acetona y etanol,
- 30 a 85% en peso de agua,
referido a la cantidad total de suspensión o disolución.
5. Procedimiento según una de las reivindicaciones precedentes, en el que el ácido orgánico se selecciona del grupo de ácidos orgánicos con al menos 2 átomos de C y sus mezclas y preferiblemente se selecciona del grupo constituido por: ácido cítrico, ácido oxálico, ácido láctico, ácido acético y sus mezclas.
6. Procedimiento según la reivindicación 1 ó 2, en el que en la etapa (i) el disolvente o agente de suspensión es una mezcla que comprende o está constituida por ácido láctico, agua y dado el caso lactida, siendo la cantidad de agua al menos equimolar con respecto a la cantidad utilizada de
(a) hesperidina, neohesperidina, eriocitrina, 7-O-beta-D-glucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7, 4'-di-O-beta-D-glucósido de homoeriodictiol o 7, 4'-diO-beta-D-glucósido de eriodictiol o
(b) floridzina.
2. O-beta-D-glucósido de 3-hidroxifloretina, 2-O-beta-D-glucósido de davidigenina .
2. (beta-Dxilosil- (1-6) -beta-D-glucósido) de floretina.
7. Procedimiento según la reivindicación 6, en el que la disolución o suspensión presente después de la etapa (i) comprende del 5 al 50% en peso, preferiblemente del 10 al 30% en peso, de (a) hesperidina o (b) floridzina, referido a la cantidad total de suspensión o disolución.
8. Procedimiento para la liberación de hesperetina a partir de hesperidina según una de las reivindicaciones precedentes, en el que a partir de la mezcla de productos se separa hesperetina, así como en una etapa adicional se separa ramnosa.
9. Procedimiento según una de las reivindicaciones precedentes, en el que la suspensión o disolución presente después de la etapa (i) posee un pH inferior a 4, preferiblemente inferior a 3.
10. Procedimiento según una de las reivindicaciones precedentes, en el que en la etapa (ii) la mezcla resultante se calienta a una temperatura en el intervalo de 125 a 145º C y a esta temperatura se mantiene durante un periodo de tiempo en el intervalo de 1 a 12 horas.
11. Uso de un ácido orgánico como catalizador de hidrólisis en la liberación de
(a) hesperetina, homoeriodictiol o eriodictiol a partir de hesperidina, neohesperidina, eriocitrina, 7-O-beta-Dglucósido de hesperetina, 7-O-beta-D-glucósido de eriodictiol, 7-O-beta-D-glucósido de homoeriodictiol, 7, 4'di-O-beta-D-glucósido de homoeriodictiol o 7, 4'-di-O-beta-D-glucósido de eriodictiol o
(b) floretina, 3-hidroxifloretina o davidigenina a partir de floridzina.
2. O-beta-D-glucósido de 3-hidroxifloretina, 2-O-beta-D-glucósido de davidigenina .
2. (beta-D-xilosil- (1-6) -beta-D-glucósido) de floretina
a escala industrial.
12. Uso de un ácido orgánico como catalizador de hidrólisis en la liberación de
(a) hesperetina a partir de hesperidina o (b) floretina a partir de floridzina a escala industrial.
Patentes similares o relacionadas:
Materiales recubiertos con bioflavonoides, del 6 de Noviembre de 2019, de Citrox Biosciences Limited: Un material polimérico sintético que tiene un recubrimiento con bioflavonoides, comprendiendo el contenido de bioflavonoides del recubrimiento al menos naringina y neohesperidina, […]
Composiciones líquidas que contienen aceites esenciales de la cáscara procedente de frutas cítricas, del 19 de Septiembre de 2016, de Suntory Beverage & Food Limited: Composiciones líquidas que contienen aceites esenciales de la cáscara procedente de frutas cítricas. Una composición líquida adecuada para la inclusión en […]
Composiciones líquidas que contienen aceites esenciales extraídos de la cáscara de frutas cítricas, del 19 de Septiembre de 2016, de Suntory Beverage & Food Limited: Composiciones líquidas que contienen aceites esenciales extraídos de la cáscara de frutas cítricas. Una composición líquida adecuada para la inclusión en bebidas […]
Material antioxidante, agente antideterioro, y alimento o bebida, del 30 de Marzo de 2016, de POKKA SAPPORO FOOD & BEVERAGE LTD: Un procedimiento de preparación de un material antioxidante que contiene una aglicona flavonoide y vitamina C, en el que la aglicona flavonoide es eriodictiol y/o diosmetina, […]
Dos tipos de forma cristalina de pinocembrina: a y b, su preparación y su uso para la fabricación de composiciones farmacéuticas, del 9 de Abril de 2014, de CSPC Zhongqi Pharmaceutical Technology (Shijiazhuang) Co., Ltd: Forma cristalina ß de pinocembrina racémica de formula (I):**Fórmula** caracterizada porque, cuando se analiza por difracción en polvo […]
USO DE DIPEPTIDOS DE OXAMILO MODIFICADOS EN EL EXTREMO C COMO INHIBIDORES DE LA FAMILIA ICE/CED-3 DE CISTEINA PROTEASAS, del 14 de Diciembre de 2009, de IDUN PHARMACEUTICALS, INC.: El uso de un compuesto de la siguiente fórmula:** ver fórmula** en la que: A es un aminoácido natural o no natural de fórmula IIa-i: ** ver fórmula** B es un átomo de hidrógeno, […]
DIPEPTIDOS DE OXAMILO C-TERMINALES MODIFICADOS COMO INHIBIDORES DE LA FAMILIA DE CISTEINA PROTEASAS ICE/CED-3., del 16 de Junio de 2007, de IDUN PHARMACEUTICALS, INC.: Un compuesto de la siguiente **fórmula**, en la que: A es un aminoácido natural o no natural B es un átomo de hidrógeno, un átomo de deuterio, alquilo, cicloalquilo, fenilo, […]
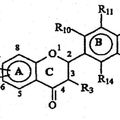 COMPUESTOS FLAVONOIDES COMO ANTIOXIDANTES TERAPEUTICOS, del 1 de Abril de 2008, de ANTOXIS LIMITED: Compuesto que tiene la Fórmula 1 siguiente: (Ver fórmula) en la que RA es una cadena hidrocarbonada saturada o insaturada C2 a C30. R10, R11, R13, R14 y R3 cada uno independientemente […]
COMPUESTOS FLAVONOIDES COMO ANTIOXIDANTES TERAPEUTICOS, del 1 de Abril de 2008, de ANTOXIS LIMITED: Compuesto que tiene la Fórmula 1 siguiente: (Ver fórmula) en la que RA es una cadena hidrocarbonada saturada o insaturada C2 a C30. R10, R11, R13, R14 y R3 cada uno independientemente […]