Procedimiento para la fabricación de intermediarios monobactamo puenteados.
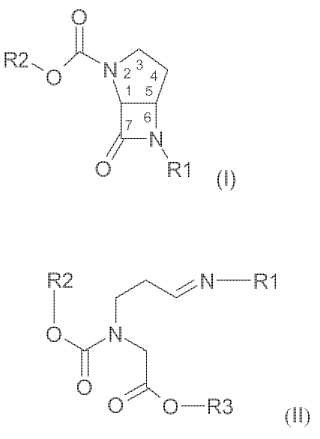
Procedimiento para la fabricación de un compuesto de fórmula (I):
que presentan conformación cis y en los que:
R1 representa un grupo 1-fenil-alquilo-C1-C4 ó 1-naftil-alquilo-C1-C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi o, preferentemente, se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono, y:
R2 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido,
en cuyo procedimiento un compuesto de fórmula (II):
en la que: R3 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido, y R1 y R2 presentan el mismo significado que en la fórmula (I):
se trata con una base a una temperatura de 0ºC o inferior en un solvente aprótico líquido durante un periodo de tiempo suficiente para obtener el compuesto de fórmula (I).
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/062258.
Solicitante: BASILEA PHARMACEUTICA AG.
Nacionalidad solicitante: Suiza.
Dirección: GRENZACHERSTRASSE 487 4005 BASEL SUIZA.
Inventor/es: MULLER, MARC, XU, LIN, WU,XIAOPING.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07C237/20 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 237/00 Amidas de ácidos carboxílicos, estando sustituida la estructura carbonada de la parte ácida por grupos amino. › conteniendo la estructura carbonada ciclos aromáticos de seis miembros.
- C07D487/04 C07 […] › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 487/00 Compuestos heterocíclicos que contienen átomos de nitrógeno como únicos heteroátomos del ciclo en el sistema condensado, no previstos por los grupos C07D 451/00 - C07D 477/00. › Sistemas condensados en orto.
PDF original: ES-2419255_T3.pdf
Fragmento de la descripción:
Procedimiento para la fabricación de intermediarios monobactamo puenteados La presente invención se refiere a la fabricación de compuestos de fórmula (I) :
que presentan la conformación cis y en los que R1 y R2 presentan los significados definidos en detalle posteriormente en la presente memoria, encontrándose descrita la utilización de los mismos en los documentos nº
EP A-0 508 234 y nº WO 2007/065288, que resultan particularmente útiles en el tratamiento de las infecciones bacterianas, determinados nuevos intermediarios de dicha fórmula (I) y un nuevo intermediario para la fabricación de compuestos de fórmula (I) .
Al contrario que otros β-lactamos, tales como las cefalosporinas o la penicilina, los monobactamos no se derivan de 15 una fermentación de un producto natural sino que son compuestos totalmente sintéticos.
Los monobactamos puenteados, un grupo específicos de monobactamos (ver, por ejemplo, Heinze-Krauss et al., J. Med. Chem. 41:3961-3971, 1998, y C. Hubschwerlen et al., J. Med. Chem. 41:3971-3975, 1998) han sido fabricados convencionalmente en un procedimiento que muestra un gran número de etapas de procedimiento y etapas de protección/desprotección de intermediarios, que además requiere la utilización de reactivos caros y que, debido a las muchas etapas requeridas, resulta en un rendimiento global bastante pobre. Además, dichos procedimientos convencionales de fabricación requieren la realización de varias etapas cromatográficas de purificación durante el curso del procedimiento. El procedimiento se muestra esquemáticamente en el Esquema de reacción 1, y se da a conocer en los documentos nº EP-A-0073061 y nº EP-A-0508234, así como en J. Med. Chem. 41:3961-3971, 1998.
Además, ya se ha descrito en la técnica anterior una cicloadición [2+2] intramolecular estereoselectiva de una imina en un andamiaje orto-bencílico, que conduce a azetidino-1, 2-dihidroquinazolinas (ver Journal of Organic Chemistr y 65 (22) :7512-7515, 2000) .
La presente invención se basa en un nuevo resultado: los compuestos de fórmula (I) , incluyendo el compuesto de fórmula (I-C) indicado en el Esquema 1,
que presentan conformación cis y en los que: R1 representa un grupo 1-fenil-alquilo-C1-C4 o 1-naftil-alquilo-C1-C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3
y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi, y R2 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido, pueden prepararse mediante el tratamiento de un compuesto de fórmula (II) :
en la que:
R3 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido, y R1 y R2 presentan el mismo significado que en la fórmula (I) anteriormente indicada, con una base a una temperatura de 0ºC o inferior en un solvente aprótico líquido durante un periodo de tiempo suficiente para obtener el compuesto de fórmula (I) .
Sin deseo de restringirse a ningún mecanismo específico de reacción, la nueva síntesis podría considerarse formalmente como una cicloadición [2+2] intramolecular de la fracción imina del compuesto de fórmula (II) con una fracción ceteno/enolato formada in situ en dicho compuesto.
La nueva síntesis proporciona buenos rendimientos y permite la utilización de materiales de partida económicos y fácilmente disponibles y es, en el caso de las fracciones R1 quirales, altamente estereoselectivo y enantioselectivo.
En un aspecto, la invención se refiere de esta manera al procedimiento anteriormente indicado.
En un aspecto adicional, la invención se refiere a un compuesto de fórmula (II) :
en la que: R1 representa un grupo 1-fenil-alquilo-C1-C4 o 1-naftil-alquilo-C1-C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi, y
R2 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido, y R3 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido.
Los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 preferentemente se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono.
Una realización específicamente preferente de los compuestos indicados de fórmula (II) son compuestos de fórmula (II-A) tal como se define posteriormente en la presente memoria.
Una realización específicamente preferente adicional de los compuestos indicados de fórmula (II) son compuestos de fórmula (II-B) tal como se define posteriormente en la presente memoria.
Todavía otra realización específicamente preferente de los compuestos indicados de fórmula (II) son compuestos de fórmula (II-C) tal como se define posteriormente en la presente memoria.
En todavía otro aspecto, la invención se refiere a un compuesto seleccionado de entre los todavía otros compuestos nuevos de fórmula (I) :
Entre estos nuevos compuestos se incluyen específicamente compuestos de fórmula (I) que presentan la conformación cis, en los que R1 representa un grupo 1-fenil-alquilo-C2-C4 o 1-naftil-alquilo-C2-C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituido o sustituido con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 son, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituido o sustituido con alcoxi-C1-C4 y/o sililoxi o, preferentemente, se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono, en particular un grupo seleccionado de entre un grupo (1S) -1-fenil-alquilo-C2-C4, un grupo (1S) -1-naftil-alquilo-C2-C4, un grupo (1R) -1-fenil-alquilo-C2-C4 y un grupo (1R) -1-naftil-alquilo-C2-C4, más preferentemente (1S) -1-fenil-etilo y (1R) 1-fenil-etilo y R2 representa un grupo alquilo-C1-C6, preferentemente terc-butilo o un grupo bencilo sustituido, o más preferentemente un grupo bencilo no sustituido.
Para los fines de la presente solicitud, la descripción de la configuración del átomo en la posición 1 de la parte alquilo en los grupos 1-fenil-alquilo-C2-C4 o 1-naftil-alquilo-C2-C4 como " (1S) " o " (1R) " ("el estereodescriptor") se refiere a la configuración del átomo de carbono respectivo en el caso de que dicho grupo se encuentre unido al resto de la molécula y en el caso de que el grupo no se encuentre adicionalmente sustituido o, en el caso de que sí se encuentre, se considera que no se encuentra adicionalmente sustituido. Según la aplicación habitual de los estereodescriptores en la nomenclatura química sistemática (ver R.S. Cahn, C.K. Ingold y V. Prelog, Angew. Chem. Internat. Ed. Eng. 5:385-415, 511, 1966, y V. Prelog y G. Helmchen, Angew. Chem. Internat. Ed. Eng. 21:567-583, 1982) , el estereodescriptor puede cambiar en el caso de que el grupo 1-fenil-alquilo-C2-C4 o 1-naftil-alquilo-C2-C4 se sustituya adicionalmente con alcoxi o sililoxi, en particular en el átomo de carbono de la posición 2 de la parte alquilo de dicho grupo, aunque la disposición estérica de los átomos/grupos unidos al átomo de carbono en la posición 1 no cambia prácticamente, tal como se muestra en el ejemplo siguiente:
en los que N representa el átomo de nitrógeno unido a R1 en la fórmula (I) o (II) . Sin embargo, para los fines de la presente solicitud, los estereodescriptores "1S" y "1R" en los grupos 1-fenil-alquilo-C2-C4 o 1-naftil-alquilo-C2-C4 sustituidos, R1 corresponde a los de los grupos 1-fenil-alquilo-C2-C4 o 1-naftil-alquilo-C2-C4 no sustituidos correspondientes.
Además, la expresión "compuestos de fórmula (I) :
que presentan la conformación cis" se refiere, para los fines de la presente solicitud, en particular a los compuestos de fórmulas (I-A) , (I-B) y (I-C) , indicadas posteriormente en la presente memoria.
Entre las expresiones "1-fenil-alquilo-C1-C4" y "1-naftil-alquilo-C1-C4" se incluyen, por ejemplo, bencilo, 1-fenil-etilo, 1fenil-n-propilo y 1-fenil-n-butilo, así como los grupos naftil-metilo, 1-naftil-etilo, 1-naftil-n-propilo y 1-naftil-n-butilo,
incluyendo las formas enantioméricas correspondientes sustancialmente puras de dichos residuos,... [Seguir leyendo]
Reivindicaciones:
1. Procedimiento para la fabricación de un compuesto de fórmula (I) :
que presentan conformación cis y en los que: R1 representa un grupo 1-fenil-alquilo-C1-C4 ó 1-naftil-alquilo-C1-C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3
y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi o, preferentemente, se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono, y: R2 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido, en cuyo procedimiento un compuesto de fórmula (II) :
en la que: R3 representa un grupo alquilo-C1-C6 o un grupo bencilo no sustituido o sustituido, y R1 y R2 presentan el mismo significado que en la fórmula (I) :
se trata con una base a una temperatura de 0ºC o inferior en un solvente aprótico líquido durante un periodo de tiempo suficiente para obtener el compuesto de fórmula (I) .
2. Procedimiento según la reivindicación 1 para la fabricación de un compuesto de fórmula (I) , en la que dicho 25 compuesto se selecciona de entre los compuestos de fórmula (I-A) :
en la que: 30 R1 representa un grupo (1S) -1-fenil-alquilo-C2-C4 o un grupo (1S) -1-naftil-alquilo-C2-C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi o, preferentemente, se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono, y:
R2 presenta el significado que en la reivindicación 1, en cuyo procedimiento un compuesto de fórmula (II-A) :
en la que: R1 presenta el mismo significado que en la fórmula (I-A) , y R2 y R3 presentan el mismo significado que en 5 la reivindicación 1, se trata con una base a una temperatura de 0ºC o inferior en un solvente aprótico líquido durante un periodo de tiempo suficiente para obtener el compuesto de fórmula (I-A) .
3. Procedimiento según la reivindicación 1 para la fabricación de un compuesto de fórmula (I) , en la que dicho compuesto se selecciona de entre los compuestos de fórmula (I-B) :
en la que: R1 representa un grupo (1R) -1-fenil-alquilo-C2-C4 o un grupo (1R) -1-naftil-alquilo-C2-C4, en los que la fracción fenilo
o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi o, preferentemente, se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono y R2 presenta el significado que en la reivindicación 1,
en cuyo procedimiento un compuesto de fórmula (II-B) :
en la que: R1 presenta el mismo significado que en la fórmula (I-B) , y R2 y R3 presentan el mismo significado que en la reivindicación 1, se trata con una base a una temperatura de 0ºC o inferior en un solvente aprótico líquido durante un periodo de tiempo suficiente para obtener el compuesto de fórmula (I-B) .
4. Procedimiento según la reivindicación 1 para la fabricación de un compuesto de fórmula (I) , en la que dicho 30 compuesto se selecciona de entre los racematos (I-C) de compuestos de fórmula (I) :
que presentan conformación cis y en los que: R1 representa un grupo bencilo o naftilmetilo o un grupo racémico 1-fenil-alquilo-C2-C4 o un grupo 1-naftil-alquilo-C2
C4, en los que la fracción fenilo o naftilo de R1 se encuentra no sustituida o sustituida con uno o más grupos alcoxi-C1-C4 y los átomos de carbono en la posición 2, 3 y/o 4 de la parte alquilo de R1 se encuentran, independientemente de la fracción fenilo o naftilo de R1 e independientemente unos de otros, no sustituidos o sustituidos con alcoxi-C1-C4 y/o sililoxi o, preferentemente, se encuentran no sustituidos o sustituidos con un grupo alcoxi-C1-C4 y/o grupo sililoxi por cada átomo de carbono y R2 presenta el mismo significado que en la reivindicación 1, en cuyo procedimiento un compuesto de fórmula (II-C) :
en la que: R1 presenta el mismo significado que en la fórmula (I-C) , y R2 y R3 presentan el mismo significado que en la reivindicación 1, se trata con una base a una temperatura de 0ºC o inferior en un solvente aprótico líquido durante un periodo de tiempo suficiente para obtener el compuesto de fórmula (I-C) .
5. Procedimiento según cualquiera de las reivindicaciones 1 a 4, en el que dicha base se selecciona de entre NaH, diisopropilamida de litio (LDA) , hexametildisilazida de litio, sodio o potasio (LiHMDS, NaHMDS, KHMDS) , 1, 5diazabiciclo[4.3.0]non-5-eno (DBN) y 1, 8-diazabiciclo[5.4.0]undec-7-eno (DBU) .
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, en el que dicha temperatura es de entre -78ºC y 0ºC.
7. Procedimiento según cualquiera de las reivindicaciones 1 a 6, en el que dicho solvente se selecciona de entre éter dietílico, tetrahidrofurano (THF) , éter terc-butilmetílico (TBME) , éter de petróleo; alcanos líquidos con un máximo de 8 átomos de carbono, cicloalcanos líquidos con un máximo de 8 átomos de carbono, benceno o un benceno sustituido con uno o más grupos alquilo-C1-C4.
8. Procedimiento según cualquiera de las reivindicaciones 1 a 7, en el que el tiempo de reacción es de entre 1 y 20 horas.
9. Procedimiento según cualquiera de las reivindicaciones 1 a 8, en el que resultan de aplicación una o más de las condiciones siguientes, y particularmente la totalidad de dichas condiciones:
dicha base se selecciona de entre diisopropilamida de litio (LDA) y hexametildisilazida de litio (LiHMDS) , dicha 40 temperatura es de entre -78ºC y -70ºC, dicho solvente es tetrahidrofurano (THF) , ydicho tiempo de reacción es de entre 1 y 12 horas.
10. Procedimiento según cualquiera de las reivindicaciones 1 a 9, en el que: R1 se selecciona de entre (1S) -1-fenil-etilo, (1R) -1-fenil-etilo, 1-fenil-etilo racémico, 2, 4-dimetoxibencilo y 3, 4
dimetoxibencilo, R2 se selecciona de entre terc-butilo y bencilo, y R3 se selecciona de entre grupos alquilo-C1-C4, en particular etilo y bencilo.
11. Procedimiento según cualquiera de las reivindicaciones 1 a 10, en el que el compuesto de fórmula (II) se obtiene haciendo reaccionar un compuesto de fórmula (III) con una amina primaria de fórmula (IV) :
en la que R1, R2 y R3 son tal como se define en cualquiera de las reivindicaciones 1 a 4 ó 10.
12. Procedimiento según la reivindicación 11, en el que el compuesto de fórmula (II) obtenido según la reivindicación 11 se utiliza para fabricar el compuesto de fórmula (I) sin purificación previa.
13. Procedimiento según la reivindicación 11 ó 12, en el que el compuesto de fórmula (III) se hace reaccionar con la amina primaria de fórmula (IV) a temperaturas de entre -20ºC y 80ºC en un solvente aprótico líquido, en presencia de un agente desecante o con eliminación azeotrópica del agua formada en dicho procedimiento bajo presión reducida.
14. Procedimiento según la reivindicación 13, en el que resultan de aplicación una o más de las condiciones siguientes, y particularmente la totalidad de dichas condiciones:
dicha temperatura es la temperatura ambiente, por ejemplo de entre 20ºC y 30ºC, dicho solvente se selecciona de entre éter terc-butilmetílico (TBME) , éter dietílico, tetrahidrofurano (THF) , cloruro
de metileno, dioxano, alcanos-C5-C7, cicloalcanos-C5-C7, benceno o bencenos sustituidos con uno o más grupos alquilo-C1-C4, formamida, dimetilformamida (DMF) , 1, 3-dimetil-3, 4, 5, 6-tetrahidro-2 (1H) -pirimidinona (DMPU) , dicho agente desecante se selecciona de entre sulfato de magnesio anhidro, sulfato de sodio anhidro y tamices moleculares o, preferentemente, el agua formada en dicho procedimiento se elimina azeotrópicamente bajo presión reducida.
15. Procedimiento según cualquiera de las reivindicaciones 1 a 14, en el que dicho compuesto de fórmula (I) es un intermediario y se procesa adicionalmente, rindiendo un compuesto de fórmula (A) :
que presenta la conformación cis y en el que: R2 presenta uno de los significados según la reivindicación 1 ó 10 y presenta el mismo significado en la fórmula (I) .
16. Procedimiento según la reivindicación 15, en el que:
R1 en la fórmula (I) se selecciona de entre (1S) -1-fenil-etilo, (1R) -1-fenil-etilo y 1-fenil-etilo racémico, R3 en la fórmula (I) presenta uno de los significados según la reivindicación 1 ó 10, y R2 presenta el significado definido en la reivindicación 15, en el que el compuesto de fórmula (I) se hace reaccionar con un metal alcalino seleccionado de entre litio, potasio y preferentemente sodio, en amonio líquido en presencia de un alcohol C1-C4.
17. Procedimiento según la reivindicación 15, en el que: R1 en la fórmula (I) se selecciona de entre 2, 4-dimetoxibeniclo y 3, 4-dimetoxibencilo,
R3 en la fórmula (I) presenta uno de los significados según la reivindicación 1 ó 10, y
R2 presenta el significado definido en la reivindicación 15,
en el que el compuesto de fórmula (I) se hace reaccionar con una sal peroxosulfato o peroxodisulfato en un solvente tal como, por ejemplo, acetonitrilo, acetonitrilo/agua y similar.
18. Procedimiento según cualquiera de las reivindicaciones 1 a 17, en el que un compuesto de fórmula (I) o un compuesto de fórmula (A) obtenido según cualquiera de las reivindicaciones 1 a 17 se procesa adicionalmente, rindiendo un derivado del mismo, en particular un compuesto ácido 6-sulfónico correspondiente o una sal del mismo,
en particular un compuesto inhibidor de β-lactamasa, tal como, en particular, ácido (1S, 5R) -2-[N- (4-{
Patentes similares o relacionadas:
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
1,5-Dihidro-4H-pirazolo[3,4-d]pirimidin-4-onas y 1,5-dihidro-4H-pirazolo[4,3-c]piridin-4-onas como inhibidores de la PDE1, del 29 de Julio de 2020, de H. LUNDBECK A/S: Un compuesto de fórmula (I) **(Ver fórmula)** en donde Y es N o CH; R1 se selecciona del grupo que consiste en alquilo C2-C8 lineal o ramificado, cicloalquilo […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Compuestos de heteroaril carboxamida como inhibidores de RIPK2, del 29 de Julio de 2020, de BOEHRINGER INGELHEIM INTERNATIONAL GMBH: Un compuesto de fórmula (I): **(Ver fórmula)** o sus sales farmacéuticamente aceptables, en la que: X es N y Y es CH; o X es CH y Y es N; […]
Ureas cíclicas como inhibidores de ROCK, del 22 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de acuerdo con la Fórmula (I): **(Ver fórmula)** o un enantiómero, un diastereómero, un estereoisómero, un tautómero, una sal farmacéuticamente aceptable […]
Derivado heteroarilo o sal farmacéuticamente aceptable del mismo, método de preparación del mismo y composición farmacéutica para prevenir o tratar enfermedades asociadas con PI3 quinasas, que contiene el mismo como principio activo, del 22 de Julio de 2020, de KOREA RESEARCH INSTITUTE OF CHEMICAL TECHNOLOGY: Un compuesto representado por la fórmula 1, un isómero óptico del mismo o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** en la fórmula […]
Derivados de 5-[2-(piridin-2-ilamino)-1,3-tiazol-5-il]-2,3-dihidro-1H-isoindol-1-ona y su uso como inhibidores dobles de fosfatidilinositol··3-cinasa delta y gamma, del 15 de Julio de 2020, de ASTRAZENECA AB: Compuesto de formula (I) **(Ver fórmula)** donde X es C(O) o SO2; Y es SO2NHR5 o SO2R6; R1 se selecciona de alquilo C1-4, […]
Antagonistas del receptor de dopamina D3 que tienen una unidad estructural biciclo, del 15 de Julio de 2020, de Indivior UK Limited: Un compuesto, o una sal farmacéuticamente aceptable del mismo, que tiene la fórmula: **(Ver fórmula)** en donde; A y B juntos tienen la fórmula: **(Ver […]