PROCEDIMIENTO DE ADMINISTRACION DE SPRAY NASAL.
Pulverizador nasal (10) que presenta un frasco (12) con una formulación (14) que comprende olopatadina,
caracterizado porque el pulverizador está configurado para administrar un spray de dicha formulación con una característica de pulverización que comprende por lo menos uno de entre: un patrón de pulverización con el eje más largo de 20 a 45 mm, el eje más corto de 14 a 20 mm y una elipticidad de 1 a 1,8, y/o una distribución de tamaños de gotitas con un D10 de 15-30 µm, un D50 de 30-60 µm, un D90 de 50-150 µm, un SPAN de no más de 3, y un % de volumen < 10 µm de menos de un 4%
Tipo: Resumen de patente/invención. Número de Solicitud: W05039268US.
Solicitante: ALCON, INC.
Nacionalidad solicitante: Suiza.
Dirección: P.O. BOX 62 BOSCH 69,6331 HUNENBERG.
Inventor/es: WALL, G., MICHAEL, CAGLE, GERALD.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Septiembre de 2009.
Clasificación Internacional de Patentes:
- A61K31/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales que contienen ingredientes orgánicos activos.
- A61K31/335 A61K […] › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen el oxígeno como único heteroátomo de un ciclo, p. ej. fungicromina.
- A61K31/445 A61K 31/00 […] › Piperidinas no condensadas, p. ej. piperocaína.
- A61M15/08 A61 […] › A61M DISPOSITIVOS PARA INTRODUCIR AGENTES EN EL CUERPO O PARA DEPOSITARLOS SOBRE EL MISMO (introducción de remedios en o sobre el cuerpo de animales A61D 7/00; medios para la inserción de tampones A61F 13/26; dispositivos para la administración vía oral de alimentos o medicinas A61J; recipientes para la recogida, almacenamiento o administración de sangre o de fluidos médicos A61J 1/05 ); DISPOSITIVOS PARA HACER CIRCULAR LOS AGENTES POR EL CUERPO O PARA SU EXTRACCION (cirugía A61B; aspectos químicos de los artículos quirúrgicos A61L; magnetoterapia utilizando elementos magnéticos colocados dentro del cuerpo A61N 2/10 ); DISPOSITIVOS PARA INDUCIR UN ESTADO DE SUEÑO O LETARGIA O PARA PONERLE FIN. › A61M 15/00 Inhaladores. › Dispositivos de inhalación colocados en la nariz.
Clasificación PCT:
- A61K31/335 A61K 31/00 […] › que tienen el oxígeno como único heteroátomo de un ciclo, p. ej. fungicromina.
Fragmento de la descripción:
Procedimiento de administración de spray nasal.
La presente solicitud reivindica la prioridad de la solicitud provisional US nº 60/630.886 presentada el 24 de noviembre de 2004.
Campo de la invención
La presente invención pertenece en general a la administración de sprays nasales y, más particularmente, a la administración de sprays nasales que contienen olopatadina.
Descripción de la técnica relacionada
Existe una variedad de sprays nasales disponibles para el tratamiento de rinitis alérgica. Ejemplos de productos incluyen el spray nasal FLO-NASE® disponible en GlaxoSmithKline del Reino Unido; el spray nasal NASONEX® disponible en Schering Corporation de Kennilworth, Nueva Jersey; y el spray nasal ASTELIN® disponible en MedPointe Pharmaceuticals de Somerset, Nueva Jersey. Todos estos productos administran formulaciones tópicas a través de pulverizadores de bomba convencionales disponibles en proveedores tales como Pfeiffer de Alemania; Saint- Gobain Calmar de Francia o Valois de Francia.
Las patentes US nº 4.871.865 y 4.923.892, ambas cedidas a Burroughs Wellcome Co. ("las patentes de Burroughs Wellcome"), describen que ciertos derivados de ácido carboxílico de la doxepina, incluyendo la olopatadina (nombre químico: ácido Z-11-(3-dimetilaminopropiliden)-6,11-dihidrodibenz[b,e]oxepin-2- acético), tienen actividad antihistamínica y antiasmática. Las patentes de Burroughs Wellcome muestran varias formulaciones farmacéuticas que contienen los derivados de ácido carboxílico de la doxepina, incluyendo formulaciones de spray nasal y oftálmicas. Véanse, por ejemplo, la Columna 7, líneas 7-26, y los Ejemplos 8 (H) y 8 (I) de la patente '865.
La patente US nº 5.116.863, cedida a Kyowa Hakko Kogyo Co., Ltd., ("la patente de Kyowa"), enseña que los derivados de ácido acético de la doxepina y, en particular, la olopatadina tienen actividad antialérgica y antiinflamatoria. Las formas de medicamentos mostradas por la patente de Kyowa para los derivados de ácido acético de doxepina incluyen una amplia gama de vehículos aceptables; sin embargo, sólo se mencionan formas de administración oral y de inyección.
La patente US nº 5.641.805, cedida a Alcon Laboratories, Inc. y a Kyowa Hakko Kogyo Co., Ltd, muestra formulaciones oftálmicas tópicas que contienen olopatadina para tratar enfermedades oculares alérgicas. De acuerdo con la patente '805, las formulaciones tópicas pueden ser soluciones, suspensiones o geles.
El PATANOL® (solución oftálmica de hidrocloruro de olopatadina) al 0,1% de Alcon Laboratories, Inc. de Fort Worth, Texas, es actualmente el único producto de olopatadina comercialmente disponible para utilización oftálmica. De acuerdo con su información de etiquetado, contiene hidrocloruro de olopatadina equivalente a 0,1% de olopatadina, 0,01% de cloruro de benzalconio, y cantidades sin especificar de cloruro de sodio, fosfato dibásico de sodio, ácido clorhídrico y/o hidróxido de sodio (para ajustar el pH) y agua purificada.
La publicación de solicitud de patente US nº 20030055102 de Alcon Inc. describe formulaciones tópicas de olopatadina que son efectivas para tratar y/o impedir trastornos alérgicos o inflamatorios del ojo o de la nariz. Se describen formulaciones de soluciones acuosas que comprenden aproximadamente 0,2-0,6% de olopatadina.
Las patentes US nº 4.871.865, 4.923.892, 5.116.863 y 5.641.805 y publicación de solicitud de patente US nº 20030055102.
Siguen siendo deseables procedimientos mejorados de administración de formulaciones tópicas de olopatadina que sean efectivas para tratar condiciones alérgicas o inflamatorias de la nariz.
Sumario de la invención
En consecuencia, la invención proporciona un pulverizador nasal según la reivindicación 1. Se proporcionan unas formas de realización ventajosas en las reivindicaciones subordinadas, un pulverizador de esta clase puede usarse en un procedimiento de administrar un spray nasal. Se proporciona un pulverizador con una formulación que comprende olopatadina. Se administra un spray de la formulación a la nariz de un sujeto. El spray tiene una característica de pulverización que comprende un patrón de pulverización con un eje más largo de 20-45 mm, un eje más corto de 14-20 mm y una elipticidad de 1-1,8, y/o una característica de pulverización que comprende una distribución de tamaños de gotitas con un D10 de 15-30 µm, un D50 de 30-60 µm, un D90 de 50-150 µm, un SPAN de no más de 3, y se proporciona también un % de volumen <10 µm de menos de un 4% de utilización de olopatadina, según se dispone en la reivindicación 10.
Breve descripción de los dibujos
Para una comprensión más completa de la presente invención y para otros objetivos y ventajas de la misma, se hace referencia a la siguiente descripción tomada en conjunción con los dibujos adjuntos, en los que:
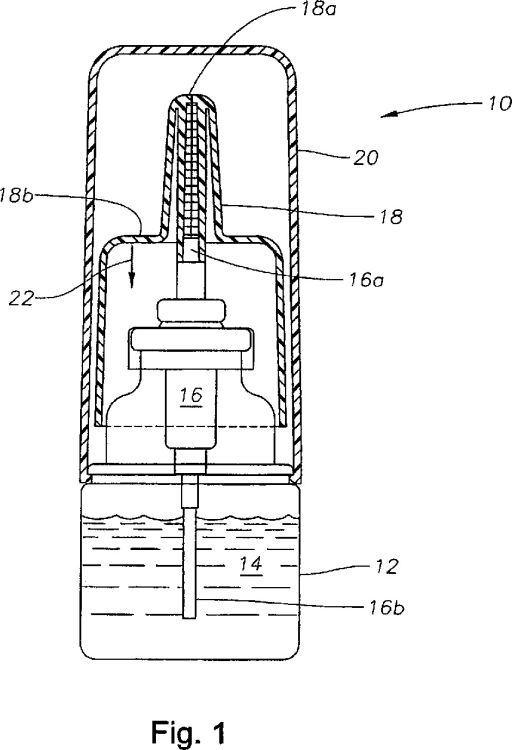
La figura 1 es una vista frontal en sección de un pulverizador nasal según una forma de realización preferida de la presente invención.
Descripción detallada de las formas de realización preferidas
Las formas de realización preferidas de la presente invención y sus ventajas se comprenden mejor haciendo referencia a la figura 1 de los dibujos, utilizándose números iguales para partes iguales y correspondientes de los diversos dibujos.
A menos que se indique lo contrario, todas las cantidades de los componentes se presentan sobre una base de % (w/v) y todas las referencias a olopatadina se hacen sobre la base de olopatadina libre.
La figura 1 muestra un pulverizador nasal 10 según una forma de realización preferida de la presente invención. El pulverizador nasal 10 incluye generalmente un frasco 12 que contiene una formulación 14, una bomba 16 acoplada de forma sellada con el frasco 12, un actuador 18 que recibe de forma amovible una parte superior 16a de la bomba 16 y una tapa 20 acoplada de forma retirable con el frasco 12 y destinada a cubrir el actuador 18. El frasco 12 y la tapa 20 están realizados preferentemente de polietileno de alta densidad. Una bomba preferida para la bomba 16 es la bomba Valois VP7/100S CS20. El actuador 18 está hecho preferentemente de polipropileno. La formulación 14 es preferentemente una formulación acuosa que es efectiva para tratar y/o impedir condiciones alérgicas o inflamatorias en la nariz y que contiene olopatadina. La formulación 14 contiene preferentemente 0,38-0,62% de olopatadina. La formulación 14 contiene muy preferentemente 0,6% de olopatadina. Después de retirar la tapa 20 e insertar la boquilla 18a del actuador 18 en su nariz, un usuario puede administrar un único spray de la formulación 14 del frasco 12 a través del tubo 16b de la bomba 16 y el actuador 18 moviendo la superficie 18b del actuador 18 en la dirección de la flecha 22. El pulverizador nasal 10 puede fabricarse utilizando técnicas convencionales.
Se ha descubierto que, para una formulación 14 que contiene 0,6% de olopatadina y una viscosidad de 1-2 cps (preferentemente 1,7 cps), una cierta característica de pulverización emitida desde la boquilla 18a da como resultado unas prestaciones clínicas inesperadamente beneficiosas. Más específicamente, se prefiere una característica de pulverización que tenga uno o más de los siguientes parámetros: un peso por disparo de 90-110 mg y, muy preferentemente, 100 mg; un patrón de pulverización con un eje más largo de 20-45 mm y, muy preferentemente, 23,5 mm; un patrón de pulverización con un eje más corto de 14-20 mm y, muy preferentemente, 17,5 mm; un patrón de pulverización con una elipticidad de 1-1,8, más preferentemente, 1-1,4 y, muy preferentemente, 1,24; y la siguiente distribución de tamaños de gotitas:
siendo D10 es la distribución de tamaños de gotitas del 10% de las gotitas, D50 es la distribución de tamaños de gotitas del 50% de las gotitas, D90 es la distribución...
Reivindicaciones:
1. Pulverizador nasal (10) que presenta un frasco (12) con una formulación (14) que comprende olopatadina, caracterizado porque el pulverizador está configurado para administrar un spray de dicha formulación con una característica de pulverización que comprende por lo menos uno de entre:
2. Pulverizador según la reivindicación 1, que presenta una característica de pulverización en la que dicho eje más largo es de 23,5 mm.
3. Pulverizador según la reivindicación 1, que presenta una característica de pulverización en la que dicho eje más corto es de 17,5 mm.
4. Pulverizador según la reivindicación 1, que presenta una característica de pulverización en la que dicha elipticidad es de 1-1,4.
5. Pulverizador según la reivindicación 1, en el que dicha formulación comprende entre 0,38 y 0,62% de olopatadina.
6. Pulverizador según la reivindicación 5, en el que dicha formulación comprende 0,6% de olopatadina.
7. Pulverizador según la reivindicación 1, en el que dicha característica de pulverización comprende además un peso por disparo de 90 a 110 mg.
8. Pulverizador según la reivindicación 1, que presenta una distribución de tamaños de gotitas en la que D10 es de 18-25 µm, D50 es de 39-53 µm, D90 es de 83-128 µm, SPAN es de 1,6-2,1 y % de volumen < 10 µm es de 0,8-2,4%.
9. Pulverizador según la reivindicación 1, que presenta una distribución de tamaños de gotitas en la que dicha distribución del tamaño de gotitas tiene un D10 de 18-25 µm, un D50 de 39-53 µm, un D90 de 83-128 µm, un SPAN de 1,6-2,1 y un % de volumen < 10 µm de 0,8-2,4%; dicha formulación comprende 0,6% de olopatadina; y dicha característica de pulverización comprende además un peso por disparo de 90 a 110 mg.
10. Utilización de olopatadina en la fabricación de un pulverizador nasal (10) para el tratamiento de condiciones alérgicas o inflamatorias de la nariz, que comprende acoplar un frasco (12) que contiene una formulación (14) de olopatadina a un pulverizador nasal (10) y caracterizado porque configura el pulverizador nasal para administrar un spray de dicha formulación con una característica de pulverización que comprende por lo menos uno de entre:
11. Utilización según la reivindicación 10, en la que la olopatadina se proporciona como una formulación que comprende entre 0,38 y 0,62% de olopatadina.
12. Utilización según la reivindicación 11, en la que dicha formulación comprende 0,6% de olopatadina.
Patentes similares o relacionadas:
Uso de inhibidores de la PDE4 para la profilaxis y/o la terapia de la dislipoproteinemia y trastornos relacionados, del 27 de Mayo de 2020, de Albert-Ludwigs-Universität Freiburg: Inhibidor específico de la fosfodiesterasa 4 (PDE 4) para uso en el tratamiento profiláctico o terapéutico de la dislipoproteinemia, en donde el inhibidor […]
Métodos y composiciones para trastornos relacionados con la proliferación celular, del 27 de Mayo de 2020, de Agios Pharmaceuticals, Inc: Un método in vitro para diagnosticar a un sujeto que tiene un trastorno relacionado con la proliferación celular o que se sospecha que tiene un trastorno relacionado con […]
Un canal catiónico no selectivo en células neurales y compuestos que bloquean el canal para su uso en el tratamiento de la inflamación del cerebro, del 6 de Mayo de 2020, de UNIVERSITY OF MARYLAND, BALTIMORE: Un antagonista de SUR1 que bloquea el canal de NCCa-ATP para su uso en (a) la prevención o el tratamiento de la inflamación de las células neurales […]
Inhibidores de ERK y sus usos, del 8 de Abril de 2020, de Celgene CAR LLC: Un compuesto de fórmula VIII: **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: el anillo A se selecciona de **(Ver fórmula)** […]
Procedimiento de uso de inmunoconjugados anti-CD79b, del 8 de Abril de 2020, de F. HOFFMANN-LA ROCHE AG: Un inmunoconjugado que comprende un anticuerpo anti-CD79b unido a un agente citotóxico para su uso en un procedimiento para tratar un trastorno proliferativo […]
IMIPRAMINA PARA USO COMO INHIBIDOR DE LA SOBREXPRESIÓN DE LA FASCINA 1, del 2 de Abril de 2020, de FUNDACION UNIVERSITARIA SAN ANTONIO: La presente invención se refiere a imipramina para su uso como inhibidor de la sobreexpresión de la fascina 1, preferiblemente dicha sobreexpresión de la fascina 1 está asociada […]
Mutación novedosa del receptor de andrógenos, del 25 de Marzo de 2020, de NOVARTIS AG: Una composicion terapeutica para su uso en el tratamiento de un paciente que padece cancer de prostata o de mama, asociado con una mutacion del receptor de […]
Composiciones y métodos para la distribución de moléculas en células vivas, del 25 de Marzo de 2020, de THE TEXAS A & M UNIVERSITY SYSTEM: Un compuesto que tiene la fórmula: **(Ver fórmula)** En donde X es un resto de unión, Y es un residuo de aminoácido acoplado de forma covalente […]