PREPARACIONES DE BACTERIAS GRAM POSITIVAS PARA EL TRATAMIENTO DE ENFERMEDADES QUE COMPRENDEN UNA MALA REGULACION INMUNE.
Uso de una composición que contiene bacterias Gram positivas o una fracción de las mismas,
en el que dichas bacterias consisten en células bacterianas Gram positivas muertas no desnaturalizadas y dicha fracción se selecciona del grupo consistente en: una fracción tratada con glicosidasa (fracción B), una fracción digerida con DNasa y/o RNasa (fracción C) y una fracción tratada con proteasa (fracción D) de dichas células bacterianas Gram positivas muertas no desnaturalizadas, para la preparación de un medicamento que es capaz de inducir una modulación de la respuesta inmune frente a un antígeno propio o un alérgeno, para la prevención y/o el tratamiento de una enfermedad seleccionada del grupo que consiste en cáncer, enfermedad autoinmune y alergia
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB02/05760.
Solicitante: INSTITUT PASTEUR
INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE.
Nacionalidad solicitante: Francia.
Dirección: 28, RUE DU DOCTEUR ROUX,75724 PARIS CEDEX 15.
Inventor/es: MARCHAL, GILLES, ROMAIN, FELIX, NAHORI,MARIE-ANNE, LAGRANDERIE,MICHELINE, VARGAFTIG,BERNARDO,BORIS, LEFORT,JEAN, HEKIMIAN,GEORGES, PELTRE,PHILIPPE.
Fecha de Publicación: .
Fecha Concesión Europea: 5 de Mayo de 2010.
Clasificación Internacional de Patentes:
- A61K35/74 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Bacterias (uso terapéutico de una proteína de la bacteria A61K 38/00).
Clasificación PCT:
- A61K35/74 A61K 35/00 […] › Bacterias (uso terapéutico de una proteína de la bacteria A61K 38/00).
- A61K39/04 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Mycobacterium, p. ej. Mycobacterium tuberculosis.
- A61P31/06 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › para la tuberculosis.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
Clasificación antigua:
- A61K35/74 A61K 35/00 […] › Bacterias (uso terapéutico de una proteína de la bacteria A61K 38/00).
- A61K39/04 A61K 39/00 […] › Mycobacterium, p. ej. Mycobacterium tuberculosis.
- A61P31/06 A61P 31/00 […] › para la tuberculosis.
- A61P35/00 A61P […] › Agentes antineoplásicos.
- A61P37/00 A61P […] › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
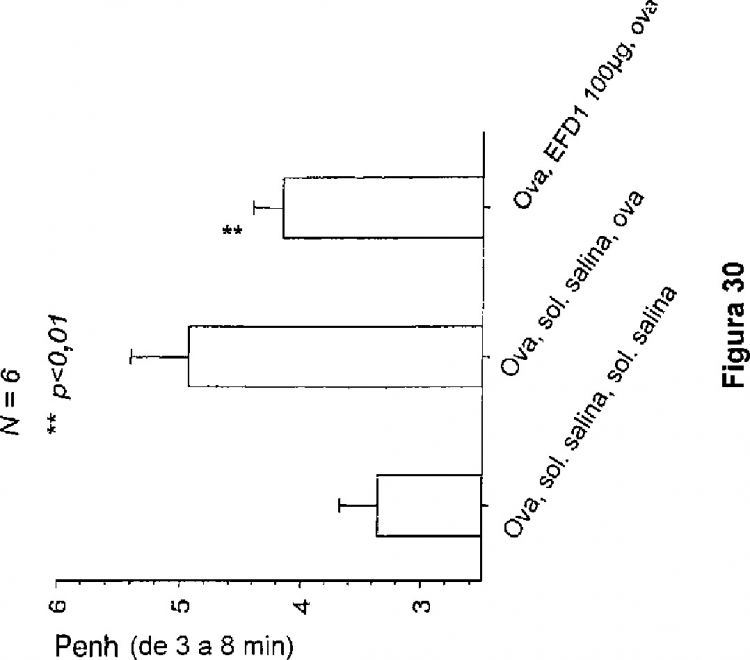
Fragmento de la descripción:
Preparaciones de bacterias Gram positivas para el tratamiento de enfermedades que comprenden una mala regulación inmune.
La presente invención se refiere a composiciones que comprenden componentes preparados a partir de bacterias Gram positivas tales como bacterias intracelulares facultativas Gram positivas, por ejemplo micobacterias, para el tratamiento de trastornos que comprenden una mala regulación inmune, en humanos y animales. La invención también se refiere a la preparación de dichos componentes y composiciones.
Las enfermedades que comprenden una mala regulación inmune, tales como desequilibrio de Th1-Th2, incluyen diferentes cánceres, enfermedades autoinmunes tales como esclerosis múltiple, artritis reumatoide, enfermedad de Crohn y diabetes mellitus, y trastornos alérgicos tales como asma, rinitis alérgica, conjuntivitis y dermatitis atópica.
Por ejemplo:
El asma alérgica es una enfermedad común, que implica una inflamación inducida por un alérgeno de las vías respiratorias; los leucocitos, eosinófilos y en ocasiones neutrófilos inflamatorios, se reclutan a las vías respiratorias como consecuencia de la presencia y activación de los linfocitos T que reaccionan con los alérgenos inhalados en el aparato respiratorio. Los linfocitos T CD4+ cumplen una función principal en la iniciación de la inflamación alérgica de las vías respiratorias mediante la producción de citoquinas de tipo Th2, que desencadenan el reclutamiento de eosinófilos a las vías respiratorias y posiblemente su activación posterior. Se ha propuesto que un desequilibrio entre los efectores Th2 y Th1 conduce a la patogenia del asma.
Por lo tanto, se ha propuesto estimular una respuesta inmune Th1 en los pulmones, por ejemplo, por nebulización de IFN-? o por administración de una vacuna micobacteriana; dicha estimulación parece inhibir el desarrollo de procesos alérgicos secundarios en ratones.
Más específicamente, el asma extrínseca o asma atópica (por ejemplo, ocupacional e inducido por drogas) se asocia con la potenciación de una respuesta inmune tipo Th2 con la producción de inmunoglobulina E (IgE) específica, ensayos en piel positivos a aeroalérgenos comunes y/o síntomas atópicos. La obstrucción de las vías respiratorias en el asma extrínseca implica una hiperrespuesta bronquial (HRB) no específica causada por inflamación de las vías respiratorias. Esta inflamación se media por compuestos químicos liberados por una diversidad de células inflamatorias, que incluye mastocitos, eosinófilos y linfocitos. Las acciones de estos mediadores dan como resultado una permeabilidad vascular, secreción de mucus y estrangulamiento del músculo liso bronquial. En el asma atópica, la respuesta inmune que produce inflamación de las vías respiratorias se ocasiona por la clase Th2 de las células T que secretan IL-4 e IL-5. Se ha descrito que el asma intrínseca o criptogénica se desarrolla después de infecciones del aparato respiratorio superior, pero puede surgir de novo en personas de mediana edad o mayores, en los cuales es más difícil de tratar que el asma extrínseca.
Por lo tanto los trastornos alérgicos se median por linfocitos T que secretan citoquinas de T colaboradores 2 (Th2), IL-4, IL-5 e IL-13, dando como resultado altos niveles de IgE en suero y reclutamiento de eosinófilos. Sin embargo, las células Th1 también pueden participar en estas patologías; por ejemplo, las células Th1 se han identificado en lesiones crónicas de la piel atópicas. Un desequilibrio tal de Th1-Th2 también se ha encontrado en otros trastornos tales como algunos cánceres, especialmente cáncer de vejiga o en enfermedades autoinmunes.
Los estudios epidemiológicos, por ejemplo, los realizados por Shirakawa y col. (Science, 1997, 275, 3), demostraron una relación inversa entre la respuesta de tuberculina y los trastornos atópicos. Dichos resultados indican que la inmunización previa contra ciertas bacterias Gram positiva, tales como las bacterias intracelulares facultativas Gram positivas, por ejemplo micobacterias tales como M. tuberculosis, M. bovis o BCG, puede proteger frente a enfermedades atópicas.
Una de las estrategias de tratamiento es la regulación negativa del componente Th2 mediante la inducción de una respuesta de T colaborador 1 (Th1) frente al alérgeno o antígeno relevante, porque se cree que las citoquinas de Th1 y Th2 son mutuamente antagonistas.
Los resultados experimentales de diferentes grupos han mostrado que la inmunización de ratones adultos con bacterias intracelulares incluyendo micobacterias y listeria, de las que se sabe que inducen una respuesta inmune Th1 fuerte, puede compensar la respuesta Th2 inducida por alérgeno o antígeno; en la alergia, por ejemplo, puede reducir la eosinofilia y la HRB asociada.
Es la razón por la que ciertas micobacterias se han propuesto para el tratamiento de trastornos alérgicos y más específicamente del asma.
A este respecto, se han ensayado diferentes tipos de composiciones que incluyen micobacterias:
- Se ha considerado que las vacunas de BCG vivas tienen un efecto potencial en el asma experimental o equivalente, especialmente cuando se proporcionan por vía intranasal (KJ. Erb y col., J. Exp. Med, 1998, 187, 561-569; MA. Nahori y col., Vaccine, 2001, 19, 1484-1495). Sin embargo, a pesar de su utilidad para prevenir la tuberculosis (JB Milstein y col., WHO Bull. OMS, 1990, 68, 93-108), las vacunas de BCG vivas muestran diversos inconvenientes; primero, no pueden darse a sujetos con insuficiencia inmune debido a su virulencia residual; segundo, hay una reacción local a la vacunación intradérmica de BCG que es proporcional a la masa total bacteriana y puede llevar a ulceración local, o en el caso de inyección subcutánea accidental, a reacciones más severas (absceso). Por lo tanto, dicha vacuna, especialmente si se proporciona por la vía intranasal o en aerosol, no se adaptaría a la administración repetida durante un período significativo para la inmunoterapia de trastornos alérgicos del aparato respiratorio, u otros trastornos que implican un desequilibrio Th1-Th2. La administración intranasal o por aerosol puede conducir a efectos adversos inadmisibles de la vacuna de BCG vivas en los pulmones;
El documento GB1027979 describe un proceso para obtener cultivos de Micobacteria liofilizados viables para su uso como una vacuna contra la tuberculosis.
El documento GB764718 describe la liofilización de materiales biológicos sensibles, tales como BCG de Micobacteria, en presencia de dextrano para aumentar el grado de supervivencia.
- Preparaciones muertas por calor de micobacterias
Las preparaciones muertas por calor de BCG o de Mycobacterium tuberculosis no tienen propiedades sistemáticas protectoras cuando se emplean en vacunas (R. Janssen y col., Immunol., 2001, 102, 4, 441-449; MA Skinner y col., Immunol., 2001, 102, 2, 225-233; GA Rook y col., Novartis Found Symposium, 1998, 217, 73-87 y 87-98). Además, dichas preparaciones inducen una hipersensibilidad de tipo retardado a los derivados de proteína purificada de BCG (PPD) que interfiere con el diagnóstico de la tuberculosis. Sin embargo, debe observarse que algunos autores han considerado que la preinmunización en el período neonato con M. bovis muerta por calor sola o además de M. vaccae puede potencialmente ser útil en la regulación negativa de una respuesta IgE (F. Tukenmez y col., Pediatr. Allergy Immunol., 1999, 10, 2, 107-111; Tukenmez F. y col., J. Asthma, 2000, 37, 4, 329-334; Nahori y col., citado anteriormente);
Las preparaciones muertas por calor de Mycobacterium vaccae, (CC Wang y col., Immunol. 1998, 93, 3, 307-313; documento WO 00/74715) tienen aplicación clínica en la inmunoterapia de alergia. Algunos resultados demuestran la potencia de las micobacterias muertas por calor como adyuvantes de Th1 y muestran una aplicación potencial de micobacterias recombinantes en modulación inmune específica de antígeno (R. Janssen y col., Immunol., 2001, 102, 4, 441-449; MA Skinner y col. Immunol., 2001, 102, 2, 225-233; CC Wang y col., Immunol. 1998, 93, 3, 307-313; documento WO 00/74715). Incluso aunque dichas preparaciones están activas en inmunoterapia, presentan varios inconvenientes, compartidos con las preparaciones muertas por calor de BCG o de Mycobacterium tuberculosis, que también impiden su uso en inmunoterapia.
De hecho, todas las preparaciones muertas por calor de micobacterias:
- Inducen la producción de TNF-a por macrófagos alveolares, que se comporta...
Reivindicaciones:
1. Uso de una composición que contiene bacterias Gram positivas o una fracción de las mismas, en el que dichas bacterias consisten en células bacterianas Gram positivas muertas no desnaturalizadas y dicha fracción se selecciona del grupo consistente en: una fracción tratada con glicosidasa (fracción B), una fracción digerida con DNasa y/o RNasa (fracción C) y una fracción tratada con proteasa (fracción D) de dichas células bacterianas Gram positivas muertas no desnaturalizadas, para la preparación de un medicamento que es capaz de inducir una modulación de la respuesta inmune frente a un antígeno propio o un alérgeno, para la prevención y/o el tratamiento de una enfermedad seleccionada del grupo que consiste en cáncer, enfermedad autoinmune y alergia.
2. El uso de una composición o una fracción de la misma, de acuerdo con la reivindicación 1, para la prevención y/o el tratamiento de una enfermedad autoinmune que se selecciona del grupo que consiste en esclerosis múltiple, artritis reumatoide, enfermedad de Crohn y diabetes mellitus.
3. El uso de una composición o una fracción de la misma, de acuerdo con la reivindicación 1 para la prevención y/o el tratamiento de una alergia que se selecciona del grupo que consiste en asma, rinitis alérgica, conjuntivitis y dermatitis atópica.
4. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 3, en el que dicha composición contiene bacterias intracelulares facultativas Gram positivas muertas seleccionadas del grupo que consiste en Listeria sp., Corynobacterium sp., y Actinomycetes que comprenden Mycobacteria sp., Nocardia sp. y Rhodococcus sp.
5. El uso de acuerdo con la reivindicación 4, en el que dicha micobacteria es Mycobacteria bovis.
6. El uso de acuerdo con la reivindicación 5, en el que dicha Mycobacteria bovis es Mycobacteria bovis BCG.
7. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en el que dicha composición contiene bacterias Gram positivas muertas por liofilización prolongada obtenibles mediante un proceso de liofilización prolongada.
8. El uso de acuerdo con la reivindicación 7, en el que dicha composición contiene micobacterias muertas por liofilización prolongada.
9. El uso de acuerdo con las reivindicaciones 7 u 8, en el que dicha composición contiene menos de 1,5% de agua residual.
10. El uso de acuerdo con las reivindicaciones 7 u 8, en el que dicha composición contiene menos de 1% de agua residual.
11. El uso de acuerdo con las reivindicaciones 7 u 8, en el que dicha composición contiene menos del 0,5% de agua residual.
12. El uso de acuerdo con una cualquiera de las reivindicaciones 7 a 11, en el que dicha composición se prepara mediante un proceso de liofilización prolongada, que comprende al menos los pasos de:
- recolectar un cultivo de células bacterianas Gram positivas vivas,
- congelar las células bacterianas en agua o en una solución acuosa de una sal,
- matar las células bacterianas congeladas mediante su secado en un liofilizador, durante un tiempo suficiente para retirar al menos el 98,5% del agua, y
- recoger las células bacterianas muertas por liofilización prolongada.
13. El uso de acuerdo con la reivindicación 12, en el que la muerte de las bacterias congeladas se realiza en una presión de cámara de secado de 0,02 milibares a 0,2 milibares.
14. El uso de acuerdo con la reivindicación 12 o reivindicación 13, en el que dicho proceso de liofilización prolongada comprende un paso adicional de lavado de las células bacterianas recolectadas en agua o en una solución acuosa o de una sal, antes de la congelación de dichas células bacterianas.
15. El uso de acuerdo con una cualquiera de las reivindicaciones 12 a 14, en el que la congelación y/o el lavado de las células bacterianas se realiza en una solución acuosa de borato.
16. El uso de acuerdo con una cualquiera de las reivindicaciones 1 a 15, en el que:
- dicha fracción tratada con glicosidasa es obtenible por digestión con lisozima,
- dicha fracción tratada con DNasa y/o RNasa es obtenible por digestión con DNasa I y/o RNasa A, y
- dicha fracción tratada con proteasa es obtenible por digestión con subtilisina.
17. El uso de una composición o una fracción de la misma de acuerdo con una cualquiera de las reivindicaciones 1 a 16, para la preparación de un medicamento que se pretende que sea administrado por la vía oral, sublingual, intranasal o parenteral.
18. El uso de acuerdo con la reivindicación 17, en el que dicha vía parenteral es la vía subcutánea.
19. El uso de una composición o una fracción de la misma, de acuerdo con una cualquiera de las reivindicaciones 3 a 18, para la preparación de un medicamento para el tratamiento del asma, que va a administrarse por vía oral, parenteral, sublingual o intranasal, en un intervalo de dosis que es equivalente en ratones a desde 1 µg hasta 10.000 µg, a intervalos de dos meses, empezando desde al menos dos semanas antes del periodo usual de exposición al alérgeno.
20. El uso de una composición o una fracción de la misma, de acuerdo con una cualquiera de las reivindicaciones 3 a 18, para la preparación de un medicamento para la prevención del asma en un bebé humano, que va a administrarse por vía oral, parenteral, sublingual o intranasal, en un intervalo de dosis que es equivalente en ratones a desde 1 µg hasta 10.000 µg.
21. Una composición que contiene bacterias Gram positivas muertas por liofilización prolongada, que es obtenible por el proceso de liofilización prolongada como se ha definido en una cualquiera de las reivindicaciones 12 a 15.
22. La composición de la reivindicación 21, que contiene micobacterias muertas por liofilización prolongada, como se ha definido en una cualquiera de las reivindicaciones 4 a 7.
23. Una fracción de células bacterianas Gram positivas muertas, como se ha definido en la reivindicación 16.
24. La composición de acuerdo con la reivindicación 21 ó 22 o la fracción de acuerdo con la reivindicación 23 como un medicamento.
25. Una composición farmacéutica que comprende las bacterias Gram positivas muertas por liofilización prolongada como se ha definido en la reivindicación 21 ó 22 y/o al menos una fracción de las mismas como se ha definido en la reivindicación 23, un transportador farmacéuticamente aceptable y/o un aditivo y/o un inmunoestimulante, y/o adyuvante y/o un inmunomodulador distinto de la composición como se ha definido en la reivindicación 1.
26. Productos que contienen una composición como se ha definido en una cualquiera de las reivindicaciones 1 a 15 o una fracción de acuerdo con la reivindicación 23 y un producto seleccionado del grupo que consiste en fármacos antineoplásicos, anti-diabetes e inmunomoduladores como una preparación combinada para uso simultáneo, separado o secuencial en la prevención y/o el tratamiento de una enfermedad seleccionada del grupo que consiste en cáncer, enfermedad autoinmune y alergia.
27. Productos de acuerdo con la reivindicación 26, en los que dicho fármaco es un fármaco anti-histamínico o un fármaco anti-inflamatorio.
Patentes similares o relacionadas:
Cepa de Faecaslibacterium Prausnitzii CNCM I-4573 para el tratamiento y la prevención de una inflamación gastrointestinal, del 15 de Julio de 2020, de Institut national de recherche pour l'agriculture, l'alimentation et l'environnement: Cepa bacteriana de la especie Faecalibacterium prausnitzii depositada en la CNCM bajo el número de acceso CNCM I-4573, para su utilización en el tratamiento y/o la prevención […]
Composiciones que comprenden cepas bacterianas, del 15 de Julio de 2020, de 4D Pharma Research Limited: Una composición que comprende una cepa bacteriana de la especie Eubacterium contortum, en donde la composición no contiene ninguna otra cepa o especie […]
BACTERIA DE HOLDEMANELLA SP. Y USO DE LA MISMA, del 2 de Julio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a la cepa de Holdemanella biformis la cepa H. biformis CECT 9752 a sus componentes celulares, metabolitos, […]
Bacteria de Holdemanella sp. y uso de la misma, del 26 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): Bacteria de Holdemanella sp. y uso de la misma. La presente invención se refiere a la cepa de Holdemanella biformis la cepa H. biformis CECT 9752 a […]
COMPOSICIONES HOMEOPÁTICAS A BASE DE VIBRIO PARAHAEMOLYTICUS Y VIBRIO ALGINOLYTICUS Y SU USO COMO INMUNOESTIMULANTES EN EL CULTIVO DE ESPECIES ACUÁTICAS, del 25 de Junio de 2020, de CENTRO DE INVESTIGACIONES BIOLOGICAS DEL NOROESTE, S.C: La presente invención se refiere a composiciones homeopáticas a base de Vibrio parahaemolyticus y Vibrio Alginolyticus para uso inmunoestimulante en acuicultura, […]
Preparación de aceite microbiano que contiene ácidos grasos poliinsaturados, del 10 de Junio de 2020, de DSM IP ASSETS B.V.: Un aceite microbiano que comprende al menos el 50% de ácido araquidónico (ARA) basado en el aceite y que tiene un contenido en triglicéridos de al menos el 90%.
Procedimientos para el tratamiento dietético del síndrome del intestino irritable y la malabsorción de carbohidratos, del 3 de Junio de 2020, de GANEDEN BIOTECH, INC.: Uso de esporas de Bacillus coagulans Hammer en la fabricación de un medicamento para reducir los síntomas del síndrome del intestino irritable (SII) […]
Composiciones farmacéuticas y alimenticias basadas en Hafnia alvei para inducir saciedad y prolongar la saciedad, del 27 de Mayo de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método cosmético no terapéutico para inducir saciedad en un sujeto que lo necesita que comprende administrar oralmente al sujeto una cantidad […]