PREPARACION DE LEVOFLOXACINO HEMIHIDRATADO.
Procedimiento para la preparación de levofloxacino hemihidratado que comprende las etapas siguientes:
mantener el levofloxacino a una temperatura de 70ºC a 120ºC en un primer disolvente que es un disolvente polar capaz de disolver el levofloxacino; añadir un segundo disolvente polar que comprende agua para precipitar el levofloxacino hemihidratado; y recuperar el levofloxacino hemihidratado
Tipo: Resumen de patente/invención. Número de Solicitud: W0231850US.
Solicitante: TEVA PHARMACEUTICAL INDUSTRIES LTD..
Nacionalidad solicitante: Israel.
Dirección: 5 BASEL STREET, P.O. BOX 3190,49131 PETAH TIQVA.
Inventor/es: NIDDAM-HILDESHEIM, VALERIE, GERSHON, NEOMI, AMIR, EHUD, WIZEL, SHLOMIT.
Fecha de Publicación: .
Fecha Concesión Europea: 4 de Octubre de 2006.
Clasificación Internacional de Patentes:
- C07D498/06 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 498/00 Compuestos heterocíclicos que contienen en el sistema condensado al menos un heterociclo que tienen átomos de nitrógeno y oxígeno como únicos heteroátomos del ciclo (4-oxa-1-azabiciclo [3.2.0] heptanos, p. ej. oxapenicilinas C07D 503/00; 5-oxa-1-azabiciclo [4.2.0] octanos, p. ej. oxacefalosporinas C07D 505/00; aquéllos de sus análogos que tienen el átomo de oxígeno del ciclo en otra posición C07D 507/00). › Sistemas peri-condensados.
Clasificación PCT:
- A61K31/5383 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › condensadas en orto o en peri con sistemas heterocíclicos.
- C07D221/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de seis miembros, teniendo un átomo de nitrógeno como único heteroátomo del ciclo, no previstos por los grupos C07D 211/00 - C07D 219/00.
- C07D265/00 C07D […] › Compuestos heterocíclicos que contienen ciclos de seis miembros que tienen un átomo de nitrógeno y un átomo de oxígeno como únicos heteroátomos del ciclo.
- C07D498/06 C07D 498/00 […] › Sistemas peri-condensados.
Clasificación antigua:
- A61K3/06
Fragmento de la descripción:
Preparación de levofloxacino hemihidratado.
Campo de la invención
La presente invención se refiere a un procedimiento para la preparación de levofloxacino hemihidratado.
Antecedentes de la invención
El levofloxacino es un antibiótico sintético de amplio espectro. El levofloxacino es el enantiómero S del racemato, ofloxacino, un agente antimicrobiano de fluoroquinolona. La actividad antibacteriana del ofloxacino radica principalmente en el enantiómero S. El mecanismo de actuación del levofloxacino y de otro antimicrobiano de fluoroquinolona implica la inhibición de la ADN girasa (topoisomerasa II bacteriana), una enzima necesaria para la replicación, transcripción, reparación y recombinación del ADN. El levofloxacino está disponible como LEVAQUIN® que puede administrarse por vía oral o por vía intravenosa.
El levofloxacino es una carboxiquinolona fluorada. Su denominación química es ácido (S)-9-fluoro-2,3-dihidro-3-metil-10-(4-metil-1-piperazinil)-7-oxo-7H-pirido[1,2,3-de]1,4-benzoxazina-6-carboxílico (nº de registro CAS 100986-85-4). La estructura química del levofloxacino se muestra como Fórmula I.
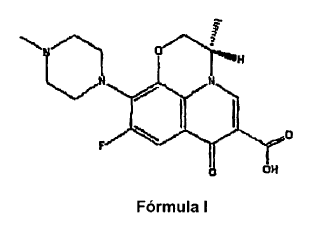
La patente US nº 4.382.892 se refiere a derivados de pirido[1,2,3-de][1,4]benzoxazina y a los procedimientos de su preparación.
La patente US nº 5.053.407 se refiere a los derivados de piridobenzoxazina ópticamente activos, a los procedimientos para preparar los mismos y a los productos intermedios útiles para preparar dichos derivados.
La patente US nº 5.051.505 se refiere a los procedimientos para preparar derivados de piperazinil quinolona. El procedimiento comprende hacer reaccionar las dialoquinolonas con derivados de piperazina y haluros de tetraalquilamonio en presencia de un disolvente polar tal como acetonitrilo, dimetilformamida, piridina, sulfolano y sulfóxido de dimetilo.
La patente US nº 5.155.223 se refiere a la preparación de ácidos quinolincarboxílicos.
La patente US nº 5.545.737 da a conocer selectivamente la producción de un levofloxacino hemihidratado o monohidratado controlando el contenido en agua de un disolvente acuoso en el que se disuelve levofloxacino durante una cristalización.
Formas de levofloxacino
En la bibliografía se mencionan tres formas polimórficas (a, ß y ? anhidras) y dos formas pseudopolimórficas (hemihidrato y monohidrato) de levofloxacino. Las formas de hemihidrato y monohidrato se mencionan en la patente EP 0444 678 B1 y en la patente US nº 5.545.737. Estas dos patentes se refieren a procedimientos para la preparación de la forma hemihidrato exenta de monohidrato y para la preparación de monohidrato exento de hemihidrato.
El artículo titulado Effect of dehydration on the formation of Levofloxacine Pseudopolymorphs
, Chem. Pharm. Bull. 43(4) 649-653 (1995), examina las propiedades físicas de las formas de hidratos de levofloxacino. Según el artículo, el calentamiento de la forma del hemihidrato produjo una eliminación del agua hidratada para dar la forma ? anhidra. Además el calentamiento produjo la formación de la forma ß anhidra y a continuación la formación de la forma a anhidra. El calentamiento de la forma de monohidrato produjo una eliminación del agua hidratada para dar la forma a anhidra. La forma ? y la forma a adsorbieron vapor de agua rápidamente en las condiciones de humedad relativa ordinarias y se transformaron en el hemihidrato y monohidrato, respectivamente.
La presente invención se refiere a las propiedades físicas en estado sólido de levofloxacino. Las propiedades físicas en estado sólido incluyen, por ejemplo, la fluidez del sólido molido. La fluidez afecta a la facilidad con la que el material se manipula durante el tratamiento en un producto farmacéutico. Cuando las partículas del compuesto en polvo no fluyen una tras otra fácilmente, un especialista en formulación debe tener este hecho en cuenta al desarrollar una formulación de comprimidos o cápsulas, que puede necesitar la utilización de fluidificantes tales como dióxido de sílice coloidal, talco, almidón o fosfato de calcio tribásico.
Otra propiedad importante del estado sólido de una composición farmacéutica es su velocidad de disolución en el fluido acuoso. La velocidad de disolución de un ingrediente activo en un fluido del estómago el paciente puede tener consecuencias terapéuticas ya que impone un límite superior en la velocidad a la que un ingrediente activo administrado por vía oral puede alcanzar el torrente circulatorio del paciente. La velocidad de disolución es asimismo una consideración al formular jarabes, elixires y otros medicamentos líquidos. La formulación en estado sólido de un compuesto puede afectar asimismo su comportamiento en la compactación y en su estabilidad al almacenamiento.
Estas características físicas prácticas están influenciadas por la configuración y orientación de las moléculas en la celda unitaria, lo que define una forma polimórfica determinada de una sustancia. La forma polimórfica puede dar lugar a un comportamiento térmico diferente al del material amorfo u otra forma polimórfica. El comportamiento térmico se mide en el laboratorio mediante técnicas tales como el punto de fusión capilar, análisis termogravimétrico (TGA) y calorimetría de exploración diferencial (DSC) y puede utilizarse para distinguir algunas formas polimórficas de otras. Una forma polimórfica determinada puede asimismo dar lugar a distintas propiedades espectroscópicas que pueden ser detectables por cristalografía de rayos X en polvo, espectrometría C-RMN en estado sólido y espectrometría infrarroja.
Sumario de la invención
La presente invención proporciona un procedimiento para preparar levofloxacino hemihidratado que comprende: mantener el levofloxacino a una temperatura entre 70ºC y 120ºC en un primer disolvente seleccionado de entre el grupo constituido por éter monometílico de propilenglicol, dimetil acetamida y sulfóxido de dimetilo; añadir un segundo disolvente polar que comprende agua para precipitar el levofloxacino hemihidratado; y recuperar el levofloxacino hemihidratado.
El levofloxacino puede prepararse por un procedimiento que comprende hacer reaccionar el ácido (S)-(-)-9,10-difluoro-3-metil-7-oxo-2,3-dihidro-7H-pirido[1,2,3-de][1,4]benzoxazina-6-carboxílico (Compuesto I
) con N-metil piperazina para formar el levofloxacino, y recuperar el levofloxacino. El Compuesto I puede reaccionar con N-metil piperazina bien en un disolvente polar o como mezcla pura.
Descripción detallada de la invención
Tal como se utiliza en la presente memoria, en bruto
y purificado
son términos afines que significan menos puro o más puro, respectivamente.
A menos que se indique de otra manera, las expresiones levofloxacino
y forma de levofloxacino
incluyen las sales, hidratos, solvatos y los derivados fisiológicamente funcionales de levofloxacino. El término incluye asimismo todas las formas polimorfas de levofloxacino en la medida que no se consideren que son sales, hidratos, solvatos o derivados fisiológicamente funcionales de levofloxacino.
El levofloxacino utilizado en la presente invención puede prepararse por un procedimiento que comprende hacer reaccionar el ácido (S)-(-)-9,10-difluoro-3-metil-7-oxo-2,3-dihidro-7H-pirido[1,2,3-de][1,4]benzoxazina-6-carboxílico (Compuesto I
) con N-metil piperazina en un disolvente polar, preferentemente a temperatura elevada, para formar levofloxacino. La temperatura elevada está comprendida preferentemente entre 70 y 120ºC. El levofloxacino puede precipitarse a continuación y recuperarse utilizando técnicas bien conocidas en la materia. Tal como se utiliza en la presente memoria, el término precipitado
incluye la formación de un sólido en una solución o un aumento en la cantidad de sólido en una suspensión. La preparación del Compuesto I se describe, por ejemplo, en la patente US nº 4.382.892.
Un disolvente polar adecuado es cualquiera que sea capaz de disolver el levofloxacino. Preferentemente, el disolvente polar es el sulfóxido de dimetilo (DMSO), un alcohol (preferentemente isobutanol), una cetona, el éter monometílico de propilenglicol (PGME) o la dimetil acetamida (DMA). Tal como se utiliza en la presente memoria, la expresión disolvente polar
se propone como término afín que significa relativamente más polar que otro disolvente.
El volumen de disolvente está...
Reivindicaciones:
1. Procedimiento para la preparación de levofloxacino hemihidratado que comprende:
2. Procedimiento según la reivindicación 1, en el que el levofloxacino se mantiene a una temperatura de 80ºC a 85ºC en el primer disolvente.
3. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el segundo disolvente polar se añade a una temperatura de 60ºC a 80ºC.
4. Procedimiento según la reivindicación 3, en el que el segundo disolvente polar se añade a una temperatura de 75ºC a 79ºC.
5. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el segundo disolvente polar se añade durante aproximadamente 2 horas.
6. Procedimiento según la reivindicación 1, en el que el segundo disolvente polar comprende una mezcla de isopropanol y agua.
7. Procedimiento según la reivindicación 6, en el que la mezcla de isopropanol y agua contiene 3% a 4% (v/v) de agua.
8. Procedimiento según la reivindicación 6 ó 7, en el que el levofloxacino se mantiene a una temperatura de aproximadamente 80ºC en el primer disolvente y el segundo disolvente polar se añade a una temperatura de aproximadamente 75ºC.
9. Procedimiento según cualquiera de las reivindicaciones anteriores, en el que el levofloxacino se prepara mediante un procedimiento que comprende:
Patentes similares o relacionadas:
Heterciclos tricíclicos como inhibidores de proteína BET, del 21 de Agosto de 2019, de Incyte Holdings Corporation: Un compuesto de Fórmula (I):**Fórmula** o una de sus sales farmacéuticamente aceptables, en donde: --- representa un enlace sencillo o un doble […]
Tetrazolonas como bioisósteros de ácido carboxílico, del 3 de Julio de 2019, de RIGEL PHARMACEUTICALS, INC.: Un compuesto seleccionado de:**Fórmula**
Intermediarios para la síntesis de ligadores P1 cíclicos como inhibidores del factor XIA, del 10 de Abril de 2019, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la Fórmula 14i:**Fórmula** en el que: el anillo A se selecciona del grupo que consiste en un arilo de 6 miembros y […]
Derivado de N-acilo O-aminofenol CBI cíclico, del 27 de Febrero de 2019, de THE SCRIPPS RESEARCH INSTITUTE: Un derivado cíclico de N-acilo O-aminofenol CBI representado por la Fórmula I:**Fórmula** en donde: 20 R es hidrido o un hidrocarbilo C1-C6; y R3 se selecciona […]
Macrociclos como inhibidores del factor XIa, del 2 de Mayo de 2018, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Formula (I):**Fórmula** o un estereoisomero, un tautomero, una sal farmaceuticamente aceptable, un solvato del mismo, en donde: […]
Macrociclos novedosos como inhibidores del factor XIa, del 7 de Junio de 2017, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de Fórmula (I): **(Ver fórmula)** o un estereoisómero, un tautómero, una sal farmacéuticamente aceptable, un solvato del mismo, […]
Heterociclos tricíclicos como inhibidores de la proteína NET, del 18 de Mayo de 2016, de Incyte Holdings Corporation: Un compuesto de fórmula (I):**Fórmula** o una sal farmacéuticamente aceptable del mismo; en la que: ----___ representa un enlace sencillo o un doble enlace; L […]
Naftiridonas y quinolonas 7-amino alquilidenil-heterocíclicas, del 1 de Marzo de 2016, de JANSSEN PHARMACEUTICA NV: Un compuesto seleccionado de**Tablas** o un isómero óptico, diastereómero, o enantiómero del mismo; una sal farmacéuticamente aceptable o hidrato del mismo.