PREPARACIÓN DE CÉLULAS T GAMMA DELTA HUMANAS PRESENTADORAS DE ANTÍGENO Y SU USO EN INMUNOTERAPIA.
Método para la preparación de células T γδ humanas presentadoras de antígeno eficaces que comprende seleccionar las células T γ
δ de células mononucleares de sangre periférica humana, tratar las células seleccionadas con un estímulo para la inducción de las funciones presentadoras de antígeno y aplicar el antígeno para su captación y presentación por estas células
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/CH2005/000469.
Solicitante: UNIVERSITY COLLEGE CARDIFF CONSULTANTS LIMITED.
Nacionalidad solicitante: Reino Unido.
Dirección: 30-36 NEWPORT ROAD CARDIFF CF24 0DE REINO UNIDO.
Inventor/es: MOSER,BERNHARD, BRANDES,MARLENE LYMPHOCYTE BIOLOGY SECTION,LAB.OF IMMUNOLOGY,NAT.INST.OF ALLERGY AND INFECTIOUS DI.
Fecha de Publicación: .
Fecha Solicitud PCT: 11 de Agosto de 2005.
Fecha Concesión Europea: 4 de Agosto de 2010.
Clasificación PCT:
- C12N5/0783 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células T; Células NK; Progenitores de células T o NK.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
Fragmento de la descripción:
Preparación de células T γδ humanas presentadoras de antígeno y su uso en inmunoterapia.
Campo de la invención
La invención se refiere a un método para la preparación de células T γδ humanas presentadoras de antígeno eficaces, a las células T γδ preparadas mediante un método de este tipo, y a su uso en inmunoterapia, la identificación de antígenos y el diagnóstico de la competencia inmunitaria.
Antecedentes de la invención
Los componentes celulares del sistema inmunitario adaptativo
Los componentes celulares del sistema inmunitario se dividen en las células del sistema inmunitario innato y las células del sistema inmunitario adaptativo (adquirido o específico). Las células del sistema inmunitario innato incluyen (entre otros) monocitos, granulocitos, células citolíticas naturales en sangre periférica, y mastocitos, macrófagos y células dendríticas (DC) en compartimentos extravasculares que incluyen tejidos periféricos, tales como la piel, las vías respiratorias, los tractos gastrointestinal y urogenital, los órganos internos así como los tejidos linfáticos secundarios, tales como el bazo, los ganglios linfáticos (LN) y las placas de Peyer (PP). Las principales funciones de las células innatas son a) provisión de protección inmediata neutralizando y limitando la diseminación de partículas infeccionas, y eliminando las células tumorales, b) inmunovigilancia de los tejidos sanos, y c) iniciación de las respuestas inmunitarias adaptativas. Las células del sistema inmunitario adaptativo incluyen linfocitos, tales como células T y B. Éstas se distinguen de las células innatas por la presencia de receptores de antígenos de superficie celular clonotípicos, denominados receptor de antígeno de células T (TCR) y receptor de antígeno de células B (BCR). Cada linfocito individual lleva un TCR o BCR distinto que reconoce un antígeno particular. La especificidad del reconocimiento de antígenos se determina mediante el reordenamiento de múltiples segmentos génicos de TCR o BCR variables durante el desarrollo de las células T y B y durante la maduración de la afinidad del antígeno en el momento de la generación de células T y B efectoras. Las células T no expuestas a antígenos, vírgenes, en sangre periférica difieren entre sí en la selectividad al antígeno de sus TCR, y las células T vírgenes individuales se expanden en respuesta a la activación inmunitaria mediante agentes que contienen el antígeno para el que son específicas. Por consiguiente, durante las respuestas inmunitarias adaptativas un grupo de células T vírgenes con TCR específicos para el agente potencialmente infeccioso se expande mediante proliferación celular, y se desarrolla en a) células T efectoras para la participación inmediata en la defensa frente al agente potencialmente infeccioso, y en b) células T de memoria para la protección a largo plazo frente a este agente potencialmente infeccioso particular. Las células T efectoras tienen vida corta, es decir desaparecen durante la fase de resolución de la respuesta inmunitaria, mientras que las células T de memoria tienen vida larga y se dividen en subgrupos de células T de memoria según su residencia tisular primaria o las rutas de recirculación preferenciales (Moser et al., 2004). Las células T se dividen además en células T αβ y células T γδ (véase a continuación) según la composición de los TCR heterodiméricos; los αβ-TCR se componen de cadenas de α y β-proteína, y los γδ-TCR se componen de cadenas de γ y δ-proteína. La mayoría (>80%) de todas las células T CD3+ en una persona sana, normal son células T αβ. Los TCR se asocian con la molécula CD3 invariable que distingue las células T de las células B y todos los demás tipos de inmunocitos. La mayoría de las células T αβ reconocen el antígeno de una manera denominada restringida a las moléculas del complejo principal de histocompatibilidad (MHC). Esto contrasta los BCR en las células B que se unen directamente al antígeno nominal de una manera no restringida al MHC. La expresión restricción por MHC se refiere al modo mediante el cual los TCR reconocen sus antígenos e implica la presentación de los péptidos antigénicos junto con las moléculas del MHC, como los denominados complejos MHC-péptido, en células presentadoras de antígeno (APC), que incluyen las DC (véase a continuación). Existen dos clases principales de moléculas de MHC, MHC clase I (MHC-I) y MHC clase II (MHC-II), que activan los TCR de los dos subgrupos principales de células T αβ, las células T αβ CD8+ y las células T αβ CD4+. Los TCR en las células T αβ CD4+ reconocen complejos MHC-II-péptido mientras que los TCR en las células T αβ CD8+ reconocen complejos MHC-I-péptido. En notable contraste, el subgrupo principal de células T γδ en sangre periférica humana no expresa CD4 ni CD8
Células T γδ
Las células T γδ son un subgrupo diferenciado de células T CD3+ que presentan TCR que se codifican en los segmentos génicos Vγ y Vδ (Morita et al., 2000; Carding y Egan, 2002). Se dividen además según su residencia primaria en sangre o tejidos, la composición de la cadena proteica de sus VγVδ-TCR y su selectividad de antígeno. En seres humanos, las células T γδ que expresan la cadena de Vδ1+-TCR (células T Vδ1+) predominan en tejidos epiteliales o asociados al epitelio/mucosos de la piel, las vías respiratorias, los tractos digestivo y urogenital, y varios órganos internos, y constituyen una fracción menor (<20%) de las células T γδ en sangre periférica. Los TCR de células T Vδ1+ reconocen antígenos lipídicos presentados por las moléculas CD1 relacionadas con el MHC. Además, las células T Vδ1+ responden a proteínas asociadas con el estrés, que incluyen las moléculas relacionadas con el MHC MICA y MICB, y las proteínas de choque térmico. Se cree que éstas proporcionan una defensa de primera línea frente a tumores y células estresadas de otra manera y, además, se cree que contribuyen a la cicatrización, la reparación de tejidos y la autoinmunidad. En la sangre periférica humana de individuos sanos, las células T γδ conforman el 2-10% de las células T CD3+ totales, y la mayoría (>80%) de las células T γδ de sangre periférica son células T γδ que expresan la cadena de Vγ2Vδ2+-TCR (células T Vγ2Vδ2+γδ) (Morita et al., 2000; Carding y Egan, 2002). Son altamente selectivas para antígenos no peptídicos pequeños de origen sobre todo microbiano y no requieren la presentación de antígeno mediante las moléculas de MHC clásicas, tal como es típico para las células αβ selectivas de péptido (véase anteriormente). Los antígenos de células T Vγ2Vδ2+γδ incluyen prenilpirofosfatos, tales como pirofosfato de isopentenilo (IPP), alquilaminas y metabolitos de una ruta de biosíntesis de isoprenoides recién descubierta encontrada en la mayoría de los patógenos microbianos humanos y bacterias comensales (Morita et al., 2000; Eberl et al., 2003). Algunos de estos antígenos de células T Vγ2Vδ2+γδ, tales como IPP y alquilaminas, también se liberan por las células de tejido necrótico. El homólogo de las células T Vγ2Vδ2+γδ humanas, que porta los TCR VγVδ homólogos con selectividad para antígenos no peptídicos pequeños de origen microbiano, también existe en primates superiores, tales como macacos, pero no existe en roedores, incluyendo ratones y conejos. No está claro por qué la presencia de las células T Vγ2Vδ2+γδ se limita a los primates superiores pero podría especularse que evolucionaron para satisfacer la necesidad especial de protección celular frente a una selección específica para especie, diferenciada, de microbios. Las células T Vγ2Vδ2+γδ se expanden rápidamente en respuesta al IPP del antígeno modelo o a extractos microbianos in vitro durante el cultivo tisular de células T Vγ2Vδ2+γδ...
Reivindicaciones:
1. Método para la preparación de células T γδ humanas presentadoras de antígeno eficaces que comprende seleccionar las células T γδ de células mononucleares de sangre periférica humana, tratar las células seleccionadas con un estímulo para la inducción de las funciones presentadoras de antígeno y aplicar el antígeno para su captación y presentación por estas células.
2. Método según la reivindicación 1, en el que se realiza la selección de las células T γδ mediante clasificación celular magnética con anticuerpos frente a receptores de células T-VγVδ humanas mediante protocolos convencionales.
3. Método según la reivindicación 1, en el que se realiza la selección de células T γδ cultivando linfocitos de sangre periférica recién aislados en presencia de compuestos no peptídicos de bajo peso molecular estructuralmente definidos que inducen la expansión selectiva de las células T γδ que expresan cadenas del receptor de células T Vγ2Vδ2+.
4. Método según la reivindicación 3, en el que el compuesto no peptídico de bajo peso molecular estructuralmente definido es pirofosfato de isopentenilo.
5. Método según la reivindicación 1, en el que el estímulo para la inducción de las funciones presentadoras de antígeno es un compuesto no peptídico de bajo peso molecular.
6. Método según la reivindicación 5, en el que el compuesto no peptídico de bajo peso molecular estructuralmente definido es pirofosfato de isopentenilo.
7. Método según la reivindicación 5, en el que el compuesto no peptídico de bajo peso molecular estructuralmente definido es pirofosfato de 4-hidroxi-3-metil-but-2-enilo.
8. Método según la reivindicación 1, en el que el estímulo para la inducción de las funciones presentadoras de antígeno es fitohemaglutinina.
9. Método según la reivindicación 1, en el que el antígeno aplicado está en forma de proteínas definidas, mezclas de proteínas no definidas, o extractos brutos o enriquecidos de células tumorales o infectadas.
10. Método según la reivindicación 1, en el que el antígeno aplicado es un péptido derivado de patógenos o de células tumorales.
11. Método según la reivindicación 9, en el que el antígeno es una proteína derivada de patógenos, que se aplica en forma de ADN o ARN que lo codifica en condiciones que permiten la expresión endógena de dichas proteínas derivadas de patógenos.
12. Método según la reivindicación 11, en el que el ADN o ARN es ADN o ARN purificado o un vector de inserción que contiene tal ADN o ARN.
13. Células T γδ humanas presentadoras de antígeno eficaces preparadas mediante el método según la reivindicación 1.
14. Uso de células T γδ humanas presentadoras de antígeno eficaces para la fabricación de un medicamento para su uso en inmunoterapia o vacunación.
15. Uso de vacunas dirigidas a células T γδ para la fabricación de un medicamento para su uso en inmunoterapia o vacunación o tumores o enfermedades infecciosas recurrentes, en el que dichas vacunas dirigidas a células T γδ comprenden un antígeno que se capta y se presenta por células T γδ humanas con el fin de la presentación de antígeno.
16. Uso según la reivindicación 15, en el que el uso implica aplicaciones únicas o repetidas de dichas células T γδ por las vías intradérmica, subcutánea, intramuscular, intravenosa, mucosa o submucosa.
17. Uso según la reivindicación 16, en el que la aplicación implica la inyección en un paciente que va a vacunarse.
18. Uso según las reivindicaciones 15-17, en el que dicho medicamento comprende una vacuna que es un compuesto híbrido compuesto por agentes de vacuna y moléculas dirigidas a células T γδ.
19. Uso según la reivindicación 18, en el que dicho compuesto híbrido comprende anticuerpos o ligandos específicos para receptores endocíticos en células T γδ.
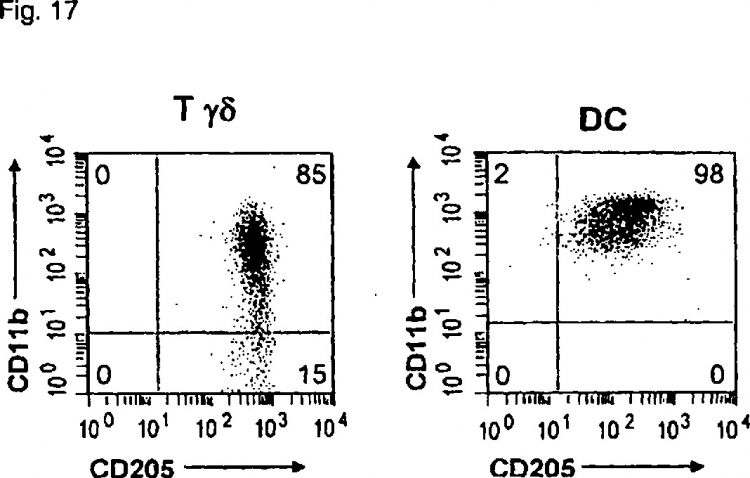
20. Uso según la reivindicación 18, en el que dicho compuesto híbrido comprende anticuerpos o ligandos específicos para CD1 1 b y CD205.
21. Uso según la reivindicación 18, en el que dichos agentes de vacuna son proteínas frente a las que se desea una protección inmunitaria.
22. Uso según la reivindicación 15, en el que la administración de vacunas dirigidas a células T γδ implica administraciones orales repetidas.
23. Método de identificación de antígenos asociados a tumores o derivados de patógenos novedosos que comprende seleccionar células T γδ de células mononucleares de sangre periférica humana, tratar las células seleccionadas con un estímulo para la inducción de las funciones presentadoras de antígeno, aplicar fracciones de una mezcla de proteínas no definida, o extractos brutos o enriquecidos de células tumorales o infectadas, o bibliotecas de ARN o ADN derivadas de tumores y agentes infecciosos, someter a prueba para detectar la activación in vitro de células T αβ vírgenes autólogas, y seleccionar muestras de proteínas con antigenicidad aumentada.
24. Método de diagnóstico de la competencia inmunitaria de un paciente que comprende seleccionar células T γδ de células mononucleares de sangre periférica del paciente, tratar las células seleccionadas con un estímulo para la inducción de las funciones presentadoras de antígeno, aplicar el antígeno para el que ha de determinarse la competencia inmunitaria, y someter a prueba para detectar la activación in vitro de células T αβ autólogas.
Patentes similares o relacionadas:
Complejos de anticuerpo solubles para la activación y expansión de linfocitos T o células NK, del 24 de Junio de 2020, de Stemcell Technologies Inc: Un método de activación de linfocitos T o células NK que comprende cultivar una muestra que contiene linfocitos T o células NK con una composición que […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Métodos para la transducción y el procesamiento de células, del 27 de Mayo de 2020, de Juno Therapeutics, Inc: Un método de transducción, que comprende incubar, en una cavidad interna de una cámara de centrífuga, una composición de entrada que comprende células y partículas […]
Regímenes de aumento escalonado de la dosis del heterodímero de il-15 e il-15ralfa para tratar afecciones, del 20 de Mayo de 2020, de NOVARTIS AG: Un complejo de IL-15/IL-15Rα para su uso en el tratamiento de linfocitopenia, cancer o una enfermedad infecciosa en un sujeto humano, o para […]
Métodos y composiciones para modular PD1, del 13 de Mayo de 2020, de Sangamo Therapeutics, Inc: Célula aislada que comprende una inserción o una deleción en un gen de PD1 endógeno dentro de, o entre, las secuencias mostradas en SEQ ID NO: 56 y SEQ ID NO: 60 del gen de PD1 […]
Células NK-92 que expresan CAR como agentes terapéuticos celulares, del 6 de Mayo de 2020, de CHEMOTHERAPEUTISCHES FORSCHUNGSINSTITUT GEORG-SPEYER-HAUS: Una célula o línea celular NK-92 específica de ErbB2, que contiene un vector lentiviral que codifica un receptor de antígeno quimérico que comprende […]
Células genéticamente modificadas que comprenden un gen de región constante alfa del receptor de linfocitos T humano modificado, del 6 de Mayo de 2020, de Precision Biosciences, Inc: Un linfocito T humano genéticamente modificado que comprende en su genoma un gen de región constante alfa del receptor de linfocitos T humano (TCR) modificado, […]
Célula, del 6 de Mayo de 2020, de UCL Business Ltd: Células que comprende un receptor de antígeno quimérico (RAQ) y una proteína truncada que comprende un dominio SH2 de una proteína que se […]