PREPARACION DE 2-((2,3-DIHIDRO-BENZO(1,4)DIOXIN-5-IL)-(2-HIDROXIETIL)-AMINO)-ETANOL Y PRODUCTOS INTERMEDIOS CORRESPONDIENTES.
Procedimiento para preparar un compuesto de fórmula I
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E07007755.
Solicitante: WYETH.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: FIVE GIRALDA FARMS,MADISON, NJ 07940.
Inventor/es: ZELDIS, JOSEPH, JIRKOVSKY,IVO, CHAN,ANITA W, FEIGELSON,GREGG B.
Fecha de Publicación: .
Fecha Solicitud PCT: 10 de Marzo de 2003.
Fecha Concesión Europea: 18 de Noviembre de 2009.
Clasificación Internacional de Patentes:
- C07D213/74 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 213/00 Compuestos heterocíclicos que contienen ciclos de seis miembros, no condensados con otros ciclos, con un átomo de nitrógeno como el único heteroátomo del ciclo y tres o más enlaces dobles entre miembros cíclicos o entre miembros cíclicos y miembros no cíclicos. › Radicales amino o imino sustituidos por radicales hidrocarbonados o hidrocarbonados sustituidos.
- C07D213/75 C07D 213/00 […] › Radicales amino o imino, acilados por ácidos carbónico o carboxílico, o por sus análogos de azufre o nitrógeno, p. ej. carbamatos.
- C07D213/76 C07D 213/00 […] › a los que está unido un segundo heteroátomo (radicales nitro C07D 213/61).
- C07D405/12 C07D […] › C07D 405/00 Compuestos heterocíclicos que contienen a la vez uno o más heterociclos que tienen átomos de oxígeno como únicos heteroátomos del ciclo y uno o más heterociclos que tienen átomos de nitrógeno como único heteroátomo del ciclo. › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Clasificación PCT:
- A61K31/44 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › Piridinas no condensadas; Sus derivados hidrogenados.
- A61P25/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de trastornos del sistema nervioso.
- C07D213/74 C07D 213/00 […] › Radicales amino o imino sustituidos por radicales hidrocarbonados o hidrocarbonados sustituidos.
- C07D213/75 C07D 213/00 […] › Radicales amino o imino, acilados por ácidos carbónico o carboxílico, o por sus análogos de azufre o nitrógeno, p. ej. carbamatos.
- C07D213/76 C07D 213/00 […] › a los que está unido un segundo heteroátomo (radicales nitro C07D 213/61).
- C07D405/12 C07D 405/00 […] › unidos por una cadena que contiene heteroátomos como enlaces de cadena.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
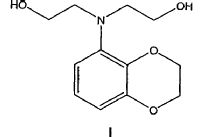
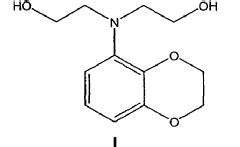
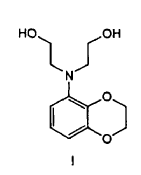
Preparación de 2-[(2,3-dihidro-benzo[1,4]dioxin-5-il)-(2-hidroxietil)-amino]-etanol y productos intermedios correspondientes.
Campo de la invención
La presente invención se refiere al campo de los procedimientos para preparar N-arilpiperazinas y productos intermedios para las mismas.
Antecedentes de la invención
Las piperazinas de fórmula A

en la que R es un alquilo inferior, Ar es un arilo o heteroarilo no sustituido o sustituido, y Q es un hidrógeno, CO-alquilo (inferior), CO-cicloalquilo, o CO-arilo, y * indica un centro quiral, son potentes agentes de unión al receptor de 5HT1A. La patente US nº 6.127.357 da a conocer derivados de piperazina que son útiles en el tratamiento de trastornos del Sistema Nervioso Central (SNC). Los enantiómeros de dichas piperazinas pueden presentar diferentes capacidades de unión a los receptores de 5HT1A. Por lo tanto, su potencia, selectividad y efectos metabólicos pueden ser diferentes. El documento WO 9703982 da a conocer que ciertos enantiómeros de tales piperazinas presentan una afinidad de unión a 5HT1A y una biodisponibilidad mejoradas.
El documento WO 9533725 da a conocer un método para sintetizar algunas piperazinas quirales de la fórmula A mediante alquilación de la 1-aril-piperazina correspondiente con 2-(5-metil-2,2-dióxido-1,2,3-oxatiazolidin-3-il)piridina enantioméricamente pura. Asimismo, el documento WO 9533725 da a conocer aperturas de anillo nucleofílicas de sulfamidatos con 1-aril-piperazina, y, a partir de L. T. Boulton, J. Chem. Soc., Perkin Trans. 1, 1999, 1421-1429, se conoce la apertura con diversas aminas primarias y secundarias.
El documento WO 97/37655 y Cignarella et al., Farmaco Ed. Sci.; 31: 1976; 194, 196, tratan sobre la preparación y reacción de N1-(2'piridil)-1,2-propano-diamina.
En el documento EP 1 483 243 B1 se describe un procedimiento fiable, económico, funcionalmente simple y eficiente, para la preparación de las piperazinas óptimamente preferidas.
Sumario de la invención
En un aspecto la presente invención se refiere a un procedimiento para preparar un compuesto de fórmula I
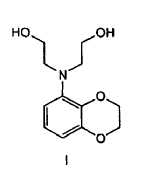
que comprende la dialquilación de una benzodioxoananilina en presencia de cloroetanol.
En otro aspecto la invención se refiere a un procedimiento alternativo para producir un producto de fórmula I que comprende la dialquilación de una benzodioxananilina en presencia de haloacetato de alquilo para producir un diéster, y la reducción del diéster para formar un diol.
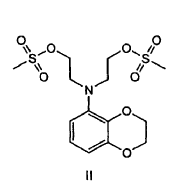
La invención proporciona además que el diol de la fórmula I preparado mediante cualquiera de los procedimientos anteriores sea convertido en un compuesto de fórmula II:
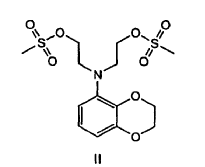
Descripción detallada de la invención
La presente invención se refiere a los procedimientos para producir productos intermedios que resultan útiles para la preparación de las N-arilpiperazinas. En el documento EP 1483243 B1 se da a conocer un procedimiento que utiliza dichos productos intermedios para preparar las N-arilpiperazinas.
En una forma de realización de la presente invención, se prepara un compuesto de fórmula I mediante la dialquilación de una benzodioxananilina en presencia de cloroetanol. En una forma de realización el cloroetanol es el 2-cloroetanol. En otra forma de realización los restos hidroxilo del compuesto de la fórmula son convertidos en grupos salientes mesilato.
En una forma de realización preferida el dimesilato de fórmula II es formado mediante la secuencia de reacción siguiente:

Alternativamente, el compuesto de la fórmula I se prepara mediante dialquilación de una benzodioxananilina con haloacetato de alquilo, seguido de reducción. En una forma de realización, el haloacetato de alquilo es el bromoacetato de etilo.
En una forma de realización preferida el compuesto de la fórmula I se prepara como se expone a continuación:
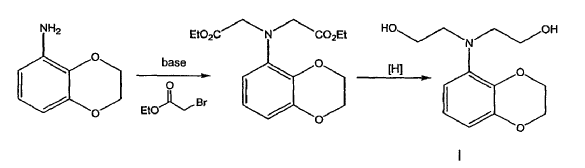
En una forma de realización el diéster es reducido en presencia de LAH.
En el procedimiento descrito en el documento EP 1 483 243 B1 el dimesilato de fórmula II se puede acoplar con el ácido N1-(2'-piridil)-1,2-propano-diamino sulfámico de fórmula III para formar una piperazina de fórmula IV:
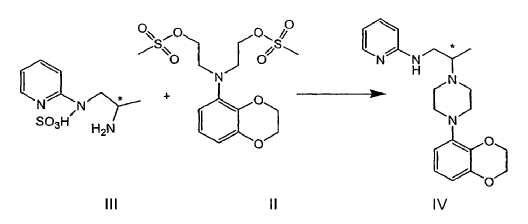
en la que * indica un estereocentro de carbono asimétrico.
Por lo tanto el documento EP 1 483 243 B1 proporciona un procedimiento que utiliza los productos intermedios preparados mediante los procedimientos de la presente invención que resulta útil en la síntesis de piperazinas N,N'-disustituidas, ópticamente activas que presentan actividad como antagonistas del receptor de 5-HT1A (serotonina).
Cuando se necesita la presencia de un ácido, base o disolvente en una reacción de la presente invención, se puede usar cualquier ácido, base o disolvente adecuado conocido en la técnica. Los expertos en la materia podrán identificar sin dificultad los disolventes, ácidos y bases a usar en la práctica de esta invención.
Los siguientes ejemplos 1 a 3 se proporcionan a título ilustrativo de formas de realización de la presente invención, pero no deben interpretarse como limitativos del alcance de la misma. Los reactivos y disolventes para la etapa individual se proporcionan únicamente con fines ilustrativos y se pueden sustituir por reactivos y disolventes conocidos por los expertos en la materia.
Los ejemplos de referencia 1 a 3 demuestran cómo los productos intermedios preparados mediante los procedimientos de la presente invención, pueden ser utilizados para sintetizar las piperazinas N,N'-disustituidas óptimamente activas como se ha descrito en el documento EP 1 483 243 B1.
Ejemplo 1
Alquilación de benzodioxananilina a diéster

Se calentó a reflujo una mezcla de benzodioxananilina (3,0 g, 20 mmoles), bromoacetato de etilo (7,5 ml, 68 mmoles), base de Hunig (12,5 ml, 72 mmoles) y Nal (0,3 g, 2,0 mmoles) en tolueno (30 ml). Después de 23 horas, la mezcla de reacción se enfrió hasta la temperatura ambiente. Se añadió agua (25 ml). Las dos capas se separaron. La capa acuosa se extrajo con tolueno (25 ml). Las capas orgánicas combinadas se secaron sobre Na2SO4, se filtraron y se concentraron a vacío para dar 6,5 g (100%) del diéster como un aceite pardo. RMN 1H (CDCl3) d 6,70 (t, J=8,1 Hz, 1H), 6,3-6,6 (m, 2H), 4,1-4,3 (m, 12H), 1,2-1,3 (m, 6H).
Ejemplo 2
Reducción del diéster de benzodioxano a diol
Una mezcla de diéster (24 g, 74,3 mmoles) en THF (240 ml) se enfrió hasta 0-5ºC antes de añadir lentamente peletes de LAH (9,9 g, 260 mmoles) mientras se mantiene la temperatura de reacción por debajo de 10ºC. Después de la adición de LAH, el baño de enfriamiento se retiró, y la agitación se continuó a temperatura ambiente toda la noche. Después de 18 horas de agitación, la mezcla de reacción se enfrió hasta 0±5ºC en un baño de hielo seco/IPA. Se añadió lentamente agua (10 ml) a la mezcla de reacción, seguido de hidróxido de sodio acuoso al 15% (10 ml) y agua (30 ml). La mezcla resultante se agitó durante 30 minutos, y luego se filtró. Los sólidos se lavaron con THF (100 ml). El filtrado se concentró a vacío para dar 14,5 g (81%) de diol de fórmula IV como un aceite transparente espeso con una pureza de 98% de área (LC-MS). RMN 1H (CDCl3) d 6,88-6,70 (m, 3H), 4,34-4,22 (m, 4H), 3,54 (t, J=7,5Hz, 4H), 3,18 (t, J=7,5Hz, 4H).
Ejemplo 3
Dialquilación de benzodioxananilina a diol
Se calentó hasta 120ºC...
Reivindicaciones:
1. Procedimiento para preparar un compuesto de fórmula I

que comprende la dialquilación de una benzodioxananilina en presencia de cloroetanol.
2. Procedimiento según la reivindicación 1, en el que el cloroetanol es el 2-cloroetanol.
3. Procedimiento para preparar un compuesto de fórmula I
que comprende la dialquilación de una benzodioxananilina en presencia de un haloacetato de alquilo para producir un diéster y la reducción del diéster para formar un diol.
4. Procedimiento según la reivindicación 3, en el que el haloacetato de alquilo es el bromoacetato de etilo.
5. Procedimiento según la reivindicación 3 ó 4, en el que el diéster es reducido en presencia de LAH.
6. Procedimiento según cualquiera de las reivindicaciones 1 a 5, que comprende además la conversión del diol en grupos mesilato para formar un compuesto de la fórmula II
Patentes similares o relacionadas:
2-Fluoro-3-nitrotolueno cristalino y procedimiento para la preparación del mismo, del 1 de Julio de 2020, de F.I.S. FABBRICA ITALIANA SINTETICI S.P.A: 2-Fluoro-3-nitrotolueno cristalino de Fórmula (I): **(Ver fórmula)** que tiene un pico de inicio de DSC a un valor entre 25,0 y 26,0 °C o que tiene un pico máximo de […]
Uso de principios activos refrescantes fisiológicos y agentes que contienen tales principios activos, del 17 de Junio de 2020, de Symrise AG: Procedimiento no terapéutico para la modulación in-vitro del receptor de mentol frío TRPM8, en el que se lleva a contacto el receptor con al menos un modulador, que se selecciona […]
Moduladores de ROR-gamma, del 18 de Marzo de 2020, de Lead Pharma B.V: Un compuesto según la Fórmula I **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde - A1 es NR1 o CR1, siendo […]
Moduladores de ROR gamma (RORgamma), del 18 de Marzo de 2020, de Lead Pharma B.V: Un compuesto según la Fórmula I **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: A1 es NR1 o CR1, siendo R1 H o metilo, estando el metilo, […]
Moduladores de ROR-gamma, del 11 de Marzo de 2020, de Lead Pharma B.V: Un compuesto según la Fórmula I **(Ver fórmula)** Meta o para o una de sus sales farmacéuticamente aceptables, en donde: - A11 - A14 son N o CR11, CR12, CR13, […]
Moduladores de ROR-gamma, del 19 de Febrero de 2020, de Lead Pharma B.V: Un compuesto según la Fórmula I **(Ver fórmula)** o una de sus sales farmacéuticamente aceptables, en donde: - A1-A8 son N o CR1-CR8, respectivamente, con la condición […]
Profármaco de roflumilast, del 29 de Enero de 2020, de HISAMITSU PHARMACEUTICAL CO. INC.: Un compuesto representado por la fórmula (I) o una sal farmacéuticamente aceptable del mismo: **(Ver fórmula)** donde R es un grupo alquilo C1-6 opcionalmente […]
Etinos de amidoheteroaril aroil hidrazida novedosos, del 29 de Enero de 2020, de Sun Pharma Advanced Research Company Ltd: Un compuesto de fórmula I **(Ver fórmula)** y las sales farmacéuticamente aceptables de los mismos en la que, R1 se selecciona entre -cicloalquilo C3-6, -alquilo […]