POTENCIADOR DE VACUNA DE PROTEOSOMAS-LIPOSACÁRIDOS.
Uso de un potenciador en la fabricación de un medicamento para potenciar la inmunidad frente a un antígeno,
comprendiendo dicho potenciador una preparación de proteínas de membrana externa de proteosomas preparada a partir de una primera bacteria gram negativa y una preparación de liposacáridos derivada de una segunda bacteria gram negativa, en el que las preparaciones de proteínas de membrana externa de proteosomas y liposacáridos forman un complejo potenciador no covalente estable, y en el que un contenido final de liposacáridos en peso como porcentaje de las proteínas totales de proteosomas es al menos de aproximadamente un 13%
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2002/007108.
Solicitante: ID BIOMEDICAL CORPORATION OF QUEBEC.
Nacionalidad solicitante: Canadá.
Dirección: 525 CARTIER BOULEVARD WEST LAVAL, QC H7V 3S8 CANADA.
Inventor/es: BURT, DAVID, S., LOWELL, GEORGE, H., RIOUX, CLEMENT, JONES, DAVID, WHITE,Gregory,L.
Fecha de Publicación: .
Fecha Solicitud PCT: 11 de Marzo de 2002.
Clasificación PCT:
- A61K39/39 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
Clasificación antigua:
- A61K39/02 A61K 39/00 […] › Antígenos bacterianos.
- A61K39/095 A61K 39/00 […] › Neisseria.
- A61K39/108 A61K 39/00 […] › Escherichia; Klebsiella.
- A61K39/116 A61K 39/00 […] › Antígenos bacterianos polivalentes.
- A61K39/12 A61K 39/00 […] › Antígenos virales.
- A61K39/385 A61K 39/00 […] › Haptenos o antígenos, unidos a soportes.
- C07H1/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › Procesos para la preparación de derivados de azúcar.
- C07K1/00 C07 […] › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Procedimientos generales de preparación de péptidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
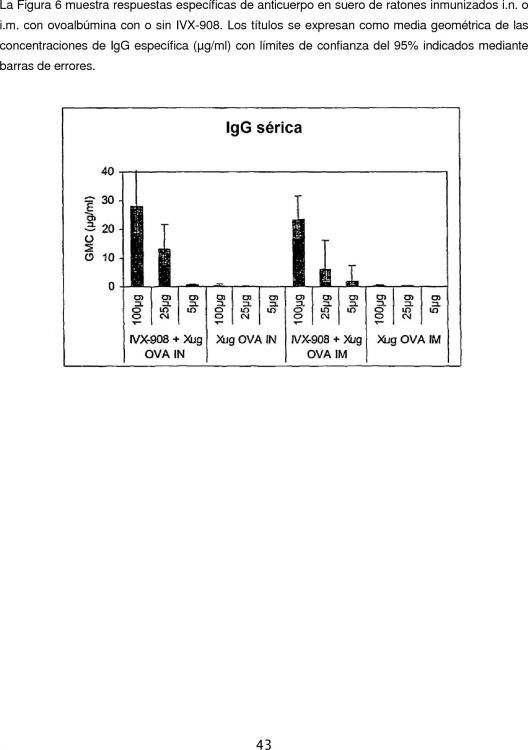
Fragmento de la descripción:
Campo de la invención
La presente invención se refiere a potenciadores para aumentar la capacidad inmunógena y la mejora de la respuesta inmune de antígenos y a los procedimientos y composiciones para preparar y usar los anteriores. 5
Antecedentes de la Invención
Se puede aumentar la capacidad de los antígenos para inducir respuestas inmunes en un hospedador combinando el antígeno con inmunoestimulantes o potenciadores. Se usan casi en exclusiva potenciadores basados en alúmina para vacunas humanas inyectables aprobadas, sin 10 embargo, aunque la alúmina potencia algunos tipos de respuestas de anticuerpos en suero (Tipo 2), es poco apropiada para potenciar otros tipos de respuestas de anticuerpos (Tipo 1) y es un activador deficiente de respuestas inmunes celulares que son importantes para la protección frente a patógenos intracelulares y para vacunas terapéuticas para el cáncer y la alergia. Además, la alúmina potencia las reacciones alérgicas debido a la producción de IgE. Aunque se han 15 probado numerosas sustancias y muestran ser potentes potenciadores de respuestas inmunes de anticuerpos y celulares (Tipo 1) en modelos animales, muy pocas han demostrado ser adecuadas para uso en seres humanos debido a los inaceptables niveles de reactogenicidad y/o a las decepcionantes capacidades inmunopotenciadoras. Además, no existen en la actualidad potenciadores aprobados capaces de potenciar respuestas inmunes en superficies mucosales por 20 las que penetran en el hospedador la mayoría de agentes infecciosos. De hecho, en Estados Unidos se ha interrumpido el desarrollo de los potenciadores mucosales más prometedores administrados por vía nasal, las enterotoxinas bacterianas (por ejemplo, toxinas del cólera mutadas y lábiles al calor) debido a su capacidad de transportarse hasta, y producir inflamación en la región del bulbo olfatorio del SNC de los roedores. Existe necesidad de potentes potenciadores 25 que sean seguros en seres humanos y capaces de inducir respuestas inmunes sistémicas y mucosales humorales y celulares protectoras.
Los liposacáridos (LPS) de las bacterias gram negativas son potentes potenciadores. Los LPS activan el sistema inmune innato ocasionando la producción de citocinas inflamatorias tales como IL-1, TNF-, IL-10 e IL-12 procedentes de macrófagos y células dendríticas; IL-1, IL-6 e IL-8 30 procedentes de células endoteliales e IL-8 procedente de células epiteliales. Además, LPS es un activador de linfocitos B en ratones, y en alguna extensión en seres humanos, tal como se evidenció por la mitogenicidad de los linfocitos B y la estimulación de la secreción de anticuerpos policlonales. LPS media sus efectos mediante la unión con moléculas CD 14 y la activación de receptores de tipo toll (TLR) en la superficie de células presentadoras de antígenos que conducen 35 al inicio de una cascada transcripcional, expresión génica y secreción de moléculas proinflamatorias.
A pesar del potencial potenciador de los LPS, se ha restringido su uso en seres humanos debido a la endotoxicidad asociada mediada por la porción del lípido A de la molécula. Se ha demostrado que la modificación química de la región del lípido A de los LPS detoxifica 5 sustancialmente el lípido A (por ejemplo, monofosforil lípido A o MPL-A o, por ejemplo, detoxificación alcalina para eliminar algunos ácidos grasos) manteniendo a la vez algunas propiedades potenciadoras (véase Qureshi y col. J. Biol Chem 1982; 257:11808-15). Aunque MPL-A presentó una potente actividad potenciadora en animales, la experiencia en seres humanos ha sido inconsistente, mostrando una deficiente actividad potenciadora con algunos 10 antígenos y una inaceptable reactogenicidad global en muchas situaciones.
Se han administrado a seres humanos complejos de proteosomas-LPS no covalentes, que contienen proteosomas de Neisseria meningitidis y LPS purificados de Shigella flexneri o Plesiomonas shigelloides, por vía intranasal y oral en ensayos clínicos en fase 1 y fase 2 en el contexto de vacunas independientes. Estas vacunas inducen respuestas inmunes protectoras 15 frente a la infección por Shigella flexneri o S. sonnei, respectivamente, en animales (Mallet y col. Infect and Immun 1995; 63:2382-86) y seres humanos (Fries y col. Infect Immun. 2001; 69:4545-53) cuando se proporcionan mediante la ruta intranasal. Además, estos complejos fueron bien tolerados por las rutas nasal u oral a dosis muy altas en seres humanos (hasta 1,5 mg de proteosomas junto con cantidades comparables de LPS proporcionados intranasalmente y hasta 2 20 mg de cada uno de los componentes de proteosomas y LPS proporcionados oralmente) (Fries y col. 2000) y no mostraron toxicidad asociada al bulbo olfatorio u otro componente del SNC en estudios de toxicidad con animales pequeños. Los proteosomas consisten predominantemente en proteínas porinas y otras proteínas de la membrana externa. Las evidencias sugieren que las porinas proteosómicas pueden inducir también IL-12 procedente de células dendríticas y la 25 inducción de linfocitos T CD8+ (Jeannin y col. Nature Immunology 2000; 1:502-509) y la activación de células Hela para producir IL-8 (Pridmore y col. J. Infect Dis 2000; 10:183). Las porinas proteosómicas regulan también por aumento moléculas B7.2 (CD28) coestimuladoras en células presentadoras de antígenos mediante la activación del receptor 2 de tipo toll (Massari y col. J. Immunol. 2002,168;1533-1537). 30
Dalseg y col. (en Vaccines 96 pp. 177-182 (Cold Spring Harbor laboratory Press. 1996)) informan del uso de vesículas de membrana externa de meningococos (VME) como potenciadores mucosales del virus de la gripe completamente inactivado. Dalseg y sus asociados y colaboradores han informado que las VME que ellos preparan emplean un procedimiento que retiene del 6% al 9% de lipooligosacárido endógeno (LOS) remanente en comparación con la 35 cantidad de proteína de VME total en peso. También han informado de que estas preparaciones de VME retienen específicamente un 16% de detergente (desoxicolato) en sus VME, una cantidad que puede ser poco saludable o tóxica en estudios de toxicidad o en seres humanos.
El documento US-A-5985284 se refiere a vacunas orales o intranasales que usan complejos hidrófobos que tienen proteosomas y lipopolisacáridos. 5
El documento WO 97/10844 se refiere a procedimientos mejorados para la producción de vacunas de subunidades de proteosomas multivalentes y complejadas de manera no covalente.
Orr y col., noviembre de 1994 (Infection and Immunity, Vol 62 Nº 11, p5198-5200) se refieren a la potenciación de la respuesta del lipopolisacárido (LPS) anti-Shigella mediante la adición de la subunidad B de la toxina del cólera a vacunas de LPS de proteosomas-Shigella 10 flexneri 2a orales o intranasales.
Levi-R y col (Vaccine 13(14) 1995; 1353-1359) describen péptidos sintéticos de la gripe que tienen un grupo lauroilo añadido a sus aminoácidos terminales. Estos se acoplaron a proteosomas y se usaron a continuación para inmunizar ratones intranasalmente para estimular una respuesta inmune humoral y celular específica frente al virus de la gripe. 15
Breve descripción de la invención
El alcance de la presente invención se define mediante las reivindicaciones y cualquier información que no esté comprendida dentro de las reivindicaciones se proporciona únicamente para información. 20
La presente invención (IVX-908) describe composiciones y procedimientos para la producción de formulaciones novedosas que son potenciadoras de antígenos y dan como resultado vacunas o inmunoterapéuticas potenciadas cuando se combinan la invención y el(los) antígeno(s) mediante mezcla simple y las vacunas o inmunoterapéuticas potenciadas se administran mediante una ruta parenteral o mucosal. 25
La invención proporciona por tanto el uso de un potenciador en la fabricación de un medicamento para aumentar la inmunidad a un antígeno, comprendiendo dicho potenciador una preparación de proteínas de membrana externa de proteosomas preparada a partir de una primera bacteria gram negativa y una preparación de liposacáridos derivada de una segunda bacteria gram negativa, en la que las preparaciones de proteínas de membrana externa de 30 proteosomas y liposacáridos forman un complejo potenciador no covalente estable, y en la que un contenido final de lipopolisacáridos en peso como porcentaje de la proteína total de los proteosomas es al menos de un 13%.
Se proporciona también el uso de un potenciador, tal como se ha definido...
Reivindicaciones:
1. Uso de un potenciador en la fabricación de un medicamento para potenciar la inmunidad frente a un antígeno, comprendiendo dicho potenciador una preparación de proteínas de membrana externa de proteosomas preparada a partir de una primera bacteria gram negativa y 5 una preparación de liposacáridos derivada de una segunda bacteria gram negativa, en el que las preparaciones de proteínas de membrana externa de proteosomas y liposacáridos forman un complejo potenciador no covalente estable, y en el que un contenido final de liposacáridos en peso como porcentaje de las proteínas totales de proteosomas es al menos de aproximadamente un 13%. 10
2. Uso del potenciador tal como se define en la reivindicación 1 en la fabricación de:
(a) el potenciador para aumentar la capacidad inmunógena y mejorar la respuesta inmune frente al antígeno;
(b) una vacuna combinada con el antígeno, o 15
(c) una inmunoterapia, para la inmunización inicial o de refuerzo antes de o posterior a la administración del antígeno.
3. Uso de acuerdo con la reivindicación 1 ó 2, en el que:
(a) la primera y la segunda bacteria gram negativas son iguales; 20
(b) la primera y la segunda bacteria gram negativas son diferentes;
(c) la primera bacteria gram negativa se selecciona del género Neisseria, en el que opcionalmente la Neisseria es Neisseria meningitidis; o
(d) la segunda bacteria gram negativa se selecciona entre los siguientes géneros: Escherichia, Shigella, Plesiomonas, o Salmonella, en el que opcionalmente, la 25 segunda bacteria gram negativa se selecciona entre E. coli, S. flexneri, P. shigelloides, o S. essen.
4. Uso de acuerdo con cualquiera de las reivindicaciones precedenres, en el que el contenido final en liposacáridos en peso como porcentaje de la proteína proteosoma total está 30 entre:
(a) 15% a 300%:
(b) 20% a 200%; o
(c) 30% a 150%.
35
5. Uso de acuerdo con la reivindicación 1, 2 ó 3, en el que la preparación de proteosomas
tiene un contenido en liposacáridos entre:
(a) 0,5% y 5% de la proteína total;
(b) 12% y 25% de la proteína total; o
(c) 15% y 20% de la proteína total.
5
6. Uso de acuerdo con la reivindicación 1 ó 2, en el que:
(a) la primera bacteria gram negativa es Neisseria meningitidis y la segunda bacteria gram negativa es Shigella flexneri y el contenido final en liposacáridos está entre 50% y 150%; o
(b) la primera bacteria gram negativa es Neisseria meningitidis y la segunda 10 bacteria gram negativa es Plesiomonas shigelloides y el contenido final en liposacáridos está entre 50% y 150%
7. Uso de un potenciador tal como se define en cualquiera de las reivindicaciones 1 a 6 y del antígeno en la fabricación de una composición inmunógena. 15
8. Uso de acuerdo con la reivindicación 7, en el que el antígeno se selecciona entre:
(a) un antígeno derivado de un organismo infeccioso del reino animal o del reino vegetal, en el que la composición inmunógena induce la inmunidad frente al organismo infeccioso; 20
(b) un alérgeno, un alérgeno química o biológicamente modificado, o un material químico;
(c) microorganismo completo o perturbado que incluye un virus, bacteria o parásito, atenuado y/o inactivado;
(d) un antígeno que está producido mediante procedimientos moleculares sintéticos 25 o recombinantes;
(e) Bet v 1a o Bet v 1a recombinante (rBet v 1a);
(f) un antígeno recombinante de la gripe;
(g) antígeno fraccionado de la gripe;
(h) extracto de polen de abedul; o 30
(i) un extracto de alérgeno.
9. Uso de acuerdo con la reivindicación 7 o la reivindicación 8, en el que la composición inmunógena es para uso como una inmunoterapia, una vacuna profiláctica potenciada, o una vacuna terapéutica para inducir una respuesta inmune específica del antígeno. 35
10. Uso de acuerdo con las reivindicaciones 7 a 9 para la fabricación de un medicamento para inducir una respuesta inmune al antígeno en un sujeto.
11. Uso de acuerdo con cualquiera de las reivindicaciones anteriores, en el que el medicamento es para administración por una ruta seleccionada entre mucosal, entérica, 5 parenteral, transdérmica/transmucosal, e inhalación para inducir una respuesta de anticuerpos séricos o mucosales o una respuesta inmune celular de Tipo 1 frente al antígeno.
12. Uso de acuerdo con la reivindicación 11 en el que;
(a) la ruta mucosal es mediante la mucosa nasal, orofaríngea, ocular, o 10 genitourinaria;
(b) la ruta entérica es oral, rectal o sublingual;
(c) la ruta parenteral es una cualquiera de inyección o infusión intraarterial, intradérmica, intramuscular, intraperitoneal, intravenosa, subcutánea, y submucosal; 15
(d) la ruta transdérmica/transmucosal es tópica; o
(e) la ruta de inhalación es intranasal, orofaríngea, intratraqueal, intrapulmonar o transpulmonar.
13. Uso de un potenciador de acuerdo con cualquiera de las reivindicaciones anteriores, 20 en el que el medicamento se administra en una cantidad suficiente para potenciar una respuesta inmune a un antígeno cuando se compara con una respuesta inmune al antígeno cuando se administra el antígeno en ausencia del potenciador.
14. El uso de una cualquiera de las reivindicaciones 7 a 13 en el que la respuesta inmune 25 frente al antígeno incluye una o más de las siguientes: a) niveles crecientes de anticuerpos séricos específicos de IgG o anticuerpos séricos; b) anticuerpos mucosales que incluyen IgG en secreciones mucosales recogidas de los tractos respiratorio, gastrointestinal o genitourinario; y c) correlaciones de inmunidad mediada por células (IMC) que incluyen un cambio de respuestas de Tipo 2 mayores o predominantes a respuestas de Tipo 1 mixtas, equilibradas, crecientes o 30 predominantes tal como se midió por los ensayos celulares o de anticuerpos o los ensayos de citocinas de Tipo 1 tales como IFN-γ con citocinas de Tipo 2 mantenidas, decrecientes o ausentes tales como IL-5.
15. El uso de una cualquiera de las reivindicaciones 7 a 13 en el que el medicamento es 35
para la administración en una serie de etapas de administración.
16. Una composición inmunógena que comprende el potenciador tal como se define en una cualquiera de las reivindicaciones 1 ó 3 a 6 y un antígeno, en el que el potenciador aumenta la inmunogenicidad del antígeno, y en el que el antígeno se selecciona entre 5
(a) un antígeno derivado de un organismo infeccioso en el que el organismo infeccioso es un virus, y en el que la composición inmunógena incluye la inmunidad frente al organismo infeccioso;
(b) un antígeno recombinante de la gripe;
(c) antígeno fraccionado de la gripe; 10
(d) un alérgeno, un alérgeno química o biológicamente modificado, o un material químico;
(e) Bet v 1a o Bet v 1a recombinante (rBet v 1a);
(f) extracto de polen de abedul; y
(g) un extracto de alérgeno. 15
17. La composición inmunógena de la reivindicación 16, en la que el antígeno está producido por procedimientos moleculares sintéticos o recombinantes.
18. La composición inmunógena de la reivindicación 16 ó 17, en la que la composición es 20 una vacuna profiláctica inmunoterapéutica potenciada o una vacuna terapéutica que induce una respuesta inmune específica del antígeno.
19. Un procedimiento para preparar una composición inmunógena que comprende mezclar un potenciador tal como se define en cualquiera de las reivindicaciones 1 ó 3 a 6 con el 25 antígeno, para formar la composición inmunógena, en el que el antígeno se selecciona entre (a) un antígeno derivado de un organismo infeccioso en el que el organismo infeccioso es un virus; (b) un antígeno recombinante de la gripe; (c) un antígeno fraccionado de la gripe; (d) un alérgeno, un alérgeno química o biológicamente modificado, o un material químico; (e) Bet v 1a o Bet v 1a recombinante (rBet v 1a); (f) extracto de polen de abedul; y (g) un extracto de alérgeno. 30
20. Uso de (a) un potenciador tal como se define en la reivindicación 1 y (b) un antígeno, para la fabricación de una vacuna potenciada o inmunoterapéutica para las inmunizaciones inicial y de refuerzo antes de o posteriormente a la administración del antígeno sin el potenciador.
21. Un producto que contiene un potenciador tal como se define en la reivindicación 1 y 35
un antígeno para las inmunizaciones inicial o de refuerzo antes de o posteriormente a, la administración del antígeno, en el que el antígeno se selecciona entre (a) un antígeno derivado de un organismo infeccioso en el que el organismo infeccioso es un virus; (b) un antígeno recombinante de la gripe; (c) un antígeno fraccionado de la gripe; (d) un alérgeno, un alérgeno química o biológicamente modificado, o un material químico; (e) Bet v 1a o Bet v 1a recombinante 5 (rBet v 1a); (i) extracto de polen de abedul; y (g) un extracto de alérgeno.
Patentes similares o relacionadas:
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Respuesta inmune mejorada en especies aviares, del 1 de Julio de 2020, de Bayer Intellectual Property GmbH: Una composición de inmunomodulador, en que la composición del inmunomodulador comprende: a. un vehículo catiónico de administración de liposomas; y […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Inmunomodulación mediante inhibidores de IAP, del 6 de Mayo de 2020, de NOVARTIS AG: Una vacuna que comprende una cantidad inmunogénica de un antígeno procedente de tumor o antígeno tumoral y un adyuvante que comprende un inhibidor de IAP […]