PLASMINA MODIFICADA RECOMBINÁNTEMENTE.
Un polinucleótido que comprende una secuencia de nucleótidos que codifica un polipéptido que tiene un único dominio en rosquilla del extremo N que es idéntico al menos el 90% al dominio en rosquilla 1 de plasminógeno humano nativo;
y un dominio del extremo C que es idéntico al menos el 90% al sitio de activación y al dominio de serina proteasa de plasminógeno humano, polipéptido que se une a lisina inmovilizada y puede activarse por un activador de plasminógeno
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/013562.
Solicitante: TALECRIS BIOTHERAPEUTICS, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4101 RESEARCH COMMONS, SUITE 300 79 T.W. ALEXANDER DRIVE RESEARCH TRIANGLE PARK NC 2770 ESTADOS UNIDOS DE AMERICA.
Inventor/es: NOVOKHATNY,VALERY, HUNT,JENNIFER,AUDREY.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Abril de 2005.
Fecha Concesión Europea: 4 de Agosto de 2010.
Clasificación Internacional de Patentes:
- C12N9/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Plasmina, es decir, fibronolisina.
Clasificación PCT:
- C12N9/68 C12N 9/00 […] › Plasmina, es decir, fibronolisina.
Clasificación antigua:
- C12N9/68 C12N 9/00 […] › Plasmina, es decir, fibronolisina.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Antecedentes de la invención
El plasminógeno humano es una proteína de una sola cadena que contiene 791 restos de aminoácidos. La activación de plasminógeno a plasmina es el resultado de una escisión única del enlace peptídico Arg561-Va1562 en el cimógeno. La molécula de plasmina resultante es una serina proteasa de dos cadenas ligada por disulfuro con especificidad similar a tripsina (después escinde Lys y Arg).
La cadena pesada del extremo amino de plasmina (restos 1-561, ∼60 kDa) está compuesta por cinco dominios en rosquilla (kringle), conteniendo cada uno aproximadamente 80 restos de aminoácidos. Los dominios en rosquilla son responsables de las propiedades reguladoras del plasminógeno tales como interacción con inhibidores de la activación, por ejemplo, iones Cl-1; con estimuladores de la activación, por ejemplo, ácido ε-aminocaproico; con células de mamífero y bacterianas; y con otras proteínas tales como el sustrato fisiológico de plasmina fibrina y el inhibidor de plasmina α2-antiplasmina. De las cinco rosquillas, la rosquilla 1 es una de las más multifuncionales: se ha demostrado que su actividad de unión a lisina es responsable de la interacción de plasmina con α2-antiplasmina y fibrina. Véanse Wiman, B. y col., Biochim. Biophys. Acta 579:142-154 (1979); y Lucas, M.A. y col., J. Biol. Chem. 258:4249-4256 (1983).
La cadena ligera del extremo C de plasmina (restos 562-791, ~251 Da) es una serina proteasa típica, homóloga a tripsina y que contiene la triada clásica de la serina proteasa catalítica: His603, Asp646 y Ser741. El plasminógeno contiene 24 puentes disulfuro y 2 sitios de glicosilación en Asn289 y Thr346.
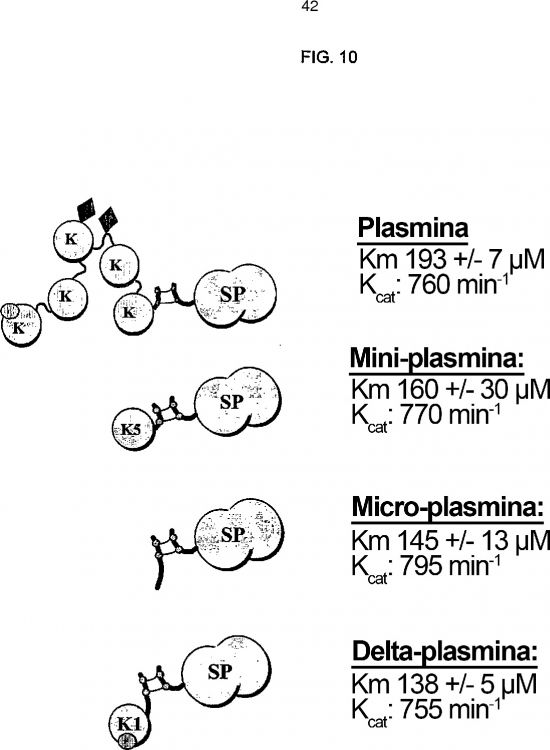
Se ha demostrado que la proteólisis limitada del plasminógeno por elastasa da como resultado tres fragmentos (Sottrup-Jensen, L. y col., Prog. Chem. Fibrinol. Thrombol., 3:191-209 (1978)). El primer fragmento, K1-3, incluye las tres primeras rosquillas y puede aislarse en dos versiones, Tyr79-Val338 y Tyr79-Val354. El segundo fragmento, K4, se corresponde con la cuarta rosquilla e incluye los restos Val355-Ala440. El último, el fragmento del extremo C (el llamado mini-plasminógeno) incluye los restos Val443-Asn791 y está constituido por la quinta rosquilla y el dominio de serina proteasa. El mini-plasminógeno puede activarse de la misma forma que el plasminógeno, formando mini-plasmina.
Debido a la compleja estructura de la molécula de plasminógeno de longitud completa, los sistemas de expresión bacteriana no se han demostrado útiles en la producción de plasminógeno recombinante. El plasminógeno se produce en forma de cuerpos de inclusión insolubles y no puede replegarse de ese estado. Además, la expresión de plasminógeno en células de mamífero se complica por la activación intracelular de plasminógeno en plasmina y la citotoxicidad resultante. La producción de plasminógeno completamente activo usando células de insecto es posible, sin embargo, este sistema no es adecuado para la producción a gran escala debido al bajo rendimiento.
Por consiguiente, se desea una proteína recombinante modificada que posea las características deseables de plasmina/plasminógeno a la vez que carezca de ciertas características negativas y que sea capaz de producir células bacterianas en cantidades sustanciales. Resumen de la invención
La presente invención proporciona un polinucleótido que comprende una secuencia de nucleótidos que codifica un polipéptido como se define en la reivindicación 1 ó 2.
En algunas realizaciones, el polipéptido codificado es idéntico en al menos el 90%, el 95%
o el 98% a la secuencia mostrada en SEC ID Nº: 2. Además, el polipéptido codificado puede ser la secuencia mostrada en SEC ID Nº: 2. La secuencia de nucleótidos del polinucleótido puede ser la secuencia mostrada en SEC ID Nº: 1 o variaciones degeneradas de la misma. En otro aspecto, la invención proporciona polipéptidos codificados por el polinucleótido como se definen anteriormente.
En algunas realizaciones, los polipéptidos pueden presentar una actividad fibrinolítica que es inhibida por α2-antiplasmina a una tasa que es al menos aproximadamente 5 veces más rápida que la tasa de inhibición de la actividad fibrinolítica de mini-plasmina por α2-antiplasmina. La tasa de inhibición por α2-antiplasmina también puede ser al menos aproximadamente 10 veces, 20 veces, 30 veces o 40 veces más rápida que la tasa de inhibición de mini-plasmina.
En algunas realizaciones, los polipéptidos pueden unirse a lisina inmovilizada. La lisina inmovilizada puede ser lisina unida a una matriz de soporte sólido seleccionada del grupo que está constituido por lisina-agarosa, lisina-BIOGEL (BioRad, Hercules, CA), lisina-HYPERD (Pall Life Sciences, East Hills, NY, un hidrogel de lisina), lisina-SEPHAROSE (SEPHAROSE es agarosa reticulada). La lisina inmovilizada puede ser lisina-SEPHAROSE.
En algunas realizaciones, los polipéptidos pueden presentar una menor afinidad de unión por el fibrinógeno que la afinidad de unión por el fibrinógeno de mini-plasmina.
En algunas realizaciones, los polipéptidos pueden presentar mayor afinidad de unión por fibrina parcialmente escindida que la afinidad de unión por fibrina parcialmente escindida de miniplasmina.
En algunas realizaciones, los polipéptidos pueden tener la secuencia de aminoácidos como se muestra en SEC ID Nº: 2 y sustituciones conservativas de la misma. Los polipéptidos pueden tener un residuo en una posición relativa análoga a la de la posición 76 de la secuencia de
aminoácidos mostrada en SEC ID Nº: 2 que es arginina.
En otro aspecto, la invención incluye vectores que comprenden los polinucleótidos de la invención, y células huésped cultivadas que comprenden los vectores. Breve descripción de los dibujos
La Figura 1 es una representación esquemática de plasmina nativa después de la activación por escisión proteolítica. K1-K5 son regiones en rosquilla 1-5; y SP es el dominio de serina proteasa. “α2-AP” es el sitio de unión a α2-antiplasmina en la rosquilla 1.
La Figura 2 es una representación esquemática de un mutante de deleción de plasminógeno de la invención usando la misma nomenclatura que en la Figura 1 y mostrando la deleción de K2-5.
La Figura 3 muestra la secuencia de aminoácidos de plasminógeno humano, mostrando la secuencia conductora de 19 restos numerada como -19 a -1 y la secuencia de plasminógeno mostrada como restos 1-791 (véase SEC ID Nº: 3 (secuencia de ADNc para plasminógeno humano; y SEC ID Nº: 4, la secuencia de aminoácidos codificada, como se muestra en la Figura 3). Se muestran varias características que incluyen las siguientes: la secuencia de deltaplasminógeno (sombreada); dominios en rosquilla 1-5 (con subrayado doble); sitios de glicosilación Asn289 y Thr346 (en negrita); el sitio de activación de Arg-Val de la activación de plasminógeno (en negrita); y sitios de unión a lisina en la rosquilla 1 (subrayados y con numeración de la posición específica).
La Figura 4 muestra comparaciones de secuencias de polipéptidos entre los cinco dominios en rosquilla (1-5) de plasmina (plasminógeno) humana(o) nativa(o). Los restos de aminoácidos que son idénticos a los de la misma posición relativa en la rosquilla 1 se muestran subrayados.
La Figura 5 muestra una SDS-PAGE del 8-25% de gradiente de una preparación de deltaplasminógeno sin reducir (Carril 1) y reducida (Carril 2). La activación de delta-plasminógeno en delta-plasmina con estreptocinasa (Carril 3), activador tisular del plasminógeno (tPA) (Carril 4) y urocinasa (Carril 5) da como resultado la formación de la molécula de dos cadenas constituida por la rosquilla 1 (K1) y el dominio de serina proteasa (SP) conectado por dos puentes disulfuro.
La Figura 6 es una representación gráfica de la activación de delta-plasminógeno por urocinasa. La urocinasa (5,8 nM) se añadió a una disolución de delta-plasminógeno 5 µM en PBS que contenía S-2251 1,0 mM a 37ºC. Los aumentos en la absorbancia se vigilaron a 405 nm.
La Figura 7 es un cromatograma que muestra la unión de delta-plasminógeno a lisina-SEPHAROSE 4B: se aplicaron 0,5 mg de delta-plasminógeno purificado sobre la columna de lisina-SEPHAROSE 4B (1x3 cm) equilibrada con solución salina tamponada con Tris, pH 7,4. La proteína unida se eluyó de la columna por un gradiente 0-20 mM de ácido ε-aminocaproico (εACA)...
Reivindicaciones:
1. Un polinucleótido que comprende una secuencia de nucleótidos que codifica un polipéptido que tiene un único dominio en rosquilla del extremo N que es idéntico al menos el 90% al dominio en rosquilla 1 de plasminógeno humano nativo; y un dominio del extremo C que es idéntico al menos el 90% al sitio de activación y al dominio de serina proteasa de plasminógeno humano, polipéptido que se une a lisina inmovilizada y puede activarse por un activador de plasminógeno.
2. El polinucleótido de la reivindicación 1, siendo el polipéptido codificado SEC ID Nº: 2 con no más de 30 sustituciones de aminoácidos.
3. El polinucleótido de la reivindicación 1 ó 2, siendo el polipéptido codificado idéntico al menos el 90% a la secuencia mostrada en SEC ID Nº: 2.
4. El polinucleótido de una cualquiera de las reivindicaciones 1-3, siendo el polipéptido codificado idéntico al menos el 95% a la secuencia mostrada en SEC ID Nº: 2.
5. El polinucleótido de una cualquiera de las reivindicaciones 1-4, siendo el polipéptido codificado idéntico al menos el 98% a la secuencia mostrada en SEC ID Nº: 2.
6. El polinucleótido de una cualquiera de las reivindicaciones 1-5, siendo el polipéptido codificado la secuencia mostrada en SEC ID Nº: 2.
7. El polinucleótido de una cualquiera de las reivindicaciones 1-6, en el que la secuencia de nucleótidos del polinucleótido es la secuencia mostrada en SEC ID Nº: 1 o una variante degenerada de la misma.
8. Un polipéptido codificado por el ácido nucleico según una cualquiera de las reivindicaciones 1 a 7.
9. El polipéptido de la reivindicación 8, presentando el polipéptido una actividad fibrinolítica que es inhibida por α2-antiplasmina a una tasa de inhibición que es al menos aproximadamente 5 veces más rápida que la tasa de inhibición de la actividad fibrinolítica de miniplasmina por α2-antiplasmina.
10. El polipéptido de la reivindicación 9, en el que la tasa de inhibición es al menos aproximadamente 10 veces, 20 veces, 30 veces o 40 veces más rápida que la tasa de inhibición de mini-plasmina.
11. El polipéptido de una cualquiera de las reivindicaciones 8 a 10, en el que la lisina inmovilizada es lisina unida a una matriz de soporte sólido seleccionada del grupo que está constituido por lisina-agarosa, lisina-hidrogel, lisina-agarosa reticulada.
12. El polipéptido de una cualquiera de las reivindicaciones 8 a 11, en el que la lisina inmovilizada es lisina-agarosa reticulada.
13. El polipéptido de una cualquiera de las reivindicaciones 8 a 12, presentando el polipéptido una menor afinidad de unión por fibrinógeno que la afinidad de unión por fibrinógeno de mini-plasmina.
14. El polipéptido de una cualquiera de las reivindicaciones 8 a 13, presentand el 5 polipéptido una mayor afinidad de unión por fibrina parcialmente escindida que la afinidad de unión por fibrina parcialmente escindida de mini-plasmina.
15. El polipéptido de una cualquiera de las reivindicaciones 8 a 14, teniendo el polipéptido una secuencia de aminoácidos como se muestra en SEC ID Nº: 2 y sustituciones conservativas de la misma.
10 16. El polipéptido de la reivindicación 15, teniendo el polipéptido un residuo de arginina en una posición relativa análoga a la de la posición 76 de la secuencia de aminoácidos mostrada en SEC ID Nº: 2.
17. Un vector de expresión que comprende un polinucleótido de una cualquiera de las reivindicaciones 1-7. 15 18. Una célula cultivada que comprende el vector de expresión de la reivindicación 17.
Patentes similares o relacionadas:
Método de trombólisis por medio del suministro local de plasmina acidulada inactivada en forma reversible, del 17 de Mayo de 2017, de Grifols Therapeutics Inc: El uso de una plasmina acidulada inactivada en forma reversible que está sustancialmente libre de un activador de plasminógeno, un excipiente […]
Variantes de plasminógeno y plasmina, del 30 de Marzo de 2016, de THROMBOGENICS N.V.: Una variante de plasminógeno aislada o plasmina obtenida a partir de esta, o una variante de plasmina aislada, o un derivado proteolíticamente activo o inactivo […]
Plasmina modificada de forma recombinante, del 21 de Enero de 2015, de Grifols Therapeutics Inc: Polipéptido para la utilización como medicamento, en el que el polipéptido se selecciona de a) un polipéptido que tiene un único dominio kringle […]
Plasmina modificada de forma recombinante, del 31 de Diciembre de 2014, de Grifols Therapeutics Inc: Polinucleótido, caracterizado porque comprende una secuencia de nucleótidos que codifica un polipéptido que es por lo menos 95% idéntico a la SEQ ID NO: 2, que tiene a) […]
Método de mejora de la cicatrización de heridas, del 11 de Abril de 2012, de OMNIO HEALER AB: Composición farmacéutica que contiene una cantidad eficaz de plasminógeno para su uso en laaceleración de la cicatrización de heridas, para su uso en la reducción […]
INHIBIDORES DE LA PLASMINA HUMANA DERIVADOS DE DOMINIOS KUNITZ Y ÁCIDOS NUCLEICOS QUE CODIFICAN LOS MISMOS, del 2 de Marzo de 2012, de DYAX CORPORATION: Uso de un polipéptido inhibidor de plasmina aislado que comprende una estructura de dominio Kunitz, que comprende una secuencia de aminoácido que tiene […]
ANGIOSTATINA Y MÉTODO PARA LA INHIBICIÓN DE LA ANGIOGÉNESIS, del 13 de Diciembre de 2011, de THE CHILDREN'S MEDICAL CENTER CORPORATION: Composición que comprende un vector que comprende una secuencia de nucleótidos que codifica para una proteína denominada angiostatina, teniendo la proteína […]
PÉPTIDOS ANTIANGIOGÉNICOS POLINUCLEÓTIDOS QUE CODIFICAN LOS MISMOS Y PROCEDIMIENTO PARA INHIBIR ANGIOGÉNESIS, del 2 de Noviembre de 2011, de ABBOTT LABORATORIES: Un compuesto que tiene la fórmula A-B1-C1-X1-Y o una sal farmacéuticamente aceptable o éster del mismo, en la que A está ausente o es un grupo protector de nitrógeno, Y […]