Péptidos de fijación a la poli-N-acetil glucosamina (PNAG/DPNAG) y procedimientos para el uso de los mismos.
Composición, que comprende
un anticuerpo aislado o fragmento del mismo que se fija selectivamente a la poli-N-acetil glucosamina(PNAG/dPNAG) estafilocócica,
en donde el anticuerpo aislado o el fragmento de anticuerpo comprende:(a) una secuencia de aminoácidos de SEQ ID n.º 1 y una secuencia de aminoácidos de SEQ ID n.º 2.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/013694.
Solicitante: THE BRIGHAM AND WOMEN'S HOSPITAL, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 75 FRANCIS STREET BOSTON, MA 02115 ESTADOS UNIDOS DE AMERICA.
Inventor/es: PIER,GERALD,B, KELLY-QUINTOS,CASIE ANNE, CAVACINI,LISA, POSNER,MARSHALL R.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/12 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales bacterianos.
PDF original: ES-2415358_T3.pdf
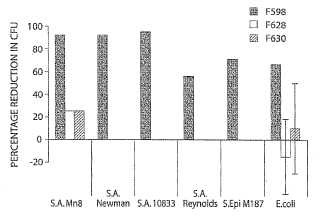
Fragmento de la descripción:
Péptidos de fijación a la poli-N-acetil glucosamina (PNAG/DPNAG) y procedimientos para el uso de los mismos Campo de la invención Esta invención se refiere de forma general a los péptidos que se fijan a la poli-N-acetil glucosamina (PNAG) y a la 5 PNAG desacetilada (dPNAG) de bacterias tales como Staphylococcus, y su uso en el diagnóstico y el tratamiento de infecciones por estafilococos y otras infecciones por bacterias que expresan la PNAG.
Antecedentes de la invención Los estafilococos son bacterias grampositivas que normalmente habitan y colonizan la piel y las membranas mucosas de los humanos. Si la piel o la membrana mucosa se daña durante una intervención quirúrgica u otro traumatismo, los estafilococos consiguen alcanzar los tejidos internos y provocan la aparición de infecciones. Si los estafilococos proliferan localmente o entran en el sistema linfático o el torrente circulatorio, podrían producirse complicaciones infecciosas graves tales como las asociadas a la bacteriemia por estafilococos. Las complicaciones asociadas a la bacteriemia por estafilococos incluyen el choque séptico, endocarditis, artritis, osteomielitis, neumonía y abscesos en diferentes órganos.
Los estafilococos incluyen tanto organismos coagulasa positivos que producen una coagulasa libre, como organismos coagulasa negativos que no producen esta coagulasa libre. Staphylococcus aureus es la forma más frecuente de estafilococo coagulasa positivo. S. aureus suele provocar la infección en un foco localizado, bien extravascular o intravascular, que finalmente podría acabar provocando una bacteriemia. S. aureus es también la principal causa de osteomielitis aguda y ocasiona infecciones de neumonía por estafilococos. Adicionalmente, S.
aureus es responsable de aproximadamente el 1-9% de los casos de meningitis bacteriana y del 10 al 15% de los abscesos cerebrales.
Hay al menos 21 especies conocidas de estafilococos que no expresan la coagulasa, entre ellos, S. epidermidis, S. saprophyticus, S. hominis, S. warneri, S. haemolyticus, S. saprophiticus, S. cohnii, S. xylosus, S. simulans y S. capitis. S. epidermidis es el que con más frecuencia provoca las infecciones asociadas a los dispositivos de acceso intravenoso y es el aislado más frecuente en las bacteriemias intrahospitalarias primarias. S. epidermidis también está asociado a la endocarditis por válvula protésica.
Los estafilococos son también una fuente habitual de infecciones bacterianas en los animales. Por ejemplo, la mastitis estafilocócica es un problema frecuente en los rumiantes entre ellos vacas, ovejas y cabras. La enfermedad se suele tratar con antibióticos para reducir la infección, pero el tratamiento es un procedimiento costoso y además 30 tiene por consecuencia una pérdida de producción de leche. Las vacunas más eficaces para el ganado que se han identificado hasta la fecha son las vacunas con S. aureus intacto y vivo administradas por vía subcutánea. La administración de las vacunas vivas, no obstante, lleva asociado el riesgo de infección y de reacciones de toxicidad. Por este motivo, muchos investigadores han intentado producir vacunas de S. aureus muertos y/o aislar los polisacáridos capsulares o los componentes de la pared celular que inducirán la inmunidad frente a S. aureus. Sin embargo, ninguno de estos intentos ha tenido éxito.
La patente internacional WO 00/03745 describe una vacuna de polisacárido para infecciones estafilocócicas.
En J. Infectious Diseases, vol.162, n.º 22, agosto 1990, páginas 435-441, Kojima Y. et al. describen un anticuerpo contra el polisacárido capsular/Adhesión que protege a los conejos contra la bacteriemia relacionada con el catéter debida a los estafilococos que no expresan la coagulasa.
En Infection and Immunity, vol. 65, n.º 10, 1997, páginas 4146-4151, Lee Jean C. et al. describen la eficacia protectora de los anticuerpos contra el polisacárido capsular de tipo 5 de Staphylococcus aureus en un modelo modificado de endocarditis en las ratas.
En Infection and Immunity, vol. 70, n.º 8, agosto de 2002, páginas 443-4440, Maria-Litran T. et al. describen las propiedades inmunoquímicas del polisacárido poli-N-acetil glucosamina de la superficie de los estafilococos.
La patente internacional WO 2004/043407 es un documento disponible bajo el Artículo 54 (3) EPC y describe los procedimientos y productos para el tratamiento de las infecciones por estafilococos.
La patente internacional WO 2004/043405 es un documento disponible bajo el Artículo 54 (3) EPC y describe la vacuna de polisacárido para las infecciones por estafilococos.
Compendio de la invención 50 La presente invención se refiere de forma general a la identificación y el uso de péptidos que se fijan a la poli-Nacetil glucosamina (PNAG) tal como la poli-N-acetil glucosamina (PNAG) estafilocócica y la PNAG poco acetilada o desacetilada (que de forma colectiva se denominan dPNAG en la presente memoria) . Estos péptidos se denominan en la presente memoria péptidos de fijación a la PNAG/dPNAG. El alcance de la presente invención queda definido mediante las reivindicaciones y cualquier información que no esté comprendida dentro de las reivindicaciones se da a conocer sólo con carácter informativo. En particular, la invención se refiere a los anticuerpos producidos por los hibridomas depositados en la ATCC el 21 de abril de 2004, con n.º de acceso PTA-5931 (F598) . La invención incluye anticuerpos (tales como anticuerpos monoclonales humanos) y fragmentos de anticuerpo. Una peculiaridad común de la invención descrita en la presente memoria es la capacidad para reconocer y fijarse a la PNAG y/o dPNAG estafilocócica de forma específica. Los péptidos de la invención también puede reconocer y fijarse a la PNAG y/o a la dPNAG expresada por otras cepas bacterianas. Una característica importante de algunos de los anticuerpos y fragmentos de anticuerpo proporcionados por la invención es su capacidad para mejorar la opsonización y la fagocitosis (a saber, opsonofagocitosis) de las cepas bacterianas, tales como las especies estafilocócicas, que expresan la PNAG.
Así pues, en un aspecto, la invención da a conocer una composición de acuerdo con la reivindicación 1.
Una serie de realizaciones están compartidas por éste y otros aspectos de la invención. Estas realizaciones se describirán una vez, pero se debe entender que se aplican igualmente a todos los aspectos de la invención.
En una realización, la CDR de fijación a la PNAG/dPNAG estafilocócica es una CDR3 de fijación a la PNAG/dPNAG
estafilocócica. La CDR3 de fijación a la PNAG/dPNAG estafilocócica puede comprender una secuencia de aminoácidos de una CDR3 de la cadena pesada seleccionada del grupo que consiste en SEQ ID n.º 9, SEQ ID n.º 15 y SEQ ID n.º 21, o puede comprender una secuencia de aminoácidos de una CDR3 de la cadena pesada procedente de un hibridoma depositado que tiene un n.º de acceso PTA-5931 en la ATCC. La CDR3 de fijación a la PNAG/dPNAG estafilocócica puede comprender una secuencia de aminoácidos de una CDR3 de la cadena ligera seleccionada del grupo que consiste en SEQ ID n.º 12, SEQ ID n.º 18 y SEQ ID n.º 24 o puede comprender una secuencia de aminoácidos de una CDR3 de la cadena ligera procedente de un hibridoma depositado que tiene el n.º de acceso PTA-5931 en la ATCC.
En otra realización, la CDR de fijación a la PNAG/dPNAG estafilocócica es una CDR2 de fijación a la PNAG/dPNAG estafilocócica. La CDR2 de fijación a la PNAG/dPNAG estafilocócica puede comprender una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID n.º 8, SEQ ID n.º 11, SEQ ID n.º 14, SEQ ID n.º 17, SEQ ID n.º 20 y SEQ ID n.º 23 o puede comprender una secuencia de aminoácidos de una CDR2 procedente de un hibridoma depositado que tiene el n.º de acceso PTA-5931 en la ATCC.
En otra realización, la CDR de fijación a la PNAG/dPNAG estafilocócica es una CDR1 de fijación a la PNAG/dPNAG estafilocócica. La CDR1 de fijación a la PNAG/dPNAG estafilocócica puede comprender una secuencia de aminoácidos seleccionada del grupo que consiste en SEQ ID n.º 7, SEQ ID n.º 10, SEQ ID n.º 13, SEQ ID n.º 16, SEQ ID n.º 19 y SEQ ID n.º 22 o puede comprender una secuencia de aminoácidos de una CDR1 procedente de un hibridoma depositado que tiene el n.º de acceso PTA-5931 en la ATCC.
En una realización, el péptido aislado comprende una secuencia de aminoácidos seleccionada del grupo que consiste en la SEQ ID n.º 1 o una secuencia de aminoácidos de una región variable de la cadena pesada procedente de un hibridoma depositado que tiene el n.º de acceso PTA-5931 en la ATCC.
En otra realización, el péptido aislado comprende una secuencia de aminoácidos... [Seguir leyendo]
Reivindicaciones:
1. Composición, que comprende un anticuerpo aislado o fragmento del mismo que se fija selectivamente a la poli-N-acetil glucosamina (PNAG/dPNAG) estafilocócica, en donde el anticuerpo aislado o el fragmento de anticuerpo comprende: 5 (a) una secuencia de aminoácidos de SEQ ID n.º 1 y una secuencia de aminoácidos de SEQ ID n.º 2.
2. Composición de acuerdo con la reivindicación 1, en donde el anticuerpo aislado o el fragmento de anticuerpo:
(a) es un anticuerpo monoclonal soluble e intacto;
(b) es un fragmento de anticuerpo aislado seleccionado del grupo que consiste en un fragmento F (ab') 2, un fragmento Fd y un fragmento Fab;
(c) estimula la opsonofagocitosis de las cepas bacterianas que expresan la PNAG; o (d) estimula la opsonofagocitosis de los estafilococos que expresan la PNAG.
3. Composición de acuerdo con la reivindicación 1, en donde
(a) los estafilococos que expresan la PNAG son S. aureus o S. epidermidis, o
(b) las cepas bacterianas que expresan la PNAG son E. coli, Yersinia pestis (Y. pestis) , Y. entercolitica,
Xanthomonas axonopodis (X. axonopodis) , Pseudomonas fluorescens (P. fluorescens) , Actinobacillus actinomycetemcomitans (A. actinomycetemcomitans) , A. pleuropneumoniae, Ralstonia solanacearum (R. solanacearum) , Bordetella pertussis (B. pertussis) , B. parapertussis o B. bronchiseptica, que expresan la PNAG.
4. Composición de acuerdo con la reivindicación 1, en donde el anticuerpo aislado está conjugado a un 20 marcador detectable.
5. Composición de acuerdo con la reivindicación 1, que además comprende un vehículo farmacéuticamente aceptable.
6. Composición de acuerdo con la reivindicación 5, en donde el anticuerpo aislado está
(a) presente en una cantidad eficaz para inhibir una infección de cepas bacterianas que expresan la PNAG; 25 (b) presente en una cantidad eficaz para inhibir una infección por estafilococos;
(c) presente en una cantidad eficaz para detectar cepas bacterianas que expresan la PNAG en un sujeto o de una muestra del mismo; o
(d) presente en una cantidad eficaz para detectar estafilococos en un sujeto o de una muestra del mismo.
7. Composición de acuerdo con la reivindicación 1, en donde el anticuerpo aislado 30 (a) se fija selectivamente a la PNAG estafilocócica, o (b) se fija selectivamente a la dPNAG estafilocócica.
8. Anticuerpo aislado para el uso en un procedimiento de detección de una cepa bacteriana que expresa la PNAG en un sujeto, que comprende determinar un nivel de fijación del análisis del anticuerpo aislado o de una variante funcionalmente equivalente del 35 mismo en un sujeto o en una muestra del sujeto, y comparar el nivel de fijación del análisis a un control,
en donde el anticuerpo aislado es el anticuerpo aislado de acuerdo con la reivindicación 1, y en donde un nivel de fijación del análisis que es mayor que el del control indica que en la muestra está presente una cepa bacteriana que expresa la PNAG.
9. Anticuerpo aislado para el uso de acuerdo con la reivindicación 8, en donde el procedimiento es un procedimiento para detectar estafilococos.
10. Anticuerpo aislado para el uso de acuerdo con la reivindicación 8 o 9, en donde el anticuerpo aislado está conjugado a un marcador detectable.
11. Anticuerpo aislado para el uso de acuerdo con la reivindicación 8 o 9, en donde el nivel de fijación del análisis se mide in vitro.
12. Anticuerpo aislado para el uso en el tratamiento de un sujeto que tiene, o que corre el riesgo de padecer, una infección por una cepa bacteriana que expresa la PNAG, en donde el anticuerpo aislado es el anticuerpo aislado de acuerdo con la reivindicación 1.
13. Anticuerpo aislado para el uso de acuerdo con la reivindicación 12, en donde el procedimiento es un procediiento para el tratamiento de un sujeto que tiene, o que corre el riesgo de padecer, una infección por estafilococos que comprende
administrar a un sujeto que necesita tal tratamiento un anticuerpo aislado de acuerdo con la reivindicación 1 en una cantidad eficaz para inhibir una infección estafilocócica.
14. Anticuerpo aislado para el uso de acuerdo con la reivindicación 12 o 13, en donde el sujeto corre el riesgo de padecer
(a) una infección por estafilococos, o
(b) una infección por E. coli, Yersinia pestis (Y. pestis) , Y. entercolitica, Xanthomonas axonopodis (X. axonopodis) , Pseudomonas fluorescens (P. fluorescens) , Actinobacillus actinomycetemcomitans (A. actinomycetemcomitans) , A. pleuropneumoniae, Bordetella pertussis (B. pertussis) , B. parapertussis o B. bronchiseptica.
15. Anticuerpo aislado para el uso de acuerdo con la reivindicación 12 o 13, en donde el anticuerpo aislado está conjugado a un agente citotóxico.
16. Anticuerpo de fijación a la PNAG/dPNAG, que es el anticuerpo aislado de acuerdo con la reivindicación 1, para el uso en el tratamiento de una infección por una cepa bacteriana que expresa la PNAG, en donde dicho anticuerpo de fijación a la PNAG/dPNAG se administra a un sujeto que lo necesita en una cantidad eficaz para tratar la infección y reducir la carga bacteriana del sujeto al menos al 50% en el plazo de 4 horas tras la exposición a una bacteria que expresa la PNAG.
17. Anticuerpo de fijación a la PNAG/dPNAG para el uso de acuerdo con la reivindicación 16, para el tratamiento de una infección por estafilococos.
18. Anticuerpo de fijación a la PNAG/dPNAG para el uso de acuerdo con la reivindicación 16 o 17, en donde el anticuerpo de fijación a la PNAG/dPNAG se administra antes de la exposición a la bacteria.
19. Anticuerpo de fijación a la PNAG/dPNAG para el uso de acuerdo con la reivindicación 16 o 17, en donde el anticuerpo de fijación a la PNAG/dPNAG
(a) reduce la carga bacteriana en un sujeto al menos el 60% en el plazo de 4 horas tras la exposición a la bacteria,
(b) reduce la carga bacteriana en un sujeto al menos el 50% en el plazo de 2 horas tras la exposición a la bacteria, o
(c) reduce la carga bacteriana en un sujeto al menos el 60% en el plazo de 2 horas tras la exposición a la bacteria.
20. Composición de acuerdo con la reivindicación 6 o un anticuerpo o un anticuerpo de fijación para el uso de acuerdo con cualquiera de las reivindicaciones 8, 12 o 16, en donde las cepas bacterianas que expresan la PNAG se seleccionan del grupo que consiste en E. coli, Yersinia pestis (Y. pestis) , Y. entercolitica, Xanthomonas axonopodis (X. axonopodis) , Pseudomonas fluorescens (P. fluorescens) , Actinobacillus actinomycetemcomitans (A. actinomycetemcomitans) , A. pleuropneumoniae, Ralstonia solanacearum (R. solanacearum) , Bordetella pertussis (B. pertussis) , B. parapertussis y B. bronchiseptica.
21. Anticuerpo aislado para el uso de acuerdo con la reivindicación 9, en donde los estafilococos son S. aureus o
S. epidermidis.
22. Composición, que comprende:
una variante aislada funcionalmente equivalente de un anticuerpo o fragmento del mismo que se fija selectivamente a la poli-N-acetil glucosamina (PNAG/dPNAG) estafilocócica,
en donde la variante comprende las secuencias aminoacídicas que tienen una identidad de aminoácidos de al menos el 80% con la SEQ ID n.º 1 y con la SEQ ID n.º 2, respectivamente.
23. Composición de acuerdo con la reivindicación 22,
en donde la variante funcionalmente equivalente comprende las secuencias aminoacídicas que tienen una identidad de aminoácidos de al menos el 80% con la SEQ ID n.º 9 y con la SEQ ID n.º 12, respectivamente.
24. Composición de acuerdo con la reivindicación 22, en donde la variante funcionalmente equivalente comprende las secuencias aminoacídicas que tienen una identidad de aminoácidos de al menos el 80% con la SEQ
ID n.º 7 y con la SEQ ID n.º 10, respectivamente; o las secuencias aminoacídicas que tienen una identidad de aminoácidos de al menos el 80% con la SEQ ID n.º 8 y con la SEQ ID n.º 11, respectivamente.
25. Anticuerpo aislado o un fragmento del mismo que se fija selectivamente a la poli-N-acetil glucosamina (PNAG/dPNAG) estafilocócica que comprende:
una región de la cadena pesada que comprende las secuencias CDR1 de la cadena pesada, CDR2 de la cadena pesada y CDR3 de la cadena pesada que comprenden las secuencias aminoacídicas de la SEQ ID n.º 7, de la SEQ ID n.º 8 y de la SEQ ID n.º 9, respectivamente; y
una región de la cadena ligera que comprende las secuencias CDR1 de la cadena ligera, CDR2 de la cadena ligera y CDR3 de la cadena ligera que comprenden las secuencias aminoacídicas de la SEQ ID n.º 10, de la SEQ ID n.º 11 y de la SEQ ID n.º 12, respectivamente.
26. Ácido nucleico que codifica el anticuerpo aislado o un fragmento del mismo que se fija selectivamente a la poli-N-acetil glucosamina (PNAG/dPNAG) estafilocócica tal y como está definido en cualquiera de las reivindicaciones anteriores.
Patentes similares o relacionadas:
 Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
Métodos para producir proteínas bicatenarias en bacterias, del 29 de Julio de 2020, de GENENTECH, INC.: Un método para producir un receptor de linfocitos T monoclonal de movilización inmunitaria contra el cáncer (ImmTAC) que comprende una cadena alfa del receptor de linfocitos […]
 Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Animales no humanos que tienen un locus de cadena ligera lambda de inmunoglobulina modificado por ingeniería, del 29 de Julio de 2020, de REGENERON PHARMACEUTICALS, INC.: Un roedor cuyo genoma de la línea germinal comprende un locus de cadena ligera λ de inmunoglobulina endógeno que comprende:
(a) uno o más segmentos […]
Composiciones farmacéuticas que contienen una leucocidina E mutada, del 22 de Julio de 2020, de NEW YORK UNIVERSITY: Una composición que comprende: una proteína Leucocidina E (LukE) aislada que comprende la secuencia de aminoácidos de la SEQ ID NO: 4, o un polipéptido […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]
Proteínas y péptidos modificados, del 24 de Junio de 2020, de GLAXO GROUP LIMITED: Un dominio variable de inmunoglobulina único, que se une a TNFR1 y que se selecciona de cualquiera de las siguientes secuencias de aminoácidos: (a) DOM1h-131-206 caracterizada […]
Métodos para purificar una proteína objetivo de una o más impurezas en una muestra, del 17 de Junio de 2020, de EMD Millipore Corporation: Un metodo para purificar una proteina objetivo que contiene una region Fc de una o mas impurezas en una muestra, el metodo comprende las etapas de: a) poner en contacto […]
Dominios variables de inmunoglobulina, del 10 de Junio de 2020, de Ablynx NV: Dominio variable individual de inmunoglobulina de cadena pesada (ISVD), en que el residuo aminoacídico en la posición 89 es L y el residuo […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]