Pentamicina altamente pura.
Pentamicina en una pureza química que supera el 96%.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2009/002054.
Solicitante: Lumavita AG.
Nacionalidad solicitante: Suiza.
Dirección: Engelgasse 77 4052 Basel SUIZA.
Inventor/es: REUTER, KARL, KRIMMER, DIETER, MEIER,VIKTOR, STOLZ,FLORIAN, WINNINPS,CEES.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H17/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
- C12P17/08 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 17/00 Preparación de compuestos heterocíclicos que contienen O, N, S, Se o Te como únicos heteroátomos del ciclo (C12P 13/04 - C12P 13/24 tienen prioridad). › que contienen un heterociclo de al menos siete miembros, p. ej. zearalenona, agliconas macrólidas.
PDF original: ES-2441601_T3.pdf
Fragmento de la descripción:
Pentamicina altamente pura.
Campo de la invención La invención se refiere a la pentamicina altamente pura, a determinados polimorfos y solvatos de pentamicina, a procedimientos para su preparación y a un procedimiento para disminuir la tasa de degradación de pentamicina pura en más del 95%.
Antecedentes de la invención La pentamicina, al igual que la anfotericina B y la nistatina A1, pertenece a la clase de antibióticos macrólidos poliénicos que presentan actividad antifúngica. La pentamicina puede obtenerse de fuentes naturales, por ejemplo puede aislarse de determinadas cepas de Streptomyces, como el micelio del actinomiceto Streptomyces penticus tal como se describe por S. Umezawa y Y. Tanaka en J. Antibiotics, Ser. A, vol. XI, n.o 1, páginas 26 a 29 (1958) , o del Streptomyces roseo luteus (NRRL 2776, NCIB 8984) tal como se describe en la patente británica 884711 concedida a Glaxo. Dicha patente se refiere a la producción del antibiótico lagosina que se ha mostrado en el artículo de Pandey et al. mencionado a continuación en J. Antibiotics vol. XXXV n.o 8, páginas 988-996 (1982) que es idéntico a fungicromina y cogomicina. Se afirma en dicha patente británica, página 2, columna derecha, líneas 48-49, que la lagosina, tanto como un sólido como en disolución, es sensible a la luz.
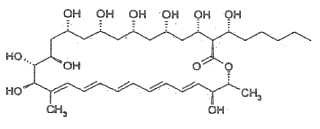
La configuración absoluta de pentamicina (= fungicromina) se determinó mediante comparación espectral de los productos de degradación y síntesis parcial por T. Oishi, Pure & Appl. Chem., vol. 61, n.o 3, págs. 427-430 (1989) . Según un análisis de rayos X publicado por Y. Igarashi et al. en J. Antibiot. vol. 58, n.o 8, págs. 523-525 (2005) pentamicina presenta la siguiente fórmula Tal como se establece por ejemplo en la página 478, columna izquierda, de un artículo de David R. Worthen et al., Drug Development and Industrial Pharmacy, vol. 27 (4) , 277-286 (2001) “la producción y purificación de antifúngicos poliénicos se frustran por su inestabilidad química inherente. Los polienos normalmente poseen una o varias funcionalidades estructurales potencialmente inestables, incluyendo hemiacetales, acetales y ésteres hidrolizables, así como sistemas de polieno conjugados vulnerables a la oxidación (19) . Por tanto, todos los antifúngicos poliénicos, hasta cierto punto, se someten a inactivación o degradación directa por las condiciones encontradas de manera rutinaria durante su producción y recuperación del cultivo en masa. Las más notable de estas condiciones potencialmente degradativas incluyen humedad, temperatura elevada, oxígeno atmosférico, metales polivalentes y exposición a la luz (19, 20) .” Las referencias 19 y 20 mencionadas en dicho artículo son (19) I. M. Teresin, Poliene Antibiotics-Present and Future; University of Tokyo Press: Tokio, 1976; 122-123, y (20) K. Thoma y N. Kubler, Photostability of antifungal agents. 2. Photostability of polyene antibiotics. Pharmazie vol. 52, 294-302 (1997) .
El artículo de Worthen mencionado anteriormente continúa afirmando en la página 478, columna izquierda, que “lo que complica adicionalmente la purificación del polieno es el hecho de que prácticamente todos los aislados de polieno en bruto de Streptomyces contienen varias isoformas distintas, aunque fisicoquímicamente similares, pudiendo ser sólo una de ellas deseable para la utilización clínica.”
Por lo tanto, no resulta sorprendente que a la pentamicina también se le dieran otros tres nombres, es decir lagosina, fungicromina y cogomicina porque inicialmente se pensaba que eran sustancias diferentes. Tal como afirman R. C. Pandey et al., J. Antibiotics vol. XXXV n.o 8, páginas 988-996 (1982) en el resumen “Se muestra por … que los tres antibióticos macrólidos poliénicos, fungicromina, lagosina y cogomicina, que se ha descrito anteriormente que presentan algunas diferencias estereoquímicas en uno o más centros, son idénticos en todos los aspectos, incluyendo los aspectos estereoquímicos. Las diferencias observadas antes en sus propiedades se han atribuido ahora a cantidades variables de impurezas que pueden separarse mediante cromatografía de líquidos de alta resolución. Los tres antibióticos contienen un componente mayoritario y varios componentes minoritarios” (se añade énfasis) . En la tabla I en la página 988 de dicho artículo de Pandey, los puntos de fusión, notificados de la bibliografía facilitados para fungicromina, lagosina y cogomicina oscilan entre 190 y 240ºC.
El Índice Merck (12ª edición) en la entrada n.o 4312 en la página 727 menciona que el punto de fusión de fungicromina es de 157-162ºC (descomposición) .
El objeto del artículo de Pandey es la comparación fisicoquímica y biológica de dichos tres antibióticos macrólidos, no proporcionar pentamicina pura en más del 95%. Tal como se afirma en la página 995 del mismo al comienzo de la “Discusión”, no fue posible eliminar todos los componentes minoritarios ni siquiera tras purificación de CCD (distribución a contracorriente) repetida. En la tabla 2 en la página 990, se facilita que los puntos de fusión de fungicromina, lagosina y cogomicina así purificados oscilan entre 157 y 165ºC. En el segundo párrafo de dicha “Discusión” se afirma con respecto a la HPLC que la separación óptima de fungicromina, lagosina y cogomicina de impurezas se lograba utilizando metanol-agua (60:40) como fase móvil. Cuando se reducía la razón de metanol con respecto a agua, los picos devenían muy anchos y el tiempo de retención aumentaba; un aumento en la razón reducía el tiempo de retención, dificultando la separación. Tal como resulta evidente a partir de la columna derecha de la tabla 2 del artículo de Pandey, el tiempo de retención de fungicromina, lagosina y cogomicina es de 6, 00 minutos en una HPLC en las condiciones descritas de manera idéntica en la página 992, líneas 3 y 4, página 990, nota al pie de página 4 a la tabla 2, y el antepenúltimo párrafo en la página 989, es decir utilizando una columna de fase inversa C18 μBondapak (DI 3, 9 mm x 30 cm) , detector UV (357 nm) , sistema de disolventes de metanol - agua (60:40) y velocidad de flujo de 1, 5 ml/minuto.
Se ordenó en el contexto de la presente invención un ensayo realizado por una tercera parte en el que se intentó purificar pentamicina en bruto, es decir pura en aproximadamente el 92% en las condiciones descritas en el artículo de Pandey. Una vez que se había evaporado la fracción de eluato que contenía pentamicina y vuelto a examinar en las mismas condiciones de HPCL que se utilizaron anteriormente, sólo se aisló pentamicina con una pureza de aproximadamente el 90%. El cromatograma de HPLC de la pentamicina aislada reveló un 9, 5% de una nueva impureza que no estaba presente en la pentamicina en bruto. De acuerdo con este hallazgo está que no se afirma en ninguna parte del artículo de Pandey que la pentamicina se hubiera aislado tras separación por HPLC o que se hubiera cristalizado. Los únicos puntos de fusión (¡que oscilan desde 157 hasta 240ºC!) facilitados en el artículo de Pandey son los que provienen de fuentes bibliográficas en la tabla 1 y los que provienen de la distribución a contracorriente en la tabla 2. En conclusión, las condiciones de HPLC dadas a conocer en el artículo de Pandey no pueden utilizarse para obtener pentamicina pura en más del 95% tras el aislamiento.
Debe apreciarse que la pentamicina es una molécula comparativamente grande y estructuralmente complicada que contiene 12 centros asimétricos, de modo que se encuentran 212 (= 4096) estereoisómeros. Además, la pentamicina contiene 5 dobles enlaces que podrían someterse a isomerización cis-trans. La síntesis química total del correcto de los posibles 4096 estereoisómeros se prolongaría años, siendo una invención en sí misma y, desde un punto de vista económico, sería demasiado costosa en comparación con la biosíntesis realizada por las cepas de Streptomyces mencionada anteriormente, teniendo en cuenta que la estabilidad de la pentamicina es muy delicada.
La delicada estabilidad de la pentamicina es evidente por ejemplo a partir de R. W. Rickards et al., J. Antibiotics vol. XXIII, n.o 12, páginas 603-611, que describe la autooxidación aérea de lagosina en disolución de metanol mediante un procedimiento de adición de radicales que pueden inhibirse mediante antioxidantes. Según Rickards et al. los principales productos de autooxidación primaria de lagosina son determinados epóxidos, mientras que la autooxidación prolongada conduce a productos de oxidación superiores y en última instancia a materiales poliméricos. De pleno acuerdo con las afirmaciones en el artículo de Worthen mencionado anteriormente, Rickards et al. afirman en la página... [Seguir leyendo]
Reivindicaciones:
1. Pentamicina en una pureza química que supera el 96%.
2. Pentamicina según la reivindicación 1 en forma de polimorfo A en una pureza química que supera el 96%, caracterizada porque presenta los valores de 2 theta siguientes, ± aproximadamente 0, 2º, de las líneas más intensas en el espectro de difracción de rayos X de polvo, proporcionándose las intensidades relativas únicamente como indicación aproximada:
3. Pentamicina en forma de un solvato con un compuesto heterocíclico seleccionado de entre morfolina, Nmetilpirrolidona y N-etilpirrolidona.
ángulo 2 theta intensidad relativa ángulo 2 theta intensidad relativa ángulo 2 theta intensidad relativa ángulo 2 theta intensidad relativa
2, 22 100 7, 29 33 9, 25 15 19, 78 51
20, 17 52 20, 62 25 21, 24 17
4. Pentamicina según la reivindicación 3 en forma de un solvato de morfolina. 15
5. Utilización de un solvato de pentamicina con un compuesto heterocíclico seleccionado de entre morfolina, Nmetilpirrolidona y N-etilpirrolidona para la purificación química de la pentamicina.
6. Procedimiento para la purificación de pentamicina hasta una pureza química que supera el 95% transformando la
pentamicina en una pureza química inferior a 93% en un solvato adecuado con un compuesto heterocíclico seleccionado de entre morfolina, N-metilpirrolidona y N-etilpirrolidona, purificando dicho solvato mediante cristalización en metanol o etanol y liberando la pentamicina del solvato.
7. Procedimiento según la reivindicación 6, en el que el solvato es un solvato de morfolina. 25
8. Procedimiento según la reivindicación 6, en el que la pentamicina se libera del solvato mediante agitación prolongada en metanol o etanol.
9. Procedimiento según la reivindicación 7, en el que la pentamicina se libera del solvato mediante agitación 30 prolongada en metanol o etanol.
10. Procedimiento según cualquiera de las reivindicaciones 6 a 9, llevado a cabo en presencia de un antioxidante adecuado.
11. Procedimiento para disminuir significativamente la tasa de degradación de la pentamicina en una pureza que supera el 95% transformándola en su polimorfo A en una pureza química que supera el 95%, estando dicho polimorfo A caracterizado porque presenta los valores de 2 theta siguientes, ± aproximadamente 0, 2º, de las líneas más intensas en el espectro de difracción de rayos X de polvo, proporcionándose las intensidades relativas únicamente como indicación aproximada:
ángulo 2 theta intensidad relativa ángulo 2 theta intensidad relativa ángulo 2 theta intensidad relativa ángulo 2 theta intensidad relativa
2, 22 100 7, 29 33 9, 25 15 19, 78 51
20, 17 52 20, 62 25 21, 24 17
y en el que la transformación en el polimorfo A se efectúa mediante cristalización a partir de una disolución de pentamicina pura en más de 95% en dimetilsulfóxido tras añadir acetato de etilo.
Patentes similares o relacionadas:
Polimorfos de 20,23-piperidinil-5-O-micaminosiltilonolida, del 20 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una forma cristalina de 20,23-dipiperidinil-5-O-micaminosil-tilonolida que tiene al menos una de las siguientes características: un espectro FT-Raman que comprende […]
Derivados de azitromicina con propiedades de potenciación de la barrera epitelial, del 13 de Mayo de 2020, de EpiEndo Pharmaceuticals ehf: Un compuesto de acuerdo con la fórmula (I) **(Ver fórmula)** En donde R1 es OH; R2 es de acuerdo con la fórmula (III) **(Ver […]
Derivados de avermectina B1 que tienen un sustituyente alcoximetilo en la posición 4'''' o 4'', del 17 de Febrero de 2020, de Boehringer Ingelheim Animal Health USA Inc: Compuesto de fórmula**Fórmula** en la que n es 0 o 1; A-B es -CH=CH; R1 es sec-butilo o isopropilo; R2 es CH2CH3, p-ClC6H4, CH2(CH2)2N3 […]
Levoisovalerilespiramicina III y preparaciones, métodos de preparación y utilizaciones de la misma, del 1 de Enero de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto cristalino de levoisovalerilespiramicina III, en el que, la fórmula estructural química de la levoisovalerilespiramicina III se representa como la fórmula […]
 Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Forma cristalina de levoisovalerilespiramicina II y preparaciones, procedimientos de preparación y utilizaciones de la misma, del 7 de Agosto de 2019, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto de levoisovalerilespiramicina II, en el que, la fórmula estructural química de la levoisovalerilespiramicina II se representa como la fórmula (II), en condiciones […]
Derivados de la anfotericina B con índice terapéutico mejorado, del 20 de Septiembre de 2018, de The Board of Trustees of the University of Illionis: Un compuesto, o una sal farmacéuticamente aceptable del mismo, el compuesto que se selecciona de**Fórmula**
Procedimientos para tratar enfermedades gastrointestinales, del 11 de Abril de 2018, de Cempra Pharmaceuticals, Inc: Una cantidad terapéuticamente efectiva de un compuesto de fórmula **Fórmula** o una sal farmacéuticamente aceptable del mismo, donde: R10 es hidrógeno […]