Nuevos polimorfos de lopinavir.
Un procedimiento para la preparación de solvato de ciclohexano de lopinavir,
caracterizado por un difractograma de polvo de rayos X con picos expresados como posiciones de ángulo 2θ a aproximadamente 4,9; 7,4; 13,4; 14,6; 17,5; 18,9 y 23,8 ± 0,2 grados, que comprende:
a. disolver lopinavir en un disolvente orgánico;
b. retirar el disolvente de la disolución obtenida en la etapa (a) para obtener un residuo.
c. poner en suspensión el residuo obtenido en la etapa (b) con disolvente ciclohexano y
d. aislar solvato de ciclohexano de lopinavir.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IN2009/000083.
Solicitante: Hetero Research Foundation.
Nacionalidad solicitante: India.
Dirección: Plot No. B-80&81 A.P.I.E., Balanagar Hyderabad 500 018, Andhrapradesh INDIA.
Inventor/es: PARTHASARADHI REDDY,BANDI, MURALIDHARA,REDDY,DASARI, RATHNAKAR REDDY,Kura, RAJI REDDY,Rapolu, SUBASH CHANDER REDDY,kesireddy.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07D239/10 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07D COMPUESTOS HETEROCICLICOS (Compuestos macromoleculares C08). › C07D 239/00 Compuestos heterocíclicos que contienen ciclos de diazina-1,3 o diazina-1,3 hidrogenada. › Atomos de oxígeno o azufre.
PDF original: ES-2459301_T3.pdf
Fragmento de la descripción:
Nuevos polimorfos de lopinavir
Campo de la invención La presente invención proporciona un procedimiento para preparar una nueva forma de solvato de ciclohexano de lopinavir. La presente invención también proporciona un procedimiento para preparar una nueva forma cristalina desolvatada de lopinavir.
Antecedentes de la invención Los inhibidores de proteasa del virus de la inmunodeficiencia humana (VIH) se han homologado para uso en el tratamiento de infección por VIH durante varios años. Un inhibidor de la proteasa de VIH eficaz en particular es (2S, 3S, 5S) -2- (2, 6-dimetilfenoxiacetil) amino-3-hidroxi-5- (2-1-tetrahidropirimid-2-onil) -3-metilbutanoil) amino-1, 6difenilhexano, también conocido como Lopinavir. El lopinavir se representa por la siguiente estructura:
Se sabe que lopinavir presenta la capacidad de inhibir la proteasa de VIH y la infección por VIH. Lopinavir es particularmente eficaz para la inhibición de la proteasa de VIH y para la inhibición de infección por VIH cuando se coadministra con Ritonavir.
El lopinavir puede ser preparado usando los procedimientos descritos en la Patente de EE.UU. Nº 5.914.332. Esta patente también describe un procedimiento para la preparación de lopinavir amorfo.
Las composiciones farmacéuticas que comprenden lopinavir o una sal farmacéuticamente aceptable del mismo se describen en la Patente de EE.UU. Nº 5.914.332.
El polimorfismo se define como "la capacidad de una sustancia para existir como dos o más fases cristalinas con diferente disposición y /o conformaciones de las moléculas en la red cristalina. Así, en el sentido estricto, polimorfos son diferentes formas cristalinas de la misma sustancia pura en que las moléculas tienen diferentes disposiciones y /
o diferentes configuraciones de las moléculas". Los diferentes polimorfos pueden diferir en sus propiedades físicas tales como punto de fusión, solubilidad, patrones de difracción de rayos X, etc. Aunque esas diferencias desaparecen una vez que se disuelve el compuesto, pueden influir de manera apreciable en las propiedades farmacéuticamente relevantes de la forma sólida, tales como propiedades de manipulación, velocidad de disolución y estabilidad. Dichas propiedades pueden influir de manera significativa en el tratamiento, tiempo de durabilidad y aceptación comercial de un polimorfo. Es importante por lo tanto investigar todas las formas sólidas de un fármaco, incluyendo todas las formas polimórficas y determinar las propiedades de estabilidad, disolución y flujo de cada forma polimórfica. Las formas polimórficas de un compuesto se pueden distinguir en el laboratorio por métodos analíticos tales como difracción de rayos X (XRD) , Calorimetría Diferencial de Barrido (DSC) y Espectroscopía Infrarroja (IR) (todas por sus siglas en inglés) .
El medio disolvente y el modo de cristalización desempeñan una función muy importante en la obtención de una forma cristalina sobre la otra.
Lopinavir puede existir en las diferentes formas polimórficas, que difieren entre sí en términos de estabilidad, propiedades físicas, datos espectrales y métodos de preparación.
La publicación de patente internacional WO Nº 2001/74787 (de ahora en adelante referida como la publicación de patente 787) describió diversas formas polimórficas de lopinavir y procedimientos para su preparación. La Publicación describió la formación de varias formas polimórficas de lopinavir, que se designaron forma cristalina de lopinavir de Tipo I hidratada, Tipo I más hidratada, hemisolvato de isopropanol de Tipo II, solvato de isopropanol de Tipo II, hemisolvato de acetato de etilo de Tipo II, solvato de acetato de etilo de Tipo II, hemisolvato de cloroformo de
Tipo II, acetato de etilo solvatado de Tipo III, desolvatado de Tipo III y no solvatado de Tipo IV.
Según la publicación de patente 787, la forma cristalina hidratada de Tipo I de lopinavir (caracterizada por un patrón de difracción de polvo de rayos X con picos expresados como 2! a aproximadamente 7, 25; 8, 53; 10, 46; 11, 05; 11, 71; 14, 76; 15, 30; 16, 67; 17, 32; 19, 10; 19, 57; 21, 24; 21, 84 y 22, 46 ± 0, 1 grados) se puede preparar por cristalización de lopinavir de disolución o suspensión en agua o de disoluciones en mezclas de agua y disolventes orgánicos miscibles en agua tales como metanol, etanol y acetonitrilo.
Según la publicación de patente 787, la forma cristalina más hidratada de Tipo I de lopinavir (caracterizada por un patrón de difracción de polvo de rayos X con picos expresados como 2! a aproximadamente 3, 89; 6, 55; 7, 76; 8, 55; 9, 70; 10, 56; 14, 76; 15, 57; 18, 30; 18, 95 y 22, 74 ± 0, 1 grados) se puede preparar por cristalización de lopinavir hidratado de una disolución caliente en una mezcla de agua y etanol, seguido por exposición prolongada a un entorno de humedad relativa elevada.
Según la publicación de patente 787, la forma cristalina solvatada de acetato de etilo de Tipo III de lopinavir (caracterizada por un patrón de difracción de polvo de rayos X que tiene picos expresados como 2! a aproximadamente 4, 85; 6, 52; 7, 32; 12, 82; 12, 96; 16, 49 y 19, 31 ± 0, 1 grados) se puede preparar por adición lenta de un heptano a una disolución calentada de lopinavir en el acetato de etilo, induciendo de ese modo cristalización y aislamiento después por filtración.
Según la publicación de patente 787, la forma cristalina desolvatada de Tipo III de lopinavir (caracterizada por un patrón de difracción de polvo de rayos X que tiene picos expresados como 2! a aproximadamente 4, 85; 6, 39; 7, 32; 8, 81; 12, 20; 12, 81; 14, 77; 16, 45 y 17, 70 ± 0, 1 grados y el termograma DSC con una endoterma de fusión con comienzo a 95 grados C y pico a 98 grados C) se puede preparar por cristalización de acetonitrilo.
Según la publicación de patente 787, la forma cristalina no solvatada de Tipo IV de lopinavir (caracterizada por un patrón de difracción de polvo de rayos X que tiene picos expresados como 2! a aproximadamente 6, 85; 9, 14; 12, 88; 15, 09; 17, 74; 18, 01 y 18, 53 ± 0, 1 grados y el termograma DSC con una endoterma de fusión con comienzo a 117 grados C y pico a 122 grados C) se puede preparar de acetonitrilo por enfriamiento lento y evaporación lenta de una disolución saturada o por exposición de lopinavir amorfo a una atmósfera de acetonitrilo.
La publicación de patente internacional WO Nº 2009/004653 describe un procedimiento para preparar una forma amoría de lopinavir.
Se ha descubierto una nueva forma cristalina desolvatada estable de lopinavir y solvato de ciclohexano de lopinavir.
Un objeto de la presente invención es proporcionar un procedimiento para preparar una nueva forma de solvato de ciclohexano de lopinavir.
Según otro objeto de la presente invención se proporciona un procedimiento para preparar una nueva forma cristalina desolvatada de lopinavir.
Sumario de la invención El solvato de ciclohexano de lopinavir se caracteriza por picos en el espectro de difracción de rayos X de polvo que tiene posiciones de ángulo 2! a aproximadamente 4, 9; 7, 4; 13, 4; 14, 6; 17, 5; 18, 9 y 23, 8 ± 0, 2 grados.
Según un aspecto de la presente invención, se proporciona un procedimiento para preparar solvato de ciclohexano de lopinavir que comprende:
a) disolver lopinavir en un disolvente orgánico;
b) retirar el disolvente de la disolución obtenida en la etapa (a) para obtener un residuo.
c) poner en suspensión el residuo obtenido en la etapa (b) con disolvente ciclohexano y
d) aislar solvato de ciclohexano de lopinavir.
La forma cristalina desolvatada de lopinavir denominada como forma H1 se caracteriza por picos en el espectro de difracción de rayos X de polvo con posiciones de ángulo 2! a aproximadamente 5, 6; 8, 6; 13, 8; 14, 3; 19, 2 y 19, 5 ± 0, 2 grados.
Según otro aspecto de la presente invención, se proporciona un procedimiento para la preparación de forma cristalina desolvatada de lopinavir H1, que comprende calentar solvato de ciclohexano de lopinavir a por encima de 80 grados C.
Descripción detallada de la invención El difractograma de rayos X de polvo (PXRD, por sus siglas en inglés) de solvato de ciclohexano de lopinavir se
muestra en la figura 1.
Según un aspecto de la presente invención, se proporciona un procedimiento para preparar solvato de ciclohexano de lopinavir que comprende:
a) disolver lopinavir en un disolvente orgánico;
b) retirar el disolvente de la disolución obtenida en la etapa (a) para obtener un residuo.
c) poner en suspensión el residuo obtenido en la etapa (b) con disolvente ciclohexano y
d) aislar solvato de ciclohexano de... [Seguir leyendo]
Reivindicaciones:
1. Un procedimiento para la preparación de solvato de ciclohexano de lopinavir, caracterizado por un difractograma de polvo de rayos X con picos expresados como posiciones de ángulo 2! a aproximadamente 4, 9; 7, 4; 13, 4; 14, 6; 17, 5; 18, 9 y 23, 8 ± 0, 2 grados, que comprende:
a. disolver lopinavir en un disolvente orgánico;
b. retirar el disolvente de la disolución obtenida en la etapa (a) para obtener un residuo.
c. poner en suspensión el residuo obtenido en la etapa (b) con disolvente ciclohexano y
d. aislar solvato de ciclohexano de lopinavir.
2. El procedimiento según la reivindicación 1, en el que el disolvente orgánico usado en la etapa (a) es un disolvente 10 o mezcla de disolventes seleccionados de: un disolvente clorado, un disolvente alcohólico y un disolvente cetónico.
3. El procedimiento según la reivindicación 2, en el que el disolvente orgánico usado en la etapa (a) se selecciona de: diclorometano, metanol, etanol y acetona.
4. El procedimiento según la reivindicación 2, en el que el disolvente orgánico usado en la etapa (a) es diclorometano.
5. El procedimiento según la reivindicación 1, en el que la suspensión en la etapa (c) se realiza a temperatura ambiente.
6. El procedimiento según la reivindicación 1, en el que el lopinavir usado está en la forma de lopinavir hidratada, no solvatada, amoría, desolvatada o solvatada.
7. El procedimiento según la reivindicación 6, en el que el lopinavir usado está en la forma de: forma amoría de
lopinavir, forma cristalina de lopinavir hidratada de tipo I, forma cristalina de lopinavir más hidratada de tipo I, forma cristalina de lopinavir de acetato de etilo solvatada de tipo III, forma cristalina de lopinavir desolvatada de tipo III y forma cristalina de lopinavir no solvatada de tipo IV.
8. Un procedimiento para la preparación de la forma cristalina desolvatada de lopinavir H1 con un difractograma de polvo de rayos X con picos expresados como posiciones del ángulo 2! a aproximadamente 5, 6; 8, 6; 13, 8; 14, 3; 19, 2 25 y 19, 5 ± 0, 2 grados, que comprende calentar solvato de ciclohexano de lopinavir a por encima de 80 grados C.
9. El procedimiento según la reivindicación 8, en el que el calentamiento se realiza a aproximadamente 80 grados C a 120 grados C.
Patentes similares o relacionadas:
Compuestos de carboxamida y su uso como inhibidores de calpaína, del 15 de Febrero de 2017, de AbbVie Deutschland GmbH & Co KG: Un compuesto de carboxamida de fórmula I**Fórmula** donde indica un enlace sencillo; R1 es hidrógeno, alquilo C1-C10, alquenilo C2-C10, alquinilo […]
N,N''-diariltioureas y N,N''-diarilureas cíclicas como antagonistas del receptor de andrógenos, agente anticanceroso, método para producirlo y usarlo, del 21 de Diciembre de 2016, de R-Pharm Overseas Inc: Compuestos que son N,N'-diariltioureas y N,N'-diarilureas cíclicas de fórmula general 1.2, sus isómeros ópticos (R) y (S), y sus sales farmacéuticamente aceptables, **Fórmula** en […]
Método mejorado para la fabricación de un inhibidor de la dipeptidil peptidasa-IV y de un intermedio, del 24 de Febrero de 2016, de Dong-A ST Co., Ltd: Un método para fabricar un inhibidor de la dipeptidil peptidasa-IV representado por la Fórmula Química 1, como se muestra en la siguiente Fórmula de Reacción […]
Derivados de triazinona y de diazinona útiles como inhibidores de Hsp90, del 8 de Febrero de 2013, de SYNTA PHARMACEUTICALS CORPORATION: Un compuesto representado por una fórmula estructural seleccionada de: **Fórmula** o un tautómero o sal farmacéuticamente aceptable del mismo, […]
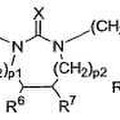 Derivados de urea cíclicos sustituidos y su utilización como moduladores del receptor vainilloide 1, del 20 de Junio de 2012, de GRUNENTHAL GMBH: Derivados de urea cíclicos sustituidos de fórmula general I, **Fórmula**
donde
X representa O, S o N-C≡N;
m es igual a 1 o 2;
n es igual a 1 o 2;
p1 y p2 […]
Derivados de urea cíclicos sustituidos y su utilización como moduladores del receptor vainilloide 1, del 20 de Junio de 2012, de GRUNENTHAL GMBH: Derivados de urea cíclicos sustituidos de fórmula general I, **Fórmula**
donde
X representa O, S o N-C≡N;
m es igual a 1 o 2;
n es igual a 1 o 2;
p1 y p2 […]
ÁCIDOS DICARBOXILICOS SUSTITUIDOS CON LACTAMA Y SU USO, del 13 de Febrero de 2012, de Bayer Pharma Aktiengesellschaft: Compuesto de fórmula (I) en la que A representa un grupo de fórmula en la que * significa el sitio de unión con el grupo E, R4 significa alquilo (C1-C6) […]
BENZOILCICLOHEXENONAS SUSTITUIDAS Y SU UTILIZACIÓN COMO AGENTES HERBICIDAS, del 29 de Diciembre de 2010, de BAYER AKTIENGESELLSCHAFT: Compuestos de la fórmula (I) 5 en la que Q representa O (oxígeno) o S (azufre), R1 representa hidrógeno, fluoro, cloro o bromo, representa metilo, etilo, n- o i-propilo, […]
 2-FENILAMINOBENZAMIDAS 5-SUSTITUIDAS COMO INHIBIDORES DE MEK, del 18 de Marzo de 2011, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Compuesto representado por la siguiente fórmula , o una sal farmacéuticamente aceptable del mismo, en la que R1 representa un átomo de halógeno, […]
2-FENILAMINOBENZAMIDAS 5-SUSTITUIDAS COMO INHIBIDORES DE MEK, del 18 de Marzo de 2011, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Compuesto representado por la siguiente fórmula , o una sal farmacéuticamente aceptable del mismo, en la que R1 representa un átomo de halógeno, […]