Nuevos anticuerpos que inhiben la dimerización de c-Met y sus utilizaciones.
Anticuerpo aislado, o uno de sus fragmentos divalentes de unión a c-Met,
caracterizado por que el anticuerpo comprende una cadena pesada que comprende CDR-H1, CDR-H2 y CDR-H3 que comprenden respectivamente la secuencia de aminoácidos SEC ID nº 1, 2 y 3; y una cadena ligera que comprende CDR-L1, CDR-5 L2 y CDR-L3 que comprenden respectivamente la secuencia de aminoácidos SEC ID nº 10, 11 y 12.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2008/059026.
Solicitante: PIERRE FABRE MEDICAMENT.
Nacionalidad solicitante: Francia.
Dirección: 45, PLACE ABEL GANCE 92100 BOULOGNE-BILLANCOURT FRANCIA.
Inventor/es: GOETSCH,LILIANE.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61P35/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Agentes antineoplásicos.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
PDF original: ES-2542059_T3.pdf




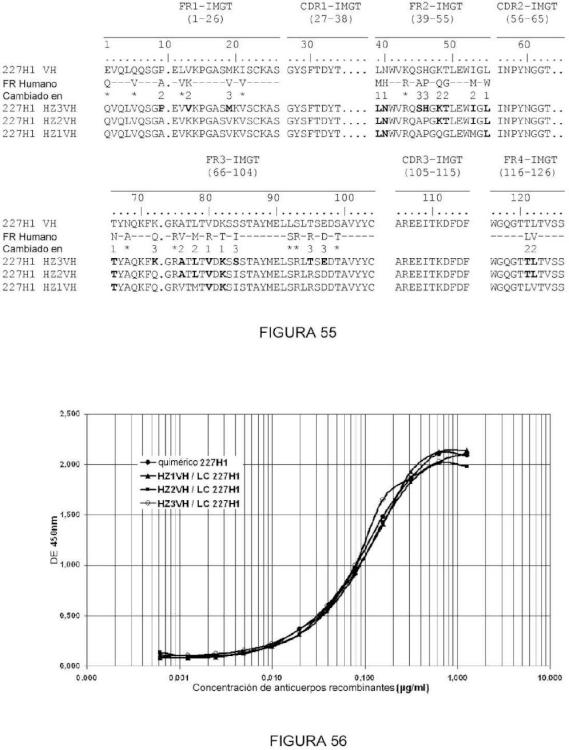
Fragmento de la descripción:
Nuevos anticuerpos que inhiben la dimerización de c-Met y sus utilizaciones.
Campo técnico
La presente invención se refiere a nuevos anticuerpos que pueden unirse específicamente al receptor de c-Met humano y/o que pueden inhibir específicamente la actividad de tirosina cinasa del receptor, especialmente anticuerpos monoclonales de origen murino, quimérico y humanizado, así como las secuencias de aminoácidos y ácidos nucleicos que codifican para estos anticuerpos. Más particularmente, anticuerpos de acuerdo con la invención pueden inhibir la dimerización de c-Met. La invención igualmente comprende la utilización de estos anticuerpos como un medicamento para el tratamiento profiláctico y/o terapéutico de cánceres o cualquier patología relacionada con la sobreexpresión del receptor, así como en procesos o equipos para diagnóstico de enfermedades relacionadas con la sobreexpresión de c-Met. La invención finalmente comprende productos y/o composiciones que comprenden estos anticuerpos, en combinación con otros anticuerpos y/o compuestos químicos dirigidos contra otros factores de crecimiento involucrados en avance de tumor o metástasis y/o compuestos y/o agentes anticancerígenos o agentes conjugados con toxinas y su uso para la prevención y/o el tratamiento de ciertos cánceres.
Antecedentes de ¡a invención
Los agentes dirigidos al receptor tirosina cinasa (RTK) tales como inhibidores trastuzumab, cetuximab, bevacizumab, imatinib y gefitinib, han ¡lustrado el interés de dianizar esta clase de proteína para tratamiento de cánceres seleccionados.
El c-Met, es el miembro prototipo de una subfamilia de RTKs que también incluye RON y SEA. La familia c-Met RTK es estructuralmente diferente de otras familias RTK y es el único receptor de alta afinidad conocido para factor de crecimiento de hepatocitos (HGF = Hepatocyte Growth Factor), también denominado factor de dispersión (SF = scater factor) [D.P. Bottaro et al, Science 1991, 251:802-804; L. Naldini et al, Eur. Mol. Biol. Org. J. 1991, 10:2867- 2878], c-Met y HGF se expresan ampliamente en una variedad de tejidos y su expresión normalmente se restringe a células de origen epitelial y mesenquimal respectivamente [M. F. Di Renzo et al., Oncogene 1991, 6:1997-2003; E. Sonnenberg et al., J. Cell. Biol. 1993, 123:223-235]. Ambos se requieren para un desarrollo normal de mamífero y se ha mostrado que son particularmente importantes en migración celular, diferenciación morfogénica, y organización de las estructuras tubulares tridimensionales así como crecimiento y angiogénesis [F. Baldt et al., Nature 1995, 376:768-771; C. Schmidt et al., Nature. 1995:373:699-702; Tsarfaty et al., Science 1994, 263:98-101]. Mientras que la regulación controlada de c-Met y HGF se ha mostrado que es importante en el desarrollo, mantenimiento y reparación de tejidos de mamíferos [Nagayama T, Nagayama M, Kohara S, Kamiguchi H, Shibuya M, Katoh Y, Itoh
J, Shinohara Y., Brain Res. 2004, 5;999(2): 155-66; Tahara Y, Ido A, Yamamoto S, Miyata Y, Uto H, Hori T, Hayashi
K, Tsubouchi H., J Pharmacol Exp Ther. 2003, 307(1): 146-51], su desregulación está implicada en el avance de cánceres.
La señalización aberrante dirigida por una activación inapropiada de c-Met es una de las alteraciones más frecuentes observadas en cánceres de humanos y juega un papel crucial en tumorigénesis y metástasis [Birchmeier et al., Nat. Rev. Mol. Cell Biol. 2003, 4:915- 925; L. Trusolino and Comoglio P. M., Nat Rev. Cáncer. 2002, 2(4):289- 300].
Una activación c-Met inapropiada puede surgir por mecanismos dependientes e independientes de ligando, que incluye sobreexpresión de c-Met y/o activación paracrina o autocrina o a través de ganancia en mutación de función [J.G. Christensen, Burrows J. and Salgia R., Cáncer Latters. 2005, 226:1-26]. Sin embargo una oligomerización de receptor c-Met, en presencia o en ausencia de ligando, se requiere para regular la afinidad de enlace y cinéticas de enlace de la cinasa hacia ATP y sustratos péptido que contienen tirosina [Hays JL, Watowich SJ, Biochemistry, 2004 Aug 17, 43:10570-8]. c-Met activado recluta efectores de señalización a su sitio de acoplamiento o conexión múltiple ubicado en el dominio de citoplasma, resultando en la activación de varias rutas de señalización clave, incluyendo Ras- MAPK, PI3K, Src y Stat3 [Gao CF, Vande Woude GF, Cell Res. 2005, 15(1):49-51; Furge KA, Zhang YW, Vande Woude GF, Oncogene. 2000, 19(49):5582-9]. Estas rutas son esenciales para proliferación de células de tumor, invasión y angiogénesis y para evadir apoptosis [Furge KA, Zhang YW, Vande Woude GF, Oncogene, 2000, 19(49):5582-9; Gu H, Neel BG, Trends Cell Biol. 2003 Mar, 13(3): 122-30; Fan S, Ma YX, Wang JA, Yuan RQ, Meng Q, Cao Y, Laterra JJ, Goldberg ID, Rosen EM, Oncogene. 2000 Apr 27, 19(18):2212-23]. Además, una faceta única de la señalización c-Met respecto a otra RTK es la interacción de la que se ha informado con complejos de adhesión focal y asociados sin enlace a cinasa tales como a6p4 integrinas [Trusolino L, Bertotti A, Comoglio PM, Cell. 2001, 107:643-54], CD44v6 [Van der Voort R, Taher TE, Wielenga VJ, Spaargaren M, Prevo R, Smit L, David G, Hartmann G, Gherardi E, País ST, J Biol Chem. 1999, 274(10):6499-506], Plexina B1 o semaforinas [Giordano S, Corso S, Conrotto P, Artigiani S, Gilestro G, Barberis D, Tamagnone L, Comoglio PM, Nat Cell Biol. 2002, 4(9):720-4; Conrotto P, Valdembri D, Corso S, Serini G, Tamagnone L, Comoglio PM, Bussolino F, Giordano S, Blood. 2005, 105(11):4321-9; Conrotto P, Corso S, Gamberini S, Comoglio PM, Giordano S, Oncogene. 2004, 23:5131-7] que además pueden contribuir a la complejidad de regular la función celular por este receptor. Finalmente datos
recientes demuestran que c-Met puede estar involucrado en resistencia a tumor de gefitinib o erlotinib, sugiriendo que la combinación del compuesto que hace blanco a EGFR como c-Met puede ser de interés significativo [Engelman JA et al., Science, 2007, 316:1039-43].
En los últimos años recientes, muchas estrategias diferentes se han desarrollado para atenuar la señalización c-Met en líneas celulares de cáncer. Estas estrategias incluyen i) neutralizar anticuerpos contra c-Met o HGF/SF [Cao B, Su Y, Oskarsson M, Zhao P, Kort EJ, Fisher RJ, Wang LM, Vande Woude GF, Proc Nati Acad Sci USA. 2001, 98(13):7443-8; Martens T, Schmidt NO, Eckerich C, Fillbrandt R, Merchant M, Schwall R, Westphal M, Lamszus K, Clin Cáncer Res. 2006, 12(20):6144-52] o el uso de antagonista HGF/SF NK4 para evitar enlace de ligando a c-Met [Kuba K, Matsumoto K, Date K, Shimura H, Tanaka M, Nakamura T, Cáncer Res., 2000, 60:6737-43], ¡i) inhibidores de sitio de enlace ATP pequeños a c-Met que bloquean actividad de cinasa [Christensen JG, Schreck R, Burrows J, Kuruganti P, Chan E, Le P, Chen J, Wang X, Ruslim L, Blake R, Lipson KE, Ramphal J, Do S, Cui JJ, Cherrington JM, Mendel DB, Cáncer Res. 2003, 63:7345-55], i¡¡) polipéptido de dominio SH2 de ingeniería que interfiere con el acceso al sitio de acoplamiento o conexión múltiple y ARNi (RNAi) o ribozima que reduce expresión de ligando o receptor. La mayoría de estos enfoques exhiben una inhibición selectiva de c-Met, resultando en inhibición de tumor y mostrando que c-Met puede ser de interés para la intervención terapéutica en cáncer.
Dentro de las moléculas generadas para la dianización de c-Met, algunos son anticuerpos.
La más extensamente descrita es el anticuerpo anti-c-Met 5D5 generado por Genentech [documento W096/38557] que se comporta como un agonista potente cuando se agrega solo en diversos modelos y como un antagonista cuando se emplea como un fragmento Fab. Una forma de ingeniería monovalente de este anticuerpo descrita como 5D5 de un brazo (OA5D5) y producida como una proteína recombinante en E. Co// también es la materia de una solicitud de patente [documento W02006/015371] por Genentech. Sin embargo, esta molécula que no puede considerarse como un anticuerpo debido a su paiticular adaptador, exhibe también mutaciones que pueden ser inmunogénicas en humanos. En términos de actividad, esta molécula no glicosilada carece de funciones efectoras y finalmente no hay datos claros que demuestren que OA5D5 inhibe la dimerización de c-Met. Aún más, cuando se prueba en el modelo /n v/vo G55, una línea celular de glioblastoma que expresa c-Met pero no HGF mRNA y proteína que se desarrolla indepenientmente del ligando, el anti-c-Met de un brazo no tiene efecto significante en crecimiento de tumor G55, sugiriendo que OA5D5 actúa primordialmente al bloquear enlace HGF y no es capaz de dianizar tumores activados independientemente de HGF [Martens T. et al, Clin. Cáncer Res., 2006, 12(20):6144- 6152].
Otro anticuerpo que dianiza c-Met se describe por Pfizer como... [Seguir leyendo]
Reivindicaciones:
1. Anticuerpo aislado, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que el anticuerpo comprende una cadena pesada que comprende CDR-H1, CDR-H2 y CDR-H3 que comprenden respectivamente la secuencia de aminoácidos SEC ID n° 1, 2 y 3; y una cadena ligera que comprende CDR-L1, CDR-L2 y CDR-L3 que comprenden respectivamente la secuencia de aminoácidos SEC ID n° 10, 11 y 12.
2. Anticuerpo según la reivindicación 1, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que comprende una cadena pesada que comprende la secuencia de aminoácidos SEC ID n° 18 y una cadena ligera que comprende la secuencia de aminoácidos SEC ID n° 21.
3. Hibridoma murino que puede secretar un anticuerpo según la reivindicación 2, caracterizado por que dicho hibridoma es el hibridoma murino depositado en CNCM, Instituí Pasteur, París, el 14 de marzo, 2007 bajo el número 1-3731.
4. Anticuerpo según la reivindicación 1 o 2, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que dicho anticuerpo es un anticuerpo monoclonal.
5. Anticuerpo según la reivindicación 4, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que dicho anticuerpo es un anticuerpo quimérico en el que las regiones constantes de cadena ligera y de cadena pesada proceden de un anticuerpo humano.
6. Anticuerpo según cualquiera de las reivindicaciones 1 a 5, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que puede unirse específicamente a c-Met.
7. Anticuerpo según la reivindicación 6, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que puede inhibir la activación dependiente de ligando e independiente de ligando de c-Met.
8. Anticuerpo según la reivindicación 7, o uno de sus fragmentos divalentes de unión a c-Met, caracterizado por que inhibe la dimerización de c-Met.
9. Ácido nucleico aislado, caracterizado por que es seleccionado de entre los ácidos nucleicos siguientes:
a) un ácido nucleico, ADN o ARN, que codifica un anticuerpo, o uno de sus fragmentos divalentes de unión a c- Met, según cualquiera de las reivindicaciones 1 y 2;
b) un ácido nucleico que comprende una secuencia de ADN que comprende la secuencia SEC ID n° 24 de CDR- H1, la secuencia SEC ID n°25 de CDR-H2, la secuencia SEC ID n° 26 de CDR-H3 y la secuencia SEC ID n° 33 de CDR-L1, la secuencia SEC ID n° 34 de CDR-L2 y la secuencia SEC ID n° 35 de CDR-L3;
c) un ácido nucleico que comprende una secuencia de ADN que comprende la secuencia SEC ID n° 41 de cadena pesada y la secuencia SEC ID n° 44 de cadena ligera;
d) los ácidos nucleicos de ARN correspondientes de los ácidos nucleicos como se ha definido en b) y/o c); y
e) los ácidos nucleicos complementarios de los ácidos nucleicos como se ha definido en a), b) y c).
10. Vector que comprende un ácido nucleico según la reivindicación 9.
11. Célula hospedadora que comprende un vector según la reivindicación 10.
12. Procedimiento para la producción de un anticuerpo, o uno de sus fragmentos divalentes de unión a c-Met, según cualquiera de las reivindicaciones 1, 2 y 4-8, caracterizado por que el procedimiento comprende:
a) cultivar una célula hospedadora según la reivindicación 11, en un medio en unas condiciones de cultivo adecuadas; y
b) recuperar dichos anticuerpos, o uno de sus fragmentos divalentes de unión a c-Met, a partir del medio de cultivo o dichas células cultivadas.
13. Anticuerpo, o uno de sus fragmentos divalentes de unión a c-Met, según las reivindicaciones 1, 2 y 4-8 u obtenido mediante el procedimiento según la reivindicación 12, para su utilización como un medicamento.
14. Composición que comprende como un principio activo un compuesto que consiste en un anticuerpo, o uno de sus fragmentos divalentes de actividad de unión a c-Met, según cualquiera de las reivindicaciones 1, 2 y 4-8, u obtenido mediante el procedimiento según la reivindicación 12, o producido mediante el hibridoma según la
reivindicación 3.
15. Composición según la reivindicación 14, caracterizada por que comprende además un agente como un producto de combinación para la utilización simultánea, separada o secuencial, y en la que dicho agente es un anticuerpo antitumoral.
16. Composición según la reivindicación 14 o 15, caracterizada por que comprende además por lo menos un agente como un producto de combinación para la utilización simultánea, separada o secuencial, en la que dicho agente es un agente citotóxico/citostático.
17. Composición según cualquiera de las reivindicaciones 14 a 16, caracterizada por que es conjugado por lo menos uno de dichos anticuerpos, o uno de sus fragmentos divalentes de unión a c-Met, con una toxina celular y/o un radioelemento.
18. Composición según cualquiera de las reivindicaciones 14 a 17 para su utilización como un medicamento.
19. Utilización de un anticuerpo, o uno de sus fragmentos divalentes de unión a c-Met, según las reivindicaciones 1, 2 y 4-8, u obtenido mediante el procedimiento según la reivindicación 12, o producido mediante el hibridoma según la reivindicación 3, o de una composición según cualquiera de las reivindicaciones 14 a 17 para la preparación de un medicamento para la prevención o para el tratamiento del cáncer.
20. Utilización según la reivindicación 19, caracterizada por que dicho cáncer es seleccionado de entre cáncer de próstata, osteosarcoma, cánceres de pulmón, cáncer de mama, cáncer de endometrio, glioblastoma o cáncer de colon.
21. Utilización según la reivindicación 19 o 20, caracterizada por que dicho cáncer es un cáncer relacionado con la activación de c-Met, seleccionado de entre cáncer que es dependiente y/o independiente del HGF.
22. Procedimiento de diagnóstico /n v/fro de enfermedades inducidas por una sobreexpresión o una infraexpresión del receptor c-Met a partir de una muestra biológica en la que se supone la presencia anormal del receptor c-Met, caracterizado por que dicho procedimiento comprende una etapa en la que dicha muestra biológica se pone en contacto con el anticuerpo, o uno de sus fragmentos divalentes de unión a c-Met, según las reivindicaciones 1, 2 y 4- 8, u obtenido mediante el procedimiento según la reivindicación 12, o producido mediante el hibridoma según la reivindicación 3, siendo posible para dicho anticuerpo ser, si resulta necesario, marcado.
Patentes similares o relacionadas:
 Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Composiciones y métodos para el tratamiento de trastornos de células plasmáticas y trastornos prolinfocíticos de células b, del 29 de Julio de 2020, de Knopp Biosciences LLC: Una composición que comprende una cantidad terapéuticamente eficaz de dexpramipexol para su uso en el tratamiento de un trastorno de células B caracterizado por niveles elevados […]
Derivados de piperidina 1,4 sustituidos, del 29 de Julio de 2020, de 89Bio Ltd: Un compuesto de acuerdo con la Fórmula I: **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de […]
Profármacos de gemcitabina, del 29 de Julio de 2020, de NuCana plc: Una formulación farmacéutica que comprende gemcitabina-[fenil-benzoxi-L-alaninil)]-(S)-fosfato 3: **(Ver fórmula)** o una sal o solvato […]
Formas cristalinas de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, del 29 de Julio de 2020, de Hutchison Medipharma Limited: Forma I de 6-((6,7-dimetoxiquinazolin-4-il)oxi)-N,2-dimetilbenzofuran-3-carboxamida, en donde el difractograma de rayos X de polvo de la Forma […]
Compuestos y procedimientos de uso, del 29 de Julio de 2020, de Medivation Technologies LLC: Un compuesto de fórmula (Aa-1): **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en la que: A representa H, halógeno, amino, […]
Complejos de agentes terapéuticos de base vírica y poli(beta-amino-ésteres) modificados, del 29 de Julio de 2020, de Sagetis Biotech, SL: Un complejo de un agente terapéutico de base vírica con un polímero de fórmula I: **(Ver fórmula)** donde cada L1 y L2 están seleccionados […]
Compuestos de alquinilbenceno heterocíclicos, y composiciones médicas y usos de los mismos, del 29 de Julio de 2020, de Guangzhou Healthquest Pharma Co., Ltd: Un compuesto de alquinilbenceno heterocíclico que tiene la fórmula (I) y una sal farmacéuticamente aceptable, o estereoisómero del mismo, **(Ver […]
Inmunoterapia novedosa contra diversos tumores, entre ellos tumores cerebrales y neuronales, del 22 de Julio de 2020, de IMMATICS BIOTECHNOLOGIES GMBH: Péptido que comprende una secuencia de aminoácidos acorde con la SEQ ID N.º 19, en que dicho péptido tiene una longitud total de entre 9 y 16 aminoácidos.