NUEVO SITIO DE FOSFORILACIÓN DE PROTEINAS QUINASAS ACTIVADAS POR MITÓGENO, PROTEÍNAS FOSFORILADAS Y APLICACIONES.
Una proteína MAPK, donde dicha proteína MAPK is una proteína p38,
seleccionada entre: a) una proteína MAPK que comprende un resto fosforilado en un sitio de fosforilación diferente al sitio o sitios de fosforilación presentes en el segmento de activación de dicha proteína MAPK, o un fragmento de dicha proteína que comprende dicho resto fosforilado, en donde - dicho sitio de fosforilación diferente es el resto de treonina en posición 123 (Thr123) de la p38, isoforma α, de ratón, o un resto de un aminoácido susceptible de fosforilación posicionalmente equivalente en otra proteína MAPK tal y como se define por alineamiento múltiple de secuencias de aminoácidos, y - la fosforilación en dicho sitio de fosforilación diferente impide la activación de dicha proteína MAPK y también su actividad hacia sus sustratos; y b) una proteína MAPK que comprende una carga negativa o un resto voluminoso en un sitio de fosforilación, o en el área que rodea a dicho sitio de fosforilación, que es diferente al sitio o sitios de fosforilación presentes en el segmento de activación de dicha proteína MAPK, o un fragmento de dicha proteína que comprende dicho resto fosforilado, en donde - dicho sitio de fosforilación diferente es el resto de treonina en posición 123 (Thr123) de la p38, isoforma α, de ratón, o un resto de un aminoácido susceptible de fosforilación posicionalmente equivalente en otra proteína MAPK tal y como se define por alineamiento múltiple de secuencias de aminoácidos, y - la introducción de una carga negativa o un resto voluminoso en dicho sitio de fosforilación, o en el área que rodea a dicho sitio de fosforilación, impide la activación de dicha proteína MAPK y también su actividad hacia sus sustratos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/005542.
Solicitante: UNIVERSIDAD AUTONOMA DE MADRID.
Nacionalidad solicitante: España.
Inventor/es: MURGA MONTESINOS,Cristina, MAYOR MENÉNDEZ,Federico, JURADO PUEYO,María, CAMPO MUELAS,Pedro Manuel, PEREGRIN PEDRIQUE,Sandra.
Fecha de Publicación: .
Fecha Solicitud PCT: 9 de Junio de 2006.
Clasificación Internacional de Patentes:
- C12N9/12B1
Clasificación PCT:
- C12N9/12 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › transfieren grupos que contienen fósforo, p. ej. Quinasas (2.7).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
PDF original: ES-2357681_T3.pdf

Fragmento de la descripción:
Nuevo sitio de fosforilación de proteínas quinasas activadas por mitógeno, proteínas modificadas y aplicaciones.
Campo de la invención
La invención se relaciona con un nuevo sitio de fosforilación de proteínas quinasas activadas por mitógeno (MAPK), a las MAPKs fosforiladas en dicho sitio de fosforilación y a sus aplicaciones, en la que dicha proteína MAPK es una proteína p38.
Antecedentes de la invención
Proteínas quinasas activadas por mitógeno (MAPK, del inglés, Mitogen-Activated Protein Kinase)
El término MAPK incluye tres cascadas de quinasas, ERK, JNK y p38, y sus respectivas isoformas [Pearson G., et al., 2001, "Mitogen-activated protein (MAP) kinase pathways: Regulation and Physiological Functions", Endocrine Reviews 22(2):153-183]. Los efectos celulares mediados por estas quinasas son muy numerosos y abarcan todo el ciclo de vida de una célula: crecimiento, división, diferenciación, motilidad, respuestas osmóticas, respuesta al estrés, inflamación, cáncer, etc.
La detección de un determinado estímulo extracelular se transmite a una primera quinasa, denominada MAPKKK cuya diana son las serinas y treoninas de otra quinasa, MAPKK. Esta fosforilación determina la activación de MAPKK fosforilando restos de serina y treonina en una tríada T-Xaa-Y (en donde T es treonina, Y es tirosina y Xaa es el resto de un aminoácido tal como, por ejemplo, ácido aspártico, ácido glutámico, glutamina, glicina o prolina) acotada, llamada segmento de activación, que porta la diana final de esta cascada trimodular. MAPK es la quinasa efectora encargada de fosforilar en serina y treonina a numerosos sustratos, tales como factores de transcripción, otras quinasas, elementos estructurales, etc.
P38
La proteína p38 MAPK, o p38, es una enzima que pertenece a la familia de las serina/treonina quinasas que juega un importante papel en la respuesta celular a señales de estrés externas, tales como luz ultravioleta, shock osmótico, calor, etc. Por este motivo, esta proteína es también conocida como proteína quinasa activada por estrés o SAPK (del inglés, Stress-Activated Protein Kinase). p38 ejerce su papel regulador controlando la expresión génica a través de la fosforilación y activación de factores de transcripción, de otras quinasas y también regulando la estabilidad de importantes ARN mensajeros.
Existen cuatro isoformas de p38 que difieren en su distribución en los diferentes tejidos y en su sensibilidad a los distintos inhibidores de p38, aunque la más estudiada y por lo tanto mejor conocida es la isoforma alfa, cuya activación se ha observado en muchos tipos celulares (tanto de tejido hematopoyético como no hematopoyético) tras el tratamiento con un estímulo apropiado. Sin embargo, a pesar de estas diferencias, todas las isoformas de p38 poseen un dominio de activación compuesto por 12 aminoácidos que contiene el segmento de activación Thr-Gly-Tyr que es fosforilado por MKK6/MKK3, enzimas de la familia de las quinasas que se encuentran por encima de p38 en la cascada de señalización celular.
p38 es un regulador esencial de las funciones celulares que media la producción de citoquinas y otras moléculas responsables del desarrollo de procesos inflamatorios, participa en distintas situaciones fisiológicas inducidas por estrés celular, como es el caso de algunas cardiopatías y fenómenos inflamatorios, y en el control del ciclo celular.
A lo largo de varios años, se ha analizado la implicación que p38 tiene en el desarrollo o evolución de distintas enfermedades. La importancia de la activación de p38 en el establecimiento y desarrollo de un fallo cardíaco ya ha sido establecida. Se ha observado una activación constitutiva tras constricción aórtica en modelos experimentales de ratón y en un modelo de ratas hipertensas con dietas altas en sal. En humanos, p38 se encuentra activada en corazón afectado por un fallo cardíaco secundario a enfermedad coronaria avanzada. La regulación de la activación de p38 parece ser clave en el desarrollo de la patología cardíaca, ya que varios grupos han observado una reducción de la actividad p38 en estadíos terminales de fallo cardíaco en miocardio humano y de rata. Empleando inhibidores de p38 MAPK, también se ha descrito en el estado de la técnica la implicación de p38 MAPK en otras patologías distintas de enfermedades cardíacas, tales como enfermedades inflamatorias, pulmonares o neuronales. Todas estas patologías se caracterizan por presentar p38 en su forma activa, es decir, con los restos Thr180 y Tyr182 fosforilados.
Por otra parte, se ha observado en pacientes con cáncer que tanto la quimioterapia como la radioterapia producen una activación de la p38 que parece ser la responsable de la señal que induce la muerte de las células tumorales.
La estrategia más extendida en el tratamiento de las distintas enfermedades caracterizadas por la presencia de p38 activa consiste en la inhibición farmacológica de su actividad o en la inhibición de su activación, como se menciona en WO 2005/032551, WO 2004/021988, EP1534282 o CA2497448, en combinación con otros agentes terapéuticos.
GRKs
Los receptores acoplados a proteínas G (GPCR) median las acciones de diversos mensajeros que desempeñan un papel esencial en la función del sistema cardiovascular o del sistema inmune. Además de interaccionar con proteínas G heterotriméricas, los GPCR activados interaccionan con quinasas de receptores acoplados a proteínas G (GRKs) y con las proteínas moduladoras denominadas arrestinas. Basados en similitudes estructurales, los siete miembros de la familia de GRKs (GRK1-7) se han clasificado en cuatro subfamilias, GRK1, GRK2/3, GRK4/5/6 y GRK7, donde GRK2/3 y GRK5/6 presentan una distribución ubicua en el organismo. Sin embargo, no se conoce el mecanismo que altera la señalización por GPCRs y contribuye al desencadenamiento y/o progresión de estas patologías.
Estas proteínas desempeñan un papel clave en la rápida modulación de la funcionalidad y la dinámica intracelular de receptores tras la activación por ligandos, además de permitir el reclutamiento y regulación de otras proteínas celulares, iniciando nuevas vías de señalización, por lo que son tanto moduladores como componentes esenciales de la transducción de señales mediada por GPCR. Los niveles y funcionalidad de algunas GRKs están alteradas en situaciones patológicas tales como el fallo cardiaco congestivo, la hipertrofia cardiaca, la hipertensión o procesos inflamatorios tales como la artritis reumatoide.
Por otro lado, se conoce el importante papel que las SAPKs tienen en el desarrollo de cardiomiopatías y fallo cardíaco y que, la activación selectiva de GPCRs promueve la activación crónica de esas quinasas en músculo cardíaco, siendo este un paso esencial en el desarrollo de fallo cardíaco a partir de una hipertrofia ventricular.
Breve descripción de las figuras
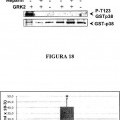
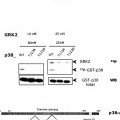
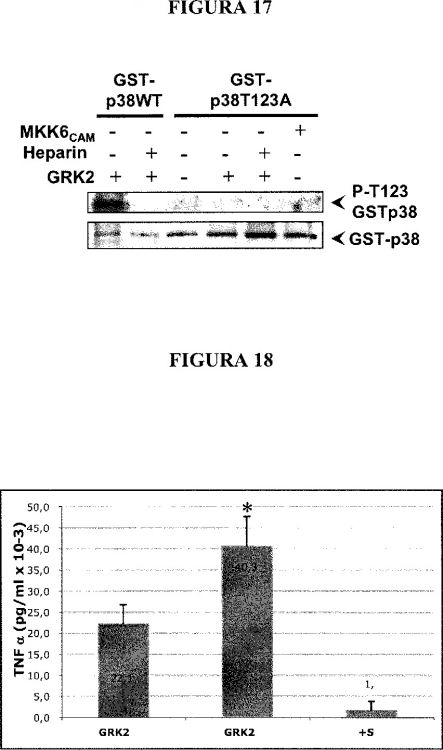
La Figura 1 muestra que GRK2 fosforila directamente a p38 in vitro. La Figura 1A muestra que p38 se fosforila por GRK2. Se incubó GRK2 recombinante purificada por el sistema de Baculovirus (50 nM) con 50 nM de p38 recombinante (GST-p38) en el tampón de fosforilación de p38 (Hepes 25 mM pH 7,5, acetato de magnesio 10 mM, ATP 50 μM, [γ-32P]ATP 2000-3000 cpm/pmol) en un volumen final 40 μl durante 30 minutos a 30ºC, sin o con heparina (50 ng/μl) con el fin de inhibir la actividad de GRK2. Los controles de autofosforilación de las quinasas se llevaron a cabo en las mismas condiciones. Se paró la reacción por adición de tampón de carga-SDS, se separaron las proteínas en un gel de poliacrilamida-SDS al 8% y se revelaron por autorradiografía. La Figura 1B muestra que GRK2 fosforila directamente p38 y no promueve su autofosforilación. Las reacciones de fosforilación se llevaron a cabo como se ha indicado en relación con la Figura 1A. Los compuestos heparina y SB203580, inhibidores de GRK2 y de p38 respectivamente, se utilizaron a concentraciones de diez veces la IC50 para asegurar la completa inhibición de sendas quinasas, esto es a 1,5 μM para la heparina y a 0,5 μM para el SB203580. Los sustratos empleados fueron MBP (14 μg por punto) para p38 y caseína (7,5 μg por punto). Se paró la reacción por adición de tampón de carga-SDS, se separaron las proteínas en un gel de poliacrilamida-SDS al 10% y se revelaron por autorradiografía. La Figura 1C muestra que GRK2 no fosforila a p38 en su segmento de activación. Se iniciaron reacciones... [Seguir leyendo]
Reivindicaciones:
1. Una proteína MAPK, donde dicha proteína MAPK is una proteína p38, seleccionada entre:
a) una proteína MAPK que comprende un resto fosforilado en un sitio de fosforilación diferente al sitio o sitios de fosforilación presentes en el segmento de activación de dicha proteína MAPK, o un fragmento de dicha proteína que comprende dicho resto fosforilado, en donde
- dicho sitio de fosforilación diferente es el resto de treonina en posición 123 (Thr123) de la p38, isoforma α, de ratón, o un resto de un aminoácido susceptible de fosforilación posicionalmente equivalente en otra proteína MAPK tal y como se define por alineamiento múltiple de secuencias de aminoácidos, y
- la fosforilación en dicho sitio de fosforilación diferente impide la activación de dicha proteína MAPK y también su actividad hacia sus sustratos; y
b) una proteína MAPK que comprende una carga negativa o un resto voluminoso en un sitio de fosforilación, o en el área que rodea a dicho sitio de fosforilación, que es diferente al sitio o sitios de fosforilación presentes en el segmento de activación de dicha proteína MAPK, o un fragmento de dicha proteína que comprende dicho resto fosforilado, en donde
- dicho sitio de fosforilación diferente es el resto de treonina en posición 123 (Thr123) de la p38, isoforma α, de ratón, o un resto de un aminoácido susceptible de fosforilación posicionalmente equivalente en otra proteína MAPK tal y como se define por alineamiento múltiple de secuencias de aminoácidos, y
- la introducción de una carga negativa o un resto voluminoso en dicho sitio de fosforilación, o en el área que rodea a dicho sitio de fosforilación, impide la activación de dicha proteína MAPK y también su actividad hacia sus sustratos.
2. Proteína según la reivindicación 1, en la que dicha proteína MAPK es la p38 de mamífero.
3. Proteína según la reivindicación 1, en la que dicha proteína MAPK es la p38, isoforma α, de ratón y tiene la secuencia de aminoácidos mostrada en la SEQ ID NO: 1.
4. Proteína según la reivindicación 1, en la que dicha proteína MAPK comprende un segmento de activación seleccionado entre:
- un segmento de activación que comprende la tríada de aminoácidos de fórmula (I)
donde
Thr es treonina,
Tyr es tirosina, y
Xaa es el resto de un aminoácido, preferentemente, de un aminoácido seleccionado entre ácido aspártico, ácido glutámico, glutamina, glicina y prolina; y
- un segmento de activación que comprende la tríada de aminoácidos de fórmula (II)
donde
Ser es serina,
Glu es ácido glutámico, y
Gly es glicina.
5. Proteína según la reivindicación 1, que comprende la secuencia de aminoácidos mostrada en SEQ ID NO: 2.
6. Un método in vitro para identificar un compuesto potencialmente útil para el tratamiento de patologías mediadas por proteínas MAPK activas, donde dicha proteína MAPK es una proteína p38, que comprende:
a) poner en contacto el compuesto candidato con una proteína MAPK,
b) detectar la fosforilación de dicha proteína MAPK en un sitio de fosforilación diferente al sitio o sitios de fosforilación presentes en el segmento de activación de dicha proteína MAPK, y
c) analizar si dicho sitio de fosforilación (i) es la Thr123 de la p38, isoforma α, de ratón, en caso de que la proteína MAPK utilizada sea dicha proteína, o un resto de un aminoácido susceptible de fosforilación posicionalmente equivalente en otra proteína MAPK tal y como se define por alineamiento múltiple de secuencias de aminoácidos, y si (ii) la fosforilación en dicho sitio de fosforilación diferente impide la activación de dicha proteína MAPK;
o, alternativamente,
7. un anticuerpo capaz de unirse a una proteína MAPK según cualquiera de las reivindicaciones 1 a 5, y/o capaz de detectar dicha proteína MAPK según cualquiera de las reivindicaciones 1 a 5, donde dicho anticuerpo es capaz de reconocer específicamente el resto de aminoácido Thr123 fosforilado o un epítopo de dicha proteína MAPK que comprende la Thr123 fosforilada.
8. Anticuerpo según la reivindicación 7, en donde dicho anticuerpo es capaz de unirse a un epítopo comprendido en un fragmento de la quinasa p38 de mamífero, comprendiendo dicho fragmento un resto de Thr123 fosfotilado, o un resto posicionalmente equivalente en otras proteínas MAPK p38.
9. Anticuerpo según la reivindicación 7 u 8, en el que dicho anticuerpo es un anticuerpo capaz de unirse un epítopo que comprende la secuencia de aminoácidos mostrada en la SEQ ID NO: 2.
10. Una composición farmacéutica que comprende una cantidad terapéuticamente eficaz de un anticuerpo según cualquiera de las reivindicaciones 7 a 9, junto con, opcionalmente, un vehículo farmacéuticamente aceptable.
11. Empleo de
en la elaboración de una composición farmacéutica para el tratamiento de una patología mediada por MAPKs activas, en la que dicha proteína MAPK es una proteína p38 de mamífero y la patología es constricción aórtica, fallo cardiaco seguido de enfermedad coronaria avanzada, fallo cardiaco congestivo o artritis reumatoide.
12. Un kit que comprende una proteína MAPK según cualquiera de las reivindicaciones 1 a 5, o un anticuerpo según cualquiera de las reivindicaciones 7 a 9.
13. Kit según la reivindicación 12, en el que dicha proteína MAPK es una quinasa p38 de mamífero fosforilada en Thr123 de una p38 de mamífero, isoforma α.
Patentes similares o relacionadas:
COMPOSICIONES Y MÉTODOS QUE UTILIZAN INTERFERENCIA DE ARN DE TIPO CDPK PARA EL CONTROL DE NEMÁTODOS, del 7 de Febrero de 2012, de BASF PLANT SCIENCE GMBH: Un método para conferir resistencia a los nematodos a una planta, comprendiendo dicho método las etapas de: a) preparar un ácido nucleico que codifica una […]
HOMÓLOGO HUMANO DE LA PROTEÍNA "FUSED" DE DROSOPHILA, del 10 de Enero de 2012, de GENENTECH, INC.: Ácido nucleico aislado que comprende ADN que codifica: (i) un polipéptido fused de vertebrado que tiene por lo menos un 80% de identidad en la secuencia de aminoácidos […]
 COMPOSICIONES Y MÉTODOS PARA EL DIAGNÓSTICO Y EL TRATAMIENTO DE TUMORES, del 18 de Mayo de 2011, de GENENTECH, INC.: Antagonista de TASK110 para utilizar en un método de inhibición del crecimiento de una célula de cáncer pancreático que expresa un polipéptido que tiene por lo […]
COMPOSICIONES Y MÉTODOS PARA EL DIAGNÓSTICO Y EL TRATAMIENTO DE TUMORES, del 18 de Mayo de 2011, de GENENTECH, INC.: Antagonista de TASK110 para utilizar en un método de inhibición del crecimiento de una célula de cáncer pancreático que expresa un polipéptido que tiene por lo […]
PROTEÍNAS DEL FACTOR DE TRANSCRIPCIÓN RELACIONADAS CON EL ESTRÉS Y MÉTODOS DE USO EN PLANTAS, del 16 de Marzo de 2011, de BASF PLANT SCIENCE GMBH: Una planta transgénica transformada por medio de un ácido nucleico que codifica una proteína del factor de transcripción relacionada con el estrés (TFSRP), […]
UN MIEMBRO DE LA FAMILIA DE LAS PROTEÍNA QUINASAS HUMANAS Y USOS DE LA MISMA, del 18 de Enero de 2011, de MILLENNIUM PHARMACEUTICALS, INC.: Un método para identificar un compuesto capaz de tratar un trastorno respiratorio que comprende analizar la capacidad del compuesto o agente […]
PROTEINAS PROTEINA-QUINASA RELACIONADAS CON EL ESTRES Y METODOS DE UTILIZACION EN LAS PLANTAS, del 4 de Octubre de 2010, de BASF PLANT SCIENCE GMBH: Una célula de planta de una monocotiledónea o una dicotiledónea que comprende una casete de expresión que comprende un ácido nucleico codificante de una proteína […]
PLANTAS QUE TIENEN CARACTERISTICAS DE CRECIMIENTO MEJORADAS Y METODO PARA SU ELABORACION, del 3 de Agosto de 2010, de CROPDESIGN N.V.: Método para mejorar las características de crecimiento de las plantas con relación a las correspondientes plantas de control, que comprende: - […]
Composiciones útiles en el tratamiento de la deficiencia de ornitina transcarbamilasa (OTC), del 8 de Julio de 2020, de THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA: Un vector vírico recombinante que comprende una secuencia de ácido nucleico que codifica la proteína ornitina transcarbamilasa humana (hOTC) y secuencias […]