Nuevas proteínas bacterianas con actividad plaguicida.
Uso de una proteína insecticida para controlar plagas de insectos,
en el que dicha proteína se caracteriza por:
a) ser insecticida para Epilachna varivestis, y
b) tener al menos 70% de identidad de secuencia con la proteína de la capa S de SEC ID No. 2.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/IB2006/001856.
Solicitante: UNIVERSIDAD NACIONAL AUTONOMA DE MEXICO INSTITUTO.
Nacionalidad solicitante: México.
Dirección: V. UNIVERSIDAD NO. 2001 COL. CHAMILPA 62210 CUERNAVACA, MORELOS, MEX MÉXICO.
Inventor/es: BRAVO-DE-LA-PARRA,ALEJANDRA, SOBERON-CHAVEZ,MARIO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K14/19 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Virus de la rubeola.
PDF original: ES-2435079_T3.pdf
Fragmento de la descripción:
Nuevas proteínas bacterianas con actividad plaguicida Campo de la invención La presente invención se refiere al campo del control de plagas, particularmente el control de insectos. Se proporcionan secuencias de ADN recombinantes que codifican proteínas plaguicidas denominadas proteínas ISLP, y sus fragmentos o variantes tóxicos, que son útiles para proteger organismos del daño por plagas, tal como la protección de plantas frente al daño por insectos. Se proporcionan además plantas que comprenden una molécula de ácido nucleico que codifica una proteína ISLP de la invención, así como métodos y medios para usar estas secuencias de ácidos nucleicos para reducir el daño por plagas, tal como daño por insectos, a las plantas.
Antecedentes El uso de bioplaguicidas bacterianos tales como Bacillus thuringiensis (Bt) es una alternativa viable para el control de insectos en agricultura y otras áreas (es decir, vectores de enfermedad) que intensificará la producción de cultivos de una manera económicamente sostenible y medioambientalmente amigable. Las proteínas Bt Cr y son muy específicas, inocuas para seres humanos, vertebrados y plantas, y son completamente biodegradables de manera que no se acumulan productos tóxicos residuales en el entorno (Schnepf et al., 1998) . Hasta la fecha, se han determinado y clasificado 200 secuencias de genes cr y en 44 familias y diferentes subclases (Crickmore et al., 1998, 2005) . Adicionalmente, Bt produce un número de compuestos extracelulares que pueden contribuir a la virulencia, como fosfolipasas, proteasas, quitinasas y otras toxinas tales como !-exotoxina o proteínas VIP (Schnepf et al., 1998) . A pesar de la intensa investigación a lo largo de las últimas décadas, sólo se usan unas pocas toxinas insecticidas bacterianas a gran escala frente a las plagas de insectos más dañinas en aplicaciones biológicas del control de insectos, tales como aquellas que usan plantas Bt.
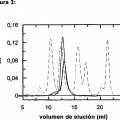
La capa S es una estructura ordenada del conjunto paracristalino proteinoso, que cubre la superficie de muchas arqueas y eubacterias (Beveridge et al., 1997; Sara y Sleytr, 2000) y puede constituir hasta el 15% de la proteína celular total. La función de las proteínas de la capa S no se ha definido exactamente, pero se ha propuesto que estas proteínas están implicadas en la integridad y mantenimiento de la forma celulares. También, se ha teorizado que pueden estar implicadas en el intercambio macromolecular con el entorno, ya que son el componente de cubierta celular más externo (Beveridge et al., 1997) . En algunas bacterias patógenas gramnegativas, se han visto implicadas en virulencia y resistencia al exterminio mediado por el complemento (Sara y SLeytr, 2000; Pei y Blaser, 1990) . En B. cereus, se ha descrito que la capa S promueve interacciones con leucocitos humanos y con el hospedante, contribuyendo a la patogenicidad (Kotiranta et al., 1998) . En B. anthracis, se ha propuesto que la capa S y la cápsula pueden cooperar en la interacción con el hospedante (Mignot et al., 2002) .
En B. anthracis, se han descrito dos proteínas de la capa S diferentes (SAP y EA1) (Mignot et al., 2002) . La presencia de estas proteínas no es necesaria para el encapsulamiento normal de los bacilos (Mesnage et al., 1998) . Estas proteínas parecen secuencialmente de manera dependiente de la fase de crecimiento, antecediendo la síntesis de SAP a la de EA1 (Mignot et al., 2002) . En B. thuringiensis subs. galleria, se describió una proteína de la capa S, SlpA, que es similar a SAP de B. anthracis. La proteína CTC de la capa S se describió en B. thuringiensis subsp. finitimus (número de acceso GenBank AAR23791) , y esta proteína es similar a EA1 de B. anthracis (Sun et al., 2001) . CTC tiene un tamaño molecular de 100 kDa y forma cuerpos paraespóricos durante la fase de esporulación del crecimiento.
Xu et al. (2004) describe la presencia de una proteína de 120 kDa en un análisis de SDS-PAGE de una mezcla de cristal/espora de una cepa esporulante de Bacillus thuringiensis. Se encontró que el sobrenadante de esta mezcla de cristal/espora, obtenido tras la disolución, centrifugación y diálisis, prolonga la supervivencia de ratones inyectados con una muestra sanguínea infecciosa de Plasmodium berghei. La secuencia N-terminal (15 aminoácidos) de la proteína de 120 kDa mostró 100% de homología con la de la proteína de la capa S de Bacillus thuringiensis subsp. galleria (dado a conocer en Mesnage et al., 1998) . La secuencia nucleotídica del gen que codifica esta proteína no se proporciona, pero se afirma que codifica 821 restos de aminoácidos con un peso molecular deducido de 87, 5 kDa. No se ensayó proteína aislada o purificada, ni un hospedante recombinante productor de esta proteína, para determinar la eficacia frente a la infección por Plasmodium aquí. También, la cepa a partir de la que se aisló tal mezcla de cristal/espora no se ha depositado o descrito específicamente en este documento.
Sumario de la invención Se proporcionan en esta invención usos de proteínas ISLP insecticidas caracterizadas por:
a) ser insecticidas frente a Epilachna varivestis, y
b) tener al menos 70% de identidad de secuencia con la proteína de la capa S de SEC ID NO:2; En otra realización, estas proteínas tienen 80% de identidad de secuencia con la proteína de la capa S de SEC ID No. 2, y tienen un peso molecular de alrededor de 50 a alrededor de 120 kDa.
Se proporcionan aquí también usos de tales proteínas ISLP que tienen al menos 95% de identidad de secuencia con la proteína de SEC ID NO:2.
Se proporciona adicionalmente según esta invención una proteína plaguicida ISLP como se define anteriormente, que comprende la secuencia de aminoácidos de SEC ID NO:2 a partir de una posición de aminoácidos entre la posición 1 de aminoácidos y la posición 31 de aminoácidos hasta la posición 863 de aminoácidos, tal como una proteína que comprende la secuencia de aminoácidos de SEC ID NO:2.
También se incluye aquí el uso de secuencias de ADN que codifican cualquiera de las proteínas ISLP anteriores para controlar plagas de insectos, y el uso de genes quiméricos que comprenden: a) una secuencia codificante que comprende tal ADN, y b) un promotor que permite la expresión en células vegetales, para controlar plagas de insectos. En una realización, tal gen quimérico comprende una secuencia codificante que es una secuencia de ADN sintética que se ha optimizado para la expresión en una planta hospedante.
En otra realización de esta invención, se proporciona el uso de una planta, semilla o célula vegetal transgénica que comprende el gen quimérico para controlar plagas de insectos, particularmente una planta, semilla o célula de maíz, algodón, soja, arroz, colza, coliflor, y repollo.
También se proporciona aquí un método para proteger plantas frente al daño causado por plagas de insectos de plantas que se alimentan de la especie vegetal a la que pertenecen dichas plantas, que comprende la etapa de expresar cualquiera de los genes quiméricos anteriores en células de dichas plantas; así como un método para obtener una planta protegida frente al daño causado por plagas de insectos de plantas, que se alimentan de la especie vegetal a la que pertenecen dichas plantas, que comprende la etapa de transformar una célula vegetal con cualquiera de los genes quiméricos anteriores.
También se proporciona aquí el uso anterior de la proteína ISLP anterior, en el que dicha proteína se produce en una planta, o el uso de cualquiera de los genes quiméricos anteriores, en el que el gen quimérico se expresa en una planta.
También se proporciona aquí un procedimiento para aislar proteínas insecticidas tóxicas frente a Epilachna varivestis, comprendiendo tal procedimiento la etapa de identificar cultivos de bacilos insecticidas en busca de genes de la proteína de la capa S, en el que tales genes se reconocen usando tecnología de PCR y cebadores específicos para las regiones de homología de la capa S en SEC ID NO: 1, en el que dichas regiones de homología de la capa S son las regiones en SEC ID NO: 1 que codifican las siguientes regiones en la secuencia de aminoácidos de SEC ID NO: 2: la región desde la posición 34 a 76 de aminoácidos, la región desde la posición 95 a 136 de aminoácidos, y la región desde la posición 162 de aminoácidos hasta la posición 198 de aminoácidos, en el que dichos genes de la proteína de la capa S se transforman en bacterias, y dichas bacterias se identifican en busca de la expresión de la proteína de la capa S, y las bacterias o las proteínas de la capa S purificadas o semipurificadas se ensayan para determinar la actividad frente a E. varivestis, y tal procedimiento en el que dichos bacilos son negativos para... [Seguir leyendo]
Reivindicaciones:
1. Uso de una proteína insecticida para controlar plagas de insectos, en el que dicha proteína se caracteriza por: a) ser insecticida para Epilachna varivestis, y b) tener al menos 70% de identidad de secuencia con la proteína de la capa S de SEC ID No. 2.
2. El uso de la reivindicación 1, en el que dicha proteína se caracteriza por: a) tener al menos 80% de identidad de secuencia con la proteína de la capa S de SEC ID No. 2, y b) un peso molecular de alrededor de 50 a alrededor de 120 kDa.
3. El uso de la reivindicación 1, en el que dicha proteína tiene al menos 95% de identidad de secuencia con la proteína de SEC ID NO: 2.
4. El uso de la reivindicación 2, en el que dicha proteína comprende la secuencia de aminoácidos de SEC ID NO: 2 desde una posición de aminoácidos entre la posición 1 de aminoácidos y la posición 31 de aminoácidos a la posición 863 de aminoácidos.
5. El uso de la reivindicación 2, en el que dicha proteína comprende la secuencia de aminoácidos de SEC ID NO: 2.
6. Uso de un ADN que codifica la proteína citada en una cualquiera de las reivindicaciones 1 a 5 para controlar plagas de insectos.
7. Uso de un gen quimérico que comprende: a) una secuencia codificante que comprende el ADN citado en la reivindicación 6, y b) un promotor que permite la expresión en células vegetales, para controlar plagas de insectos.
8. El uso de la reivindicación 7, en el que dicha secuencia codificante es una secuencia de ADN sintética que se ha optimizado para la expresión en una planta hospedante.
9. Uso de una planta, semilla o célula vegetal transgénica que comprende el gen quimérico citado en la reivindicación 7 u 8, para controlar plagas de insectos.
10. El uso de la reivindicación 9, en el que dicha planta, semilla o célula se selecciona del grupo de: maíz, algodón, soja, arroz, colza, coliflor, y repollo.
11. Un método para proteger plantas frente al daño provocado por plagas de insectos de plantas, que se alimentan de la especie vegetal a la que dichas plantas pertenecen, que comprende la etapa de expresar el gen quimérico citado en la reivindicación 7 u 8 en células de dichas plantas.
12. Un método para obtener una planta protegida frente al daño provocado por plagas de insectos de plantas, que se alimentan de la especie vegetal a la que pertenece dicha planta, que comprende la etapa de transformar dicha planta con el gen quimérico citado en la reivindicación 7 u 8.
13. El uso de una cualquiera de las reivindicaciones 1 a 5, en el que dicha proteína se produce en una planta, o el uso de la reivindicación 7 u 8, en el que el gen quimérico se expresa en una planta.
14. Un procedimiento para aislar proteínas insecticidas tóxicas para Epilachna varivestis, comprendiendo tal procedimiento la etapa de identificar cultivos de bacilos insecticidas para genes de la proteína de la capa S, en el que dichos genes son reconocidos usando tecnología de PCR y cebadores específicos para las regiones de homología de la capa S en SEC ID NO: 1, en el que dichas regiones de homología de la capa S son las regiones en SEC ID NO: 1 que codifican las siguientes regiones en la secuencia de aminoácidos de SEC ID NO: 2: la región de la posición 34 a 76 de aminoácidos, la región de la posición 95 a 136 de aminoácidos, y la región de la posición 162 de aminoácidos a la posición 198 de aminoácidos, en el que dichos genes de la proteína de la capa S se transforman en bacterias, y dichas bacterias se seleccionan para la expresión de la proteína de la capa S, y las bacterias o las proteínas de la capa S purificadas o semipurificadas se ensayan para determinar la actividad frente a
E. varivestis.
15. El procedimiento de la reivindicación 14, en el que dichos bacilos son negativos para los genes Cr y o VIP en el análisis de PCR.
16. Un anticuerpo monoclonal o policlonal que se une específicamente a la proteína de SEC ID No. 2.
17. Una proteína insecticida que comprende una secuencia de aminoácidos con al menos 95% de identidad de secuencia con la secuencia de aminoácidos de SEC ID No. 2, en la que dicha proteína es insecticida para Epilachna varivestis.
Patentes similares o relacionadas:
 EXPRESIÓN RECOMBINANTE DE VARIANTES DE PROTEÍNA DE CUBIERTA DE RUBEOLA E1 COMO PROTEÍNAS DE FUSIÓN CHAPERONAS, Y UTILIZACIÓN DE LAS MISMAS EN LA DETECCIÓN DE ANTICUERPOS ANTI-RUBEOLA, del 7 de Abril de 2011, de F. HOFFMANN-LA ROCHE AG: Antígeno E1 soluble de rubeola y variantes de este péptido, caracterizado porque: (i) no presenta en el extremo C-terminal por lo menos la […]
EXPRESIÓN RECOMBINANTE DE VARIANTES DE PROTEÍNA DE CUBIERTA DE RUBEOLA E1 COMO PROTEÍNAS DE FUSIÓN CHAPERONAS, Y UTILIZACIÓN DE LAS MISMAS EN LA DETECCIÓN DE ANTICUERPOS ANTI-RUBEOLA, del 7 de Abril de 2011, de F. HOFFMANN-LA ROCHE AG: Antígeno E1 soluble de rubeola y variantes de este péptido, caracterizado porque: (i) no presenta en el extremo C-terminal por lo menos la […]
ESPECIFICIDAD MEJORADA EN LA DETECCION DE ANTICUERPOS IGM DE ANTI-RUBEOLA., del 16 de Julio de 2006, de VIRAL ANTIGENS, INC.: Un método para la detección de anticuerpos IgM de anti-rubéola que ccomprende Poner en contacto una muestra sospechosa de contener anticuerpos IgM de anti-rubéola con […]
COMPOSICION DE INTERFERON HIBRIDO Y PROCEDIMIENTO DE USO., del 1 de Diciembre de 2005, de UNIVERSITY OF FLORIDA: LA PRESENTE INVENCION DESCRIBE POLIPEPTIDOS HIBRIDOS DE FUSION DEL INTERFERON, FORMADOS POR UN PRIMER SEGMENTO QUE CONTIENE LA SECUENCIA DE AMINOACIDOS […]
PEPTIDOS, SUS ANALOGOS Y MEZCLAS PARA DETECTAR Y PRODUCIR ANTICUERPOS DE LAS PROTEINAS E1 Y E2 DEL VIRUS DE LA RUBEOLA., del , de BIOCHEM IMMUNOSYSTEMS INC.: ESTA INVENCION SE REFIERE A PEPTIDOS CICLICOS LINEALES DE LAS GLICOPROTEINAS E1 Y E2 DEL VIRUS DE LA RUBEOLA. ESTOS PEPTIDOS Y ANALOGOS, MEZCLAS Y COMBINACIONES […]
 CONJUGADO DE UNION FIBRINA/FIBRINOGENO, del 13 de Noviembre de 2009, de BAXTER AKTIENGESELLSCHAFT
BAXTER INTERNATIONAL INC: Conjugado de unión fibrina/fibrinógeno que comprende una fracción de unión fibrina/fibrinógeno que comprende el dominio C-terminal de VEGF165, y una sustancia farmacéuticamente […]
CONJUGADO DE UNION FIBRINA/FIBRINOGENO, del 13 de Noviembre de 2009, de BAXTER AKTIENGESELLSCHAFT
BAXTER INTERNATIONAL INC: Conjugado de unión fibrina/fibrinógeno que comprende una fracción de unión fibrina/fibrinógeno que comprende el dominio C-terminal de VEGF165, y una sustancia farmacéuticamente […]
 RECEPTOR DE QUIMIOCINAS CXCR3, ANTICUERPOS, ACIDOS NUCLEICOS Y METODOS DE USO, del 1 de Enero de 2008, de THEODOR-KOCHER INSTITUTE
LEUKOSITE, INC.: LA INVENCION SE REFIERE A PROTEINAS RECOMBINANTES DE MAMIFEROS (POR EJ., HUMANOS) RECEPTORAS DEL IP-10/MIG DESIGNADAS COMO RECEPTOR 3 DE LA QUEMOQUINA […]
RECEPTOR DE QUIMIOCINAS CXCR3, ANTICUERPOS, ACIDOS NUCLEICOS Y METODOS DE USO, del 1 de Enero de 2008, de THEODOR-KOCHER INSTITUTE
LEUKOSITE, INC.: LA INVENCION SE REFIERE A PROTEINAS RECOMBINANTES DE MAMIFEROS (POR EJ., HUMANOS) RECEPTORAS DEL IP-10/MIG DESIGNADAS COMO RECEPTOR 3 DE LA QUEMOQUINA […]