MOVILIZACION DE GENOMAS VIRICOS A PARTIR DE T-ADN UTILIZANDO SISTEMAS DE RECOMBINACION ESPECIFICOS DE SITIO.
Un método para movilizar un replicón vírico de un T-ADN, que comprende:
a) proporcionar un replicón Agrobacterium que comprende un T-ADN, que contiene un replicón vírico flanqueado al repetir directamente sitios objetivo para una recombinasa específica de sitio; y
b) infectar una célula de una planta con un Agrobacterium que lleva dicho replicón Agrobacterium bajo condiciones que permiten la transferencia de dicho T-ADN y la expresión de dicha recombinasa específica de sitio en dicha célula; en donde dicha célula, dicho T-ADN, o dicho replicón vírico comprende una secuencia de nucleótido que codifica dicha recombinasa o un fragmento activo o una variante activa de la misma, y dicha secuencia de nucleótido se liga operablemente a un promotor que controla la expresión en dicha célula
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US98/24486.
Solicitante: PIONEER HI-BRED INTERNATIONAL, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 800 CAPITAL SQUARE, 400 LOCUST STREET,DES MOINES, IOWA 50309.
Inventor/es: BASZCZYNSKI, CHRISTOPHER, L., LYZNIK, LESZEK, ALEXANDER, GORDON-KAMM, WILLIAM J., GUAN, XUENI.
Fecha de Publicación: .
Fecha Concesión Europea: 6 de Enero de 2010.
Clasificación Internacional de Patentes:
- C12N15/82A10
- C12N15/82A4A
- C12N15/82A4B
- C12N15/90 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Introducción estable de ADN extraño en el cromosoma.
- C12N9/00 C12N […] › Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas.
Clasificación PCT:
- A01H4/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01H NOVEDADES VEGETALES O PROCEDIMIENTOS PARA SU OBTENCION; REPRODUCCION DE PLANTAS POR TECNICAS DE CULTIVO DE TEJIDOS. › Reproducción de plantas por técnicas de cultivo de tejidos.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/83 C12N 15/00 […] › Vectores virales, p. ej. virus del mosaico de la coliflor.
- C12N15/84 C12N 15/00 […] › Plásmidos Ti.
- C12N5/10 C12N […] › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
Clasificación antigua:
- A01H4/00 A01H […] › Reproducción de plantas por técnicas de cultivo de tejidos.
- C12N15/63 C12N 15/00 […] › Introducción de material genético extraño utilizando vectores; Vectores; Utilización de huéspedes para ello; Regulación de la expresión.
- C12N15/83 C12N 15/00 […] › Vectores virales, p. ej. virus del mosaico de la coliflor.
- C12N15/84 C12N 15/00 […] › Plásmidos Ti.
- C12N5/10 C12N 5/00 […] › Células modificadas por introducción de material genético extraño, p. ej. células transformadas por virus.
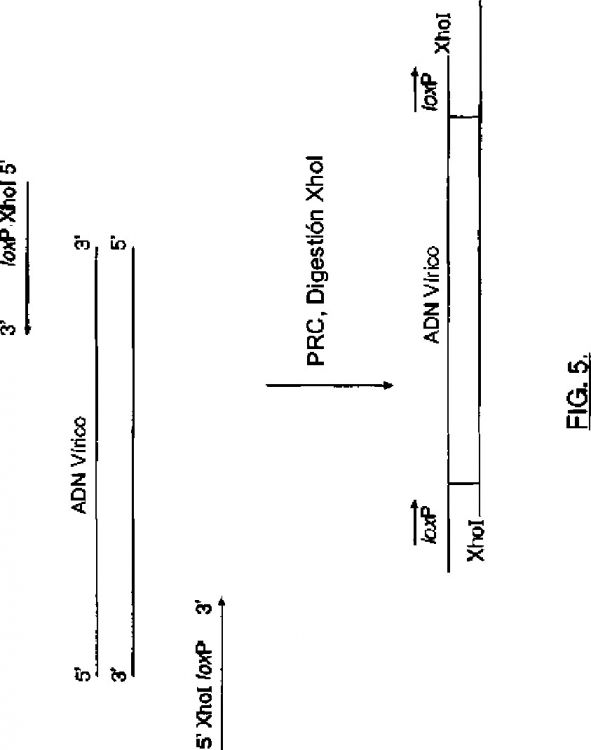
Fragmento de la descripción:
Movilización de genomas víricos a partir de T-ADN utilizando sistemas de recombinación específicos de sitio.
Campo de la invención
La presente invención se relaciona con biología molecular de plantas. Más específicamente, la invención se relaciona con métodos y composiciones para incrementar la eficiencia de escisión de replicón vírico de T-ADN que se transfiere a una planta mediante agroinfección.
Antecedente de la invención
El Agrobacterium que cosecha un plásmido Ti o Ri puede transferir eficientemente una porción de estos plásmidos, del T-ADN, en células de planta en el sitio de una herida. La transferencia del T-ADN en la célula de planta se induce mediante compuestos de señal presentes en el sitio de una herida de una planta y requiere secuencias de límite de T-ADN en ambos extremos de T-ADN y los productos de gen de virulencia que actúan trans (vir) codificados por el plásmido Ti o Ri. El T-ADN transferido luego se objetiva en el núcleo y se integra en el genoma de la planta. Un tumor, agalla de corona, se forma en el sitio de inoculación en la mayoría de las plantas dicotiledóneas.
La formación de tumor resulta de la expresión de Oncogenes T-ADN que codifican los factores de crecimiento auxina y citoquinina que promueven la proliferación de células de planta. Con el fin de que se expresen estos oncogenes, el T-ADN primero se debe integrar en el genoma de la planta. La formación de tumor se limita a las plantas dicotiledóneas debido al TDNA, aunque se transfiere en las células de monocotiledóneas, ya sea que no se integre normalmente en el genoma de plantas monocotiledóneas o se integre y sea silencioso.
Al insertar un genoma vírico en el T-ADN, el Agrobacterium se puede utilizar para mediar la infección vírica de las plantas. Luego de la transferencia del T-ADN a las células de planta, se requiere la escisión del genoma vírico del T-ADN (movilización) para la infección vírica exitosa. Este método mediado por Agrobacterium para introducir un virus en un anfitrión de planta se conoce como agroinfección (para una revisión, ver Grimsley, "Agroinfection" pp. 325-342, in Methods in Molecular Biology, vol 44: Agrobacterium Protocols, ed. Gartland y Davey, Humana Press, Inc., Totowa, NJ; y Grimsley (1990) Physiol. Plant. 79:147-153). Luego de la entrada en el núcleo de la célula de planta, un genoma vírico circular de longitud unitaria que es capaz de iniciar infección sistémica se moviliza desde el T-ADN. No se requiere la integración del T-ADN en el genoma de la planta para este evento. Dos mecanismos no exclusivos, liberación replicativa y recombinación homóloga intramolecular, se han propuesto para esta liberación de genomas víricos circulares o intermedios de replicación de T-ADN. La liberación replicativa de genomas víricos mediante el mecanismo de replicación de círculo giratorio se ha demostrado para la movilización de genomas geminivirus de T-ADN (Stenger et al. (1991) Proc. Natl. Acad. Sci. 88:8029-8033). También se ha demostrado la liberación de geminivirus por vía de recombinación homóloga entre genomas repetidos en forma de pares (Lazarowitz et al. (1989) EMBO J. 8:1023-1032).
La liberación mediante cualquiera de los mecanismos anteriores requieren la presencia de pares de copias del replicón vírico directamente repetidos en el T-ADN. Un replicón vírico circular se puede cortar del T-ADN mediante recombinación homóloga intramolecular entre los genomas repetidos. Para liberación replicativa, dos orígenes de secuencias de replicación pueden estar presentes para iniciar y completar el proceso de replicación. Ambos mecanismos de movilización son procesos bioquímicos complejos que se pueden atenuar mediante un número de factores que a su vez afectan la eficiencia de escisión vírica. Adicionalmente, los dímeros en pares del ADN vírico son frecuentemente difíciles de construir y son inestables en recombinación de células anfitrionas proeficientes.
Se ha reportado la agroinfección en un número de publicaciones como un método exitoso para inducir infecciones víricas sistémicas en células de planta, que incluyen plantas monocotiledóneas tal como maíz (Heath et al. (1997) Mol. Plant-Microbe Interact. 10:221-227, Grimsley et al. (1989) Mol. Gen. Genet. 217:309-316).
En muchos casos, particularmente cuando el ácido nucleico vírico desnudo no es infeccioso, la agroinfección es solo la forma de transformar una planta con ADN vírico clonado. Aún cuando el ácido nucleico vírico desnudo es infeccioso, la agroinfección se utiliza frecuentemente debido a que este es relativamente eficiente y no requiere la producción de grandes cantidades de plásmido o ADN vírico. La agroinfección se ha utilizado para estudiar la replicación vírica y recombinación, en la investigación de funciones de gen vírico, para la producción de vectores víricos que se replican autónomamente, para la expresión transitoria de genes insertados en el T-ADN, para la integración de ADN en un genoma de planta, para la producción de plantas resistentes a virus, para el estudio de elementos transponibles y para la determinación de susceptibilidad específica de tejido a la transferencia de T-ADN.
El desarrollo de vectores de gen de virus de plantas para la expresión de genes externos en las plantas proporciona un medio para proporcionar altos niveles de la expresión de gen dentro de un corto tiempo. Los beneficios de ARN transitorio basado en virus y replicones de ADN incluyen construcción por ingeniería conveniente y rápida acoplada con flexibilidad para la aplicación rápida en varias especies de planta. De esta forma, los virus de replicación autónoma ofrecen numerosas ventajas para uso como vehículos para la expresión transitoria de genes externos, que incluyen sus altos niveles de características de multiplicación y niveles concomitantes de expresión transitoria del gen. De acuerdo con lo anterior, sería benéfico proporcionar métodos que faciliten la construcción de vectores para agroinfección, proporcionar flexibilidad en vectores víricos diseñados para transformación genética de células de planta e incrementar la eficiencia de movilización de replicones víricos a partir de T-ADN y el número de copia de una secuencia de ADN de interés asociada con el replicón vírico.
La presente invención cumple estos objetivos al proporcionar métodos y composiciones para la movilización de replicón vírico de T-ADN por vía de sistemas de recombinación específicos de sitio. La escisión mediada por recombinación específica de sitio de fragmentos de ADN de moléculas de ADN cromosómicas o extracromosómicas se ha descrito para un número de sistemas de recombinación específicos de sitio y especies de planta. Ver Russell et al. (1992) Mol. Gen. Genet. 234:49-59; Lyznik et al. (1996) Nucleic Acids Res. 24: 3784-3789; y Dale et al. (1991) Proc. Natl. Acad. Sci. 88:10558-10562. Sin embargo, la movilización de vectores víricos a partir de T-ADN por vía de recombinación específica de sitio no se ha aplicado previamente para la transformación agromediada.
Resumen de la invención
La invención se relaciona con métodos y composiciones para la movilización mediada por recombinasa específica de sitio de replicones víricos y los ADN asociados de interés de T-ADN. Los métodos de la invención comprenden transferencia mediada por Agrobacterium de T-ADN a una célula de planta, en donde el T-ADN contiene un replicón vírico flanqueado al repetir directamente sitios objetivo para una recombinasa específica de sitio y opcionalmente un ADN de interés ligado al replicón vírico. El ADN de interés también puede contener un sitio objetivo no idéntico para la recombinasa. Un casete de expresión para la recombinasa específica de sitio está presente en el T-ADN o el genoma de planta, o se introduce transitoriamente en la célula de planta. La expresión de la recombinasa específica de sitio en las células de planta resulta en escisión del replicón vírico y el ADN asociado de interés. El replicón vírico y el ADN de interés luego se replican para el alto número de copias en la célula de planta anfitriona.
Los composiciones de la invención comprenden ácidos nucleicos, tal como T-ADN que contienen un ADN vírico flanqueado al repetir directamente sitios objetivo para una recombinasa específica de sitio. Los ácidos nucleicos de la invención pueden contener adicionalmente los casetes de expresión que codifican la recombinasa específica de sitio cognato para los sitios objetivo que flanquean el genoma vírico. Las composiciones de la invención...
Reivindicaciones:
1. Un método para movilizar un replicón vírico de un T-ADN, que comprende:
2. Un método de acuerdo con la reivindicación 1, en donde dicho método proporciona a dicha célula de planta una pluralidad de copias de una secuencia de ADN de interés y en donde dicho T-ADN contiene en una orientación 5' a 3' o 3' a 5', un primer sitio objetivo para dicha recombinasa específica de sitio, dicho replicón vírico, dicha secuencia de ADN de interés, y un segundo sitio objetivo para dicha recombinasa en repetición directa con dicho primer sitio objetivo, en donde dicho primer y segundo sitios objetivo son idénticos.
3. Un método de acuerdo con la reivindicación 1, en donde dicho método proporciona a una célula de planta una pluralidad de copias de una secuencia de ADN de interés, en donde dicho T-ADN contiene en una orientación 5' a 3' o 3' a 5', un primer sitio objetivo para dicha recombinasa, dicho replicón vírico, un segundo sitio objetivo para dicha recombinasa, dicha secuencia de ADN de interés, y un tercer sitio objetivo para dicha recombinasa, en donde dicho primer y dicho tercer sitios objetivo se repiten directamente y son idénticos con respecto uno del otro, y dicho segundo sitio objetivo no es idéntico a dicho primer y dicho tercer sitios objetivo.
4. Un método de acuerdo con la reivindicación 2, en donde el genoma de dicha célula de planta comprende por lo menos un sitio objetivo que corresponde a sitios objetivo idénticos en dicho T-ADN, y en donde dicho replicón vírico y dicho ADN de interés se inserta dentro del sitio objetivo en el genoma de dicha célula de planta.
5. Un método de acuerdo con la reivindicación 3, en donde el genoma de dicha célula de planta comprende por lo menos dos sitios objetivo no idénticos que corresponden al segundo y tercero sitios objetivo no idénticos que flanquean la secuencia de ADN de interés, y en donde dicho ADN de interés se inserta dentro del sitio objetivo en el genoma de dicha célula de planta.
6. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 5, en donde dicha recombinasa específica de sitio es un miembro de la familia integrasa o es FLP, Cre, Int, SSVI, integrasa R, un fragmento activo, o una variante activa de la misma.
7. Un método de acuerdo con una cualquiera de las reivindicaciones 1 a 6, en donde dichos sitios objetivo se seleccionan de un sitio FRT, un sitio FRT mutante, un sitio LoxP y un sitio LoxP mutante.
8. Un método de acuerdo con la reivindicación 1 a 7, en donde dicha célula de planta es de una monocotiledónea o una dicotiledónea o en donde dicha monocotiledónea es maíz, trigo, arroz, cebada, sorgo o centeno o en donde dicha dicotiledónea es soya, Brassica, girasol, alfalfa o alazor.
9. Un T-ADN que contiene un replicón vírico flanqueado al repetir directamente sitios objetivo para una recombinasa específica de sitio.
10. Un T-ADN de acuerdo con la reivindicación 9, dicho T-ADN comprende en una orientación 5' a 3' o 3' a 5', un primer sitio objetivo para dicha recombinasa específica de sitio, dicho replicón vírico, una secuencia de ADN de interés, y un segundo sitio objetivo para dicha recombinasa en repetición directa con dicho primer sitio objetivo, en donde dicho primer y segundo sitios objetivo son idénticos.
11. Un T-ADN de acuerdo con la reivindicación 9 que comprende en una orientación 5' a 3' o 3' a 5', un primer sitio objetivo para la recombinasa, el replicón vírico, un segundo sitio objetivo para la recombinasa, una secuencia de ADN de interés, y un tercer sitio objetivo para dicha recombinasa, en donde dicho primer y dicho tercer sitios objetivo se repiten directamente y son idénticos con respecto uno del otro, y dicho segundo sitio objetivo no es idéntico a dicho primer y dicho tercer sitios objetivo.
12. Un T-ADN de acuerdo con la reivindicación 9, 10 o 11, en donde dicho replicón vírico contiene una secuencia de nucleótido que codifica dicha recombinasa o un fragmento activo o una variante activa de la misma, y dicha secuencia de nucleótido se liga operablemente a un promotor que controla la expresión en una célula de planta.
13. Un T-ADN de acuerdo con la reivindicación 9, 10, 11o 12, en donde dicha recombinasa específica de sitio es FLP, Cre, Int, SSVI, o Integrasa R o un fragmento funcional o una variante activa de la misma, y en donde dicho fragmento o variante retiene la actividad de recombinación específica de sitio.
14. Un T-ADN de acuerdo con una cualquiera de las reivindicaciones 9 a 13, en donde dichos sitios objetivo se seleccionan de un sitio FRT, un sitio FRT mutante, un sitio LoxP, y un sitio LoxP mutante.
15. Un replicón Agrobacterium o un Agrobacterium que contiene el T-ADN como se define por cualquiera de las reivindicaciones 9 a 14.
16. Una célula de planta que tiene una construcción de ADN que comprende en una orientación 5' a 3' o 3' a 5'un primer sitio objetivo para una recombinasa específica de sitio, un replicón vírico, una secuencia de nucleótido de interés, y un segundo sitio objetivo para dicha recombinasa específica de sitio, en donde dicho primer y dicho segundo sitio objetivo se repiten directamente y son idénticos con respecto uno del otro.
17. Una célula de planta de acuerdo con la reivindicación 16, en donde dicha construcción de ADN comprende en la orientación 5' a 3' o 3' a 5'el primer sitio objetivo para dicha recombinasa específica de sitio, dicho replicón vírico, un tercer sitio objetivo para dicha recombinasa específica de sitio, la secuencia de nucleótido de interés, y el segundo sitio objetivo para dicha recombinasa específica de sitio, en donde dicho primer y dicho segundo sitio objetivo se repiten directamente y son idénticos con respecto uno del otro, y dicho tercer sitio objetivo no es idéntico a dicho primer y dicho segundo sitio objetivo.
18. Una célula de planta de acuerdo con la reivindicación 16 o 17, en donde dicha construcción de ADN se incorpora en el genoma de dicha célula de planta.
19. Una célula de planta de acuerdo con una cualquiera de las reivindicaciones 16, 17, o 18, en donde dicha célula de planta comprende una secuencia de nucleótido que codifica dicha recombinasa específica de sitio.
20. Una célula de planta de acuerdo con la reivindicación 19, en donde dicha recombinasa específica de sitio es un miembro de la familia integrasa o es FLP, Cre, Int, SSVI, Integrasa R, o un fragmento activo o una variante activa de la misma.
21. Una célula de planta de acuerdo con una cualquiera de las reivindicaciones 16 a 20, en donde dichos sitios objetivo se seleccionan de un sitio FRT, un sitio FRT mutante, un sitio LoxP, y un sitio LoxP mutante.
22. Una célula de planta de acuerdo con las reivindicaciones 16 a 21, en donde dicha célula de planta es de una monocotiledónea o una dicotiledónea o en donde dicha monocotiledónea es maíz, trigo, arroz, cebada, sorgo, o centeno o dicha dicotiledónea es soya, Brassica, girasol, alfalfa, o alazor.
23. Una planta que comprende una célula de planta de acuerdo con una cualquiera de las reivindicaciones 16 a 22.
24. Una semilla transformada que comprende una célula de planta como se define en una cualquiera de las reivindicaciones 16 a 22.
Patentes similares o relacionadas:
PRODUCCIÓN BIOTECNOLÓGICA DE D-DIBOA Y SUS DERIVADOS CLORADOS A PARTIR DE SUS PRECURSORES NITROFENOXIDO-ACETATO, del 7 de Julio de 2020, de UNIVERSIDAD DE CADIZ: Producción biotecnológica de D-Diboa y sus derivados clorados a partir de sus precursores nitrofenoxido-acetato. El área científica al que corresponde la invención es la […]
Agrupación de genes de biosíntesis de carrimicina, del 27 de Mayo de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Agrupación de genes de biosíntesis de carrimicina, que consiste en 44 genes que comprende: 1) cinco genes de policétido sintasa, incluyendo los residuos […]
Microorganismo modificado para la producción optimizada de 2,4-dihidroxibutirato con eflujo de 2,4- dihidroxibutirato aumentado, del 27 de Mayo de 2020, de METABOLIC EXPLORER: Microorganismo Escherichia coli modificado genéticamente para producir 2,4-dihidroxibutirato por fermentación, en el que dicho microorganismo se […]
Transformante, procedimiento de producción del mismo y procedimiento de producción de ácido dicarboxílico C4, del 13 de Mayo de 2020, de JMTC Enzyme Corporation: Un transformante que comprende uno o más genes extraños de uno o más tipos seleccionados del grupo que consiste en un gen de fosfoenolpiruvato carboxiquinasa y un gen de piruvato […]
Fitasa, del 6 de Mayo de 2020, de BASF Enzymes LLC: Un ácido nucleico aislado, recombinante o sintético que codifica un polipéptido que tiene actividad fitasa, en donde el ácido nucleico se selecciona del grupo que […]
Variantes de polimerasa, del 6 de Mayo de 2020, de F. HOFFMANN-LA ROCHE AG: Una ADN polimerasa modificada que tiene una actividad ADN polimerasa que comprende una secuencia de aminoácidos que tiene al menos un 70 % de […]
Método de amplificación de ADN circular, del 22 de Abril de 2020, de OriCiro Genomics, Inc: Un método para amplificar exponencialmente ADN circular mediante la repetición de ciclos de replicación, que comprende una etapa de: formar una […]
Péptidos UBE2T y vacunas que los contienen, del 19 de Febrero de 2020, de ONCOTHERAPY SCIENCE, INC.: Un péptido aislado de menos de 15 aminoácidos capaz de inducir linfocitos T citotóxicos (CTLs), en donde el péptido comprende una secuencia de aminoácidos […]