MONOHIDRATO DE L-MALATO DE AZITROMICINA CRISTALINO Y COMPOSICION FARMACEUTICA QUE LO CONTIENE.
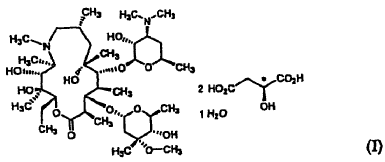
Un monohidrato de L-malato de azitromicina cristalino de la fórmula (I): **(Ver fórmula)**
Tipo: Resumen de patente/invención. Número de Solicitud: W06002157KR.
Solicitante: HANMI PHARM. CO., LTD..
Nacionalidad solicitante: República de Corea.
Dirección: 893-5 HAJEO-RI, PALTAN-MYEON,HWASEONG-GUN, KYUNGKI-DO 445-9.
Inventor/es: KWON,BO SUNG, KIM,EUN SOOK, KIM,HEE CHEOL, YUN,SANGMIN, KO,MYOUNG-SIL, SONG,TAE HUN, KIM,HAN KYONG, SUH,KWEE HYUN GREENVILLE APT. 101-204,-, LEE,GWANSUN.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H17/08 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 17/00 Compuestos que contienen radicales heterocíclicos unidos directamente a los heteroátomos de los radicales sacárido. › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Clasificación PCT:
- C07H17/08 C07H 17/00 […] › Heterociclos que contienen ocho o más miembros cíclicos, p. ej. eritromicinas.
Fragmento de la descripción:
Monohidrato de L-malato de azitromicina cristalino y composición farmacéutica que lo contiene.
Campo de la invención
La presente invención versa acerca de un monohidrato de L-malato de azitromicina cristalino compuesto de una molécula de azitromicina, de dos moléculas de ácido L-málico y de una molécula de H2O, acerca de un procedimiento para prepararlo y acerca de una composición farmacéutica que lo contiene.
Descripción de la técnica anterior
La azitromicina, 9-deoxo-9a-aza-9a-metil-9a-homoeritromicina A (USAN) de la fórmula (II), dada a conocer anteriormente en las patentes US Nos 4.517.359 y 4.474.768, es un antibiótico macrólido semisintético de tipo azalida útil para tratar infecciones bronquiales, infecciones sexuales de contacto e infecciones dérmicas (véase H.A. Kirst y G.D. Sildes, Antimicrob. Agents Chemother. 1989, 33, 1419-1422).
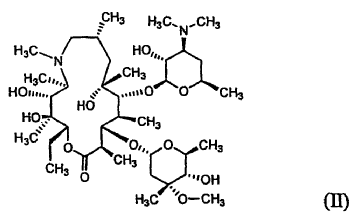
La azitromicina dada a conocer en las anteriores patentes está en la forma de anhidrato o monohidrato cristalino sumamente higroscópico e inestable, que no es adecuado para la formulación farmacéutica.
Para resolver este problema, la Patente EP Nº 0 298 605 da a conocer un dihidrato de azitromicina cristalino no higroscópico. La Patente EP Nº 0 984 020 y la Publicación PCTG Nº WO 2002/085898 dan a conocer una forma solvatada de azitromicina con alcohol no tóxico.
Sin embargo, el dihidrato de azitromicina tenía una reducida solubilidad en el agua de 1,1 mg/ml a 37ºC, lo que afecta de manera adversa la tasa de liberación y la adsorción del fármaco in vivo cuando se administra una composición farmacéutica de dosificación elevada, como en forma de cápsula o de comprimido, y, por ello, se usa con un agente de solubilización para potenciar la tasa de adsorción del fármaco in vivo cuando se requiere, por ejemplo, una administración inyectable.
La azitromicina tiene dos restos de amina terciaria y, por lo tanto, puede ser convertida a la forma de una sal de adición ácida para mejorar la solubilidad de la misma. Por ejemplo, la Patente US Nº 4.474.768 da a conocer sales de adición ácida de azitromicina con un ácido orgánico o inorgánico, por ejemplo el ácido clorhídrico. También se han publicado informes de diversas sales de azitromicina con ácido clorhídrico, ácido yodhídrico, ácido acético, ácido L-aspártico y ácido lactobiónico (véanse S. Djokic et al., J. Chem. Research (8), 1988, 152-153, o J. Chem. Research (M), 1988, 1239-1261). Además, las publicaciones de Patentes CN Nos 1.123.279, 1.157.824, 1.205.338 y 1.334.541 dan a conocer sales de azitromicina con ácido glutámico, ácido aspártico, ácido láctico, ácido cítrico, ácido acético, ácido glucurónico, N-acetilcisteína, ácido metilsulfúrico, ácido ascórbico y ácido sulfúrico.
Sin embargo, la mayoría de estas sales anteriores son materiales amorfos obtenidos por eliminación del disolvente usando en el paso de formación de la sal mediante secado por congelación, deshidratación por aspersión o destilación al vacío. La Patente EP Nº 0.677.530 proporciona dihidrocloruro de azitromicina amorfo preparado mediante precipitación. Tales sales amorfas son higroscópicas e inestables, además del problema de contener cantidades variables de agua o de disolvente orgánico residuales. En consecuencia, no son adecuadas para su aplicación farmacéutica.
La Publicación PCT Nº WO 2004/106355 proporciona una sal cristalina de azitromicina con ácido cítrico, concretamente, citrato ácido de azitromicina. Sin embargo, es difícil mantener el contenido de agua de esta sal a un nivel constante en condiciones de ambiente húmedas.
Los presentes inventores se han esforzado por desarrollar una sal de adición ácida de azitromicina mejorada y hallaron una sal de azitromicina cristalina que tiene estabilidad, solubilidad y no higroscopicidad muy mejoradas con respecto al dihidrato de azitromicina conocido.
Resumen de la invención
Es un objeto primario de la presente invención proporcionar una sal de adición ácida de azitromicina dotada de solubilidad, estabilidad y no higroscopicidad excelentes, y un procedimiento para prepararla.
Conforme a un aspecto de la presente invención, se proporciona un monohidrato de L-malato de azitromicina cristalino de la fórmula (I):
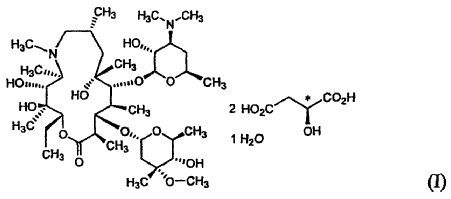
La presente invención proporciona además una composición farmacéutica para tratar infecciones microbianas que comprende el monohidrato de L-malato de azitromicina de la fórmula (I) como ingrediente activo.
Breve descripción de los dibujos
Los objetos y las características anteriores de la presente invención, y otros más, se harán evidentes a partir de la siguiente descripción de la invención tomada en conjunto con los dibujos adjuntos que muestran, respectivamente:
Fig. 1: un espectro de difracción de rayos X en polvo (XPRD) del monohidrato de L-malato de azitromicina cristalino de la invención;
Fig. 2: un espectro de absorción infrarroja (IR) del monohidrato de L-malato de azitromicina cristalino de la invención;
Fig. 3: un espectro XPRD de L-malato anhidrato de azitromicina;
Fig. 4: un espectro de absorción IR de L-malato anhidrato de azitromicina;
Fig. 5: cambios en función del tiempo (%) en el contenido de agua del monohidrato de L-malato de azitromicina cristalino de la invención;
Fig. 6: cambios en función del tiempo (%) en la cantidad de azitromicina activa del monohidrato de L-malato de azitromicina de la invención en comparación con el dihidrato de azitromicina; y
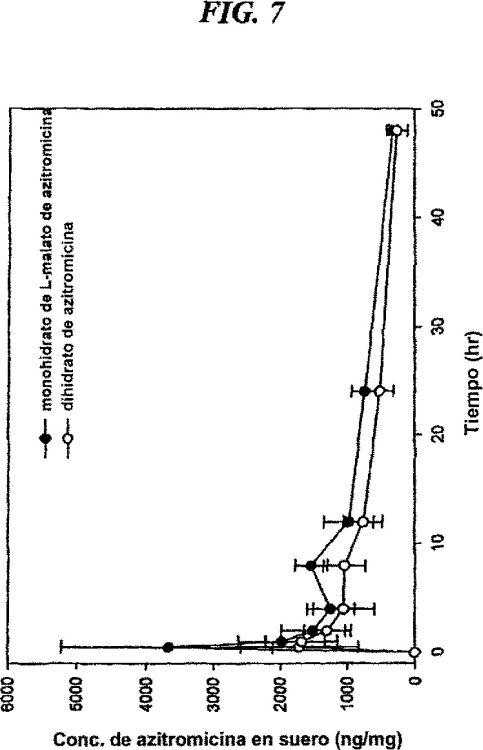
Fig. 7: un perfil farmacocinético in vivo del monohidrato de L-malato de azitromicina de la invención en comparación con el dihidrato de azitromicina.
Descripción detallada de la invención
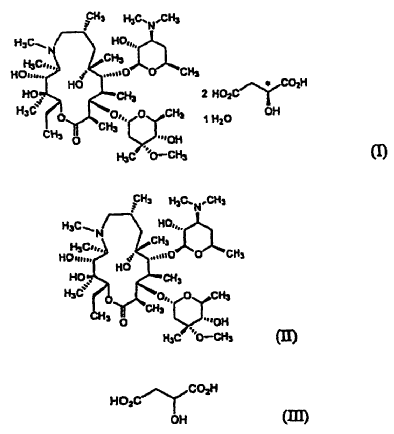
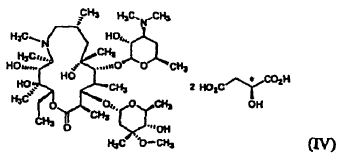
El monohidrato de L-malato de azitromicina de la fórmula (I) de la presente invención puede ser preparado a) haciendo reaccionar azitromicina de la fórmula (II) con ácido málico de la fórmula (III) en un disolvente orgánico acuoso, o b) recristalizando el L-malato cristalino anhidrato de azitromicina de la fórmula (IV) a partir de un disolvente orgánico acuoso:
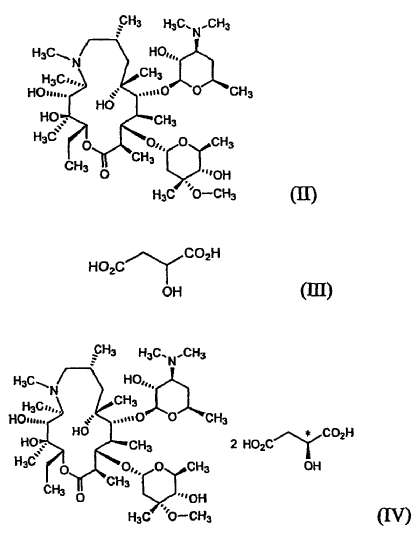
Específicamente, el compuesto inventivo de la fórmula (I) puede ser preparado mediante un procedimiento que comprende: suspender la azitromicina de la fórmula (II) en un disolvente orgánico acuoso, añadir a lo anterior ácido málico de la fórmula (III), calentar la mezcla a una temperatura que oscila entre la temperatura ambiente y el punto de ebullición del disolvente usado, enfriar la solución clara resultante a una temperatura que oscila entre 0ºC y la temperatura ambiente, y filtrar y secar los cristales precipitados.
La azitromicina de la fórmula (II) usada en la presente invención puede estar en forma de anhidrato, monohidrato, dihidrato o solvato.
El ácido málico de la fórmula (III) usado en la presente invención puede ser ácido L-málico, ácido DL-málico de racemato o de una mezcla de los mismos, entre los cuales se prefiere el ácido L-málico.
Conforme al anterior procedimiento de la presente invención, únicamente el ácido L-málico reacciona de forma selectiva con la azitromicina de una molécula quiral en un aspecto estereoquímico para producir el monohidrato de L-malato de azitromicina de la fórmula (I), aun cuando se usa ácido DL-málico de racemato. Aunque cada sal de azitromicina con ácido D- o D,L-málico puede ser formada mediante otro método, por ejemplo usando un disolvente orgánico no acuoso, tal sal se obtiene en forma de anhidrato.
Por lo tanto, en el monohidrato de L-malato de azitromicina de la fórmula (I), L-malato significada la sal del ácido L-(-)málico cuyo carbono asimétrico tiene preferentemente la configuración en S.
En la presente invención, el ácido L-málico se usa preferentemente en una cantidad de entre dos 2 a 2,5 equivalentes molares por cada 1 equivalente molar de azitromicina.
Los disolventes orgánicos acuosos que pueden usarse en la presente invención incluyen la acetona acuosa, la metil...
Reivindicaciones:
1. Un monohidrato de L-malato de azitromicina cristalino de la fórmula (I):
2. El monohidrato de L-malato de azitromicina cristalino de la reivindicación I, cuyo espectro de difracción de rayos X en polvo muestra picos principales que tienen valores I/I0 de al menos el 10% a 2?±0,2 de 9,6, 10,6, 11,2, 12,0, 12,4, 14,3, 14,6, 15,0, 16,6, 17,5, 18,1, 18,6, 19,3, 19,7, 20,2, 20,5, 21,4, 22,6, 23,6, 24,0, 24,6, 27,1, 27,7 y 34,4.
3. Un procedimiento de preparación del monohidrato de L-malato de azitromicina cristalino de la reivindicación 1 que comprende a) hacer reaccionar la azitromicina de la fórmula (II) con el ácido málico de la fórmula (III) en un disolvente orgánico acuoso, o b) recristalizar el L-malato anhidrato de azitromicina de la fórmula (IV) a partir de un disolvente orgánico acuoso:
4. El procedimiento de la reivindicación 3 en el que el ácido málico de la fórmula (III) es ácido L-málico, ácido DL-málico de racemato o de una mezcla de los mismos.
5. El procedimiento de la reivindicación 3 en el que el disolvente orgánico acuoso está seleccionado del grupo constituido por acetona, metil etil cetona, metil isobutil cetona, etanol, 1-propanol, 2-propanol, 1-butanol, tetrahidrofurano, 1,4-dioxano, acetato de metilo, acetato de etilo y una mezcla de los mismos.
6. El procedimiento de la reivindicación 3 en el que el disolvente orgánico acuoso tiene un contenido en agua del 2 al 10% en volumen.
7. El procedimiento de la reivindicación 3 en el que el disolvente orgánico acuoso se usa en una cantidad de 3 a 20 ml en base a 1 g de azitromicina, en el paso a) de la reacción.
8. El procedimiento de la reivindicación 3 en el que el contenido en ácido L-málico en el ácido málico de la fórmula (III) corresponde a entre 2 y 2,5 equivalentes molares basados en 1 equivalente molar de azitromicina, en el paso a) de la reacción.
9. Una composición farmacéutica para tratar una infección microbiana que comprende el monohidrato de L-malato de azitromicina cristalino de la reivindicación 1 como ingrediente activo.
10. La composición de la reivindicación 9 que es administrada en forma de formulación oral.
11. La composición de la reivindicación 10 en la que la formulación oral está en forma de comprimido, cápsula o polvo.
12. La composición de la reivindicación 10 en la que la formulación oral comprende vehículos, diluyentes y excipientes seleccionados del grupo constituido por agentes aglutinantes, agentes de carga, agentes tampón, agentes lubricantes, desintegrantes, agentes edulcorantes, odorantes, tensioactivos, agentes de recubrimiento y una mezcla de los mismos.
13. La composición de la reivindicación 12 en la que la cantidad de monohidrato de L-malato de azitromicina está en el intervalo de 20 a 80 partes en peso en base a 100 partes de peso de la composición.
14. La composición de la reivindicación 11 en la que la formulación en comprimido o cápsula contiene azitromicina en una cantidad de 50 a 3.500 mg.
15. La composición de la reivindicación 9 en la que la infección microbiana está seleccionada entre neumonía, faringitis, amigdalitis, enfermedad pulmonar obstructiva crónica, otitis aguda, infecciones cutáneas sin complicaciones, infecciones de tracto genitourinario y enfermedad por complejo Mycobacterium avium diseminado.
Patentes similares o relacionadas:
Polimorfos de 20,23-piperidinil-5-O-micaminosiltilonolida, del 20 de Mayo de 2020, de INTERVET INTERNATIONAL B.V: Una forma cristalina de 20,23-dipiperidinil-5-O-micaminosil-tilonolida que tiene al menos una de las siguientes características: un espectro FT-Raman que comprende […]
Derivados de azitromicina con propiedades de potenciación de la barrera epitelial, del 13 de Mayo de 2020, de EpiEndo Pharmaceuticals ehf: Un compuesto de acuerdo con la fórmula (I) **(Ver fórmula)** En donde R1 es OH; R2 es de acuerdo con la fórmula (III) **(Ver […]
Derivados de avermectina B1 que tienen un sustituyente alcoximetilo en la posición 4'''' o 4'', del 17 de Febrero de 2020, de Boehringer Ingelheim Animal Health USA Inc: Compuesto de fórmula**Fórmula** en la que n es 0 o 1; A-B es -CH=CH; R1 es sec-butilo o isopropilo; R2 es CH2CH3, p-ClC6H4, CH2(CH2)2N3 […]
Levoisovalerilespiramicina III y preparaciones, métodos de preparación y utilizaciones de la misma, del 1 de Enero de 2020, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto cristalino de levoisovalerilespiramicina III, en el que, la fórmula estructural química de la levoisovalerilespiramicina III se representa como la fórmula […]
 Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Derivado de anfotericina b con toxicidad reducida, del 25 de Septiembre de 2019, de THE BOARD OF TRUSTEES OF THE UNIVERSITY OF ILLINOIS: C2'epiAmB, representado por**Fórmula**
o una sal farmacéuticamente aceptable del mismo.
Forma cristalina de levoisovalerilespiramicina II y preparaciones, procedimientos de preparación y utilizaciones de la misma, del 7 de Agosto de 2019, de Shenyang Fuyang Pharmaceutical Technology Co., Ltd: Compuesto de levoisovalerilespiramicina II, en el que, la fórmula estructural química de la levoisovalerilespiramicina II se representa como la fórmula (II), en condiciones […]
Derivados de la anfotericina B con índice terapéutico mejorado, del 20 de Septiembre de 2018, de The Board of Trustees of the University of Illionis: Un compuesto, o una sal farmacéuticamente aceptable del mismo, el compuesto que se selecciona de**Fórmula**
Procedimientos para tratar enfermedades gastrointestinales, del 11 de Abril de 2018, de Cempra Pharmaceuticals, Inc: Una cantidad terapéuticamente efectiva de un compuesto de fórmula **Fórmula** o una sal farmacéuticamente aceptable del mismo, donde: R10 es hidrógeno […]