MIEMBROS DE LA FAMILIA DEL RECEPTOR SIMILAR A IG LEUCOCITENO MODIFICADO (LIR) CON AFINIDAD INCREMENTADA PARA MHC CLASE I Y SUS USOS EN LA MODULACION DE LA ACTIVACION DE CELULA T.
Un polipéptido que tiene la propiedad de unir a un pMHC Clase I dado CARACTERIZADO PORQUE dicho polipéptido tiene un KD para el dicho pMHC Clase I dado de menos de o igual a 1 µM y/o tiene una constante de disociación (koff) para la dicha molécula pMHC Clase I dada de 2 S -1 o menos y dicho polipéptido tiene por lo menos a 45% de identidad y/o 55% de similitud con la SEQ ID NO:
7 y dicho polipéptido que inhibe al CD8 se une al pMHC dado a un mayor grado que el polipéptido SEQ ID NO: 3
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/GB2006/001860.
Solicitante: MEDIGENE LTD.
Nacionalidad solicitante: Alemania.
Dirección: ISENBRUCK BOSL HORSCHLER WICHMANN LLP PRINZREGENTENSTRASSE 68 81675 MUNCHEN ALEMANIA.
Inventor/es: LI, YI, JAKOBSEN,BENT KARSTEN, MOYSEY,RUTH KAREN.
Fecha de Publicación: .
Fecha Solicitud PCT: 19 de Mayo de 2006.
Fecha Concesión Europea: 7 de Julio de 2010.
Clasificación Internacional de Patentes:
- C07K14/705B
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- A61P37/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Medicamentos para el tratamiento de problemas inmunológicos o alérgicos.
- C07K14/705 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › Receptores; Antígenos celulares de superficie; Determinantes celulares de superficie.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
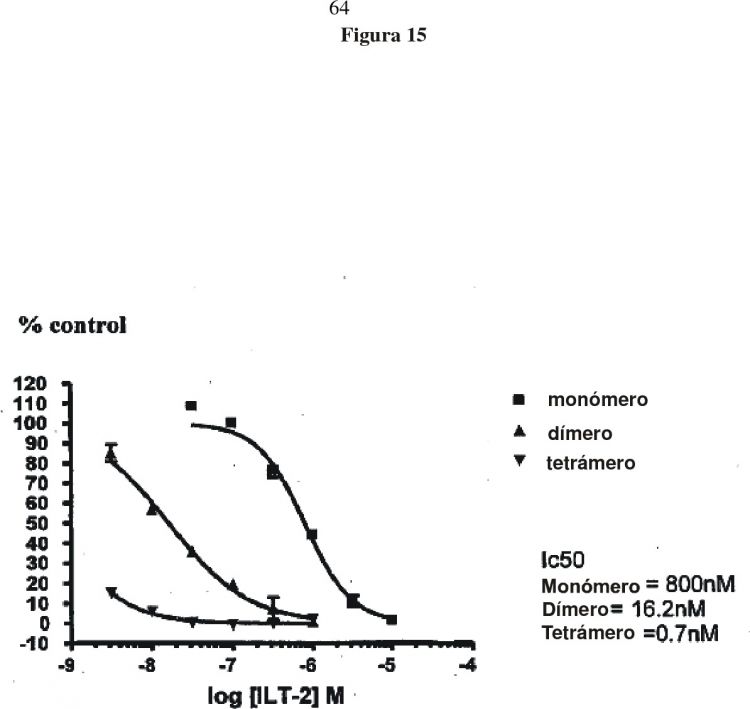
Fragmento de la descripción:
La presente invención se relaciona con polipéptidos que tienen la propiedad de unirse a un pMHC Clase I dado CARACTERIZADO PORQUE dicho polipéptido tiene un KD para dicho pMHC Clase I dado, de menos de o igual a 1 µM y/o tiene una constante de disociación (koff) para dicha molécula pMHC Clase I dada, de 2 S-1 o menos y dicho polipéptido tiene por lo menos un 45% de identidad y/o 55% de similitud con la SEQ ID NO: 7 y dicho polipéptido que inhibe CD8 une al pMHC dado a un mayor grado que el polipéptido SEQ ID NO: 3. También se proporcionan complejos multivalentes de dichos polipéptidos, células que presentan dichos polipéptidos, dichos polipéptidos asociados con agentes terapéuticos y métodos para utilizar estos polipéptidos.
Antecedente de la Invención
Los transcritos similares a inmunoglobulina (ILT) también se conocen como receptores similares a inmunoglobulina leucocito (LIR), receptores similares a inmunoglobulina monocito/macrófago (MIR) y CD85. Esta familia de inmunoreceptores forma parte de la superfamilia de inmunoglobulina. La identificación de las moléculas ILT se publica primero en marzo 1997 en un estudio (Samaridis et al., (1997) Eur J Immunol 27 660-665) que detalla la secuencia de LIR-1 (ILT2), que nota su similitud con el FCγ2R bovino, receptores inhibidores de linfocito citolítico (KIR), FcαR humano, y gp49 de ratón. Este estudio también nota que el LIR-1, como los KIR, se expresan predominantemente en células linfoides B y monocíticas.
Los polipéptidos solubles con las características de unión de pMHC de moléculas ILT y sus complejos multivalentes proporcionan un medio para bloquear el sitio de unión CD8 en moléculas pMHC, por ejemplo para el propósito de inhibir la enfermedad autoinmune mediada por célula T CD8+. Sin embargo, para aquel propósito sería deseable que estos polipéptidos tuvieran una mayor afinidad y/o una menor constante de disociación para las moléculas pMHC objetivo que para las moléculas ILT naturals.
Breve Descripción de la Invención
La presente invención se relaciona con polipéptidos que tienen la propiedad de unirse a un pMHC Clase I dado CARACTERIZADO PORQUE dicho polipéptido tiene un KD para dicho pMHC Clase I dado de menos de o igual a 1 µM y/o tiene una constante de disociación (koff) para dicha molécula pMHC Clase I dada de 2 S-1 o menor y dicho polipéptido tiene por lo menos a 45% de identidad y/o 55% de similitud con la SEQ ID NO: 7 y dicho polipéptido que inhibe CD8 se une al pMHC dado a un mayor grado que el polipéptido de la SEQ ID NO: 3. También se proporcionan complejos multivalentes de dichos polipéptidos, células que presentan dichos polipéptidos, dichos polipéptidos asociados con agentes terapéuticos y métodos para utilizar estos polipéptidos.
Descripción Detallada de la Invención
Como se anotó anteriormente las moléculas ILT también se conocen como LIR, MIR y CD85. El término ILT como se utiliza aquí se entiende que abarca cualquier polipéptido dentro de esta familia de inmunoreceptores.
ILT
La familia ILT de inmunoreceptores se expresa en la superficie de células mieloides y linfoides. Las moléculas ILT comparten 63-84% de homología en sus regiones extracelulares y todas excepto los LIR-4 solubles son proteínas de transmembrana tipo I. Todas las moléculas ILT
2
identificadas actualmente tienen dos a cuatro dominios de la superfamilia de inmunoglobulina en sus regiones extracelulares. (Willcox et al., (2003) 4 (9) 913-919) También se pueden expresar moléculas ILT individuales como un número de variantes/isoformas diferentes. (Colonna et al., (1997) J Exp Med 186 (11) 1809-1818) y (Cosman et al., (1997) Immunity 7 273-282)
Existe un número de papeles científicos que detallan la estructura y función de las moléculas ILT que incluyen los siguientes: (Samaridis et al., (1997) Eur J Inmunol 27 660-665), (Cella, et al., (1997) J Exp Med 185 (10) 1743-1751), (Cosman et al., (1997) Immunity 7 273-282), (Borges et al., (1997) J Inmunol 159 5192-5196), (Colonna et al., (1997) J Exp Med 186 (11) 1809-1818), (Colonna et al., (1998) J. Inmunol 160 3096-3100), (Cosman et al., (1999) Inmunological Revs 168 177-185), (Chapman et al., (1999) Immunity 11 603-613), (Chapman et al., (2000) Immunity 12 727-736), (Willcox et al., (2002) BMC Structural Biology 2 6), (Shiroshi et al., (2003) PNAS 100 (5) 88568861) y (Willcox et al., (2003) 4 (9) 913-919).
La WO9848017 describe las secuencias genéticas que codifican los miembros de la familia de ILT y sus secuencias de aminoácido deducidas. Esta solicitud clasifica las moléculas LIR en tres grupos. El primer grupo contiene polipéptidos con una región de transmembrana que incluye un residuo cargado positivamente y una cola citoplásmica corta. El segundo grupo comprende polipéptidos que tienen una región de transmembrana no polar y una cola citoplásmica larga, y finalmente un tercer grupo que contiene un polipéptido expresado como un polipéptido soluble que no tiene región de transmembrana o cola citoplásmica. También se describen procesos para producir polipéptidos de la familia LIR, y anticuerpos antagónicos para los miembros de la familia LIR. Esta solicitud discute el posible uso de miembros de la familia LIR para tratar enfermedades autoinmunes y estados de enfermedad asociados con función inmune suprimida. A este respecto, se observa que el uso de formas solubles de un miembro de la familia LIR es ventajoso para ciertas aplicaciones. Estas ventajas incluyen la facilidad de purificar formas solubles de ILT/LIR de células anfitrionas recombinantes, que son adecuadas para la administración intravenosa y su potencial uso para bloquear la interacción de los miembros de la familia LIR de superficie celular con sus ligandos con el fin de mediar una función inmune deseable. También se observa la utilidad posible de fragmentos LIR solubles que retienen la actividad biológica deseada, tal como la unión a ligandos que incluyen moléculas MHC clase I.
Otro estudio (Shiroishi et al (2003) PNAS 100 (15) 8856-8861) trata formas solubles (truncadas) de moléculas ILT-2 y ILT-4. Se observa su capacidad para competir con CD8 soluble para la unión a moléculas MHC en estudios Biacore y se considera que este puede ser uno de los mecanismos por los que el ILT-2 modula la activación de célula T CD8+. En relación con la unión de pMHC este estudio iindica "La alta afinidad de ILT versus la unión de CD8 lo que sugiere que los ILT pueden bloquear efectivamente la unión de CD8 a la superficie celular. Este estudio observa que el ILT2 se une al dominio α3 de MHC Clase I y que se ha reportado la estructura de cristal de un fragmento ILT2 que contiene los dominios 1 y 2.
(Colonna et al., (1998) J. Inmunol. 160 3096-3100) que se enfoca en ILT-4, contiene un resumen de la distribución del tejido y la especificidad de los ILT 2-5. De estas moléculas ILT, ILT-2 y ILT-4 se observa que se unen a moléculas MHC Clase I. Este estudio analiza la unión de ILT-4 soluble a células transfectadas con varios MHC Clase I. El estudio concluye que el ILT-4 se une a HLAs-A, B y G, pero no al HLA-Cw3 o HLA-Cw5.
La WO03041650 describe un método para tratar Artritis Reumatoide (RA) utilizando los moduladores de la actividad LIR-2 y/o LIR-3/ LIR-7. Los moduladores descritos incluyen agonistas y
3
antagonistas de la actividad LIR. La WO2006033811 describe el uso de polipéptidos ILT-3 y sus fusiones como agentes terapéuticos para la inhibición del rechazo de injerto.
Se ha determinado la afinidad para varios análogos solubles de moléculas ILT tipo intacto para diferentes objetivos pMHC. Por ejemplo, (Chapman et al., (1999) Immunity 11 603-613) utilizado en métodos basados en Biacore para determinar que el LIR-1 (ILT-2) que se une a un rango de moléculas HLA-A, HLA-B, HLA-C, HLA-E y HLA-G. Los valores KD determinados para estas interacciones varía de 1 x 10-4 M (para HLA-G1) a 2 x 10-5 M (para HLA-Cw*0702). Este estudio también observa que el KD de la interacción entre el ILT-2 tiene una afinidad al UL18, un análogo vírico de MHC Clase I, en el rango de nM.
Un estudio adicional (Chapman et al., (2000) Immunity 12 727-736) reporta la estructura de cristal de un polipéptido LIR-1 truncado (ILT-2) que comprende los dominios D1 y D2. También se conoce que el LIR-1 se une al análogo MhC clase I vírico UL18 con afinidad mucho mayor que el LIR-2 similar. Los autores utilizan la estructura de cristal del polipéptido LIR-1 truncado para identificar las...
Reivindicaciones:
27
1. Un polipéptido que tiene la propiedad de unir a un pMHC Clase I dado CARACTERIZADO PORQUE dicho polipéptido tiene un KD para el dicho pMHC Clase I dado de menos de o igual a 1 µM y/o tiene una constante de disociación (koff) para la dicha molécula pMHC Clase I dada de 2 S-1 o menos y dicho polipéptido tiene por lo menos a 45% de identidad y/o 55% de similitud con la SEQ ID NO: 7 y dicho polipéptido que inhibe al CD8 se une al pMHC dado a un mayor grado que el polipéptido SEQ ID NO: 3.
2. Un polipéptido como se reivindica en la reivindicación 1 que es una molécula ILT humana mutada.
3. Un polipéptido como se reivindica en la reivindicación 1 o reivindicación 2 en donde el dicho KD y/o koff es/son según se mide mediante Resonancia de Plasmón de Superficie.
4. Un polipéptido como se reivindica en cualquier reivindicación precedente en donde uno
o más de los aminoácidos que corresponden a los aminoácidos 10W, 19Q, 20G, 21S, 42K, 47W, 50R, 66I, 77Y, 78Y, 79G, 80S, 81D, 82T, 83A, 84G, 85R, 87E, 99A,101I, 102K, 141 E, 146L, 147N, 159I, 168S, 172W, 174R y 188L de la SEQ ID NO: 3 se muta/se mutan.
5. Un polipéptido como se reivindica en cualquier reivindicación precedente que comprende una o más de las siguientes mutaciones 10W→L, 19Q→M, 19Q→L, 19Q→V, 20G→D, 20G→M, 20G→Q, 20G→F, 20G→S, 20G→E, 20G→R, 21S→Q, 21S→R, 21S→A, 21S→S, 42K→R, 47W→Q, 50R→L, 66L→V, 77Y→V, 77Y→M, 77Y→I, 77Y→Q, 78Y→Q, 78Y→1, 78Y→G, 79G→Q, 79G→Y, 79G→W, 79G→R, 79G→V, 80S→R, 80S→T, 80S→G, 81D→G, 81D→Q, 81D→L, 81D→V, 82T→G, 82T→E, 83A→S, 83A→G, 83A→R, 84G→L, 84G→Q, 84G→A, 85R→W, 87E→A, 99A→I, 99A→Y, 1011→L, 1011→K, 1011→Q, 1011→V, 102K→Q, 102K→A, 102K→R, 141E→G, 141E→D, 146L→D, 147N→S, 159I→E, 168S→G, 172W→R, 174R→W o 188L→D utilizando el número de la SEQ ID NO: 3.
6. Un polipéptido como se reivindica en cualquier reivindicación precedente que comprende mutaciones que corresponden a 19Q→M y 21S→Q utilizando el número de la SEQ ID NO: 3
7. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 5 que comprende mutaciones que corresponden a 19Q→M, 20G→D, 21S→Q, 99A→Vy 168S→G utilizando el número de la SEQ ID NO: 3.
8. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 5 que comprende mutaciones que corresponden a 19Q→L, 20G→M, y21S→Q utilizando el número de la SEQ ID NO: 3.
9. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 5 que comprende mutaciones que corresponden a 19Q→M, 20G→Q, 21S→R, 42K→R, y 146L→S utilizando el número de la SEQ ID NO: 3.
10. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 5 que comprende mutaciones que corresponden a 19Q→M, 20G→D, 21S→Q, 83A→S, 84G→Q, 85R→W, 87E→A y 99A→V utilizando el número de la SEQ ID NO: 3.
11. Un polipéptido como se reivindica en cualquiera de las reivindicaciones precedentes en donde los aminoácidos que corresponden a uno o ambos de 135C o 145C utilizando el número de la SEQ ID NO: 3. se muta/se mutan a S.
12. Un polipéptido como se reivindica en cualquiera de las reivindicaciones precedentes que comprende aminoácidos que corresponden a por lo menos aminoácidos 1-195 de la SEQ ID NO: 3.
13. Un polipéptido como se reivindica en cualquier reivindicación precedente que consiste de o incluye cualquiera de la SEQ ID NOs: 6 a 9 o 21 a 61.
14. Un polipéptido como se reivindica en cualquier reivindicación precedente que consiste de o incluye SEQ ID NO: 16.
15. Un polipéptido como se reivindica en cualquier reivindicación precedente que comprende una o más mutaciones que incrementa la solubilidad del polipéptido con relación a una carencia de polipéptido correspondiente de dichas mutaciones.
16. Un polipéptido como se reivindica en la reivindicación 15 en donde por lo menos un disolvente expuesto al aminoácido hidrófobo se sustituye por un aminoácido cargado.
17. Un polipéptido como se reivindica en la reivindicación 15 o reivindicación 16 en donde dichas mutaciones están dentro de los 6 aminoácidos del polipéptido de terminal C.
18. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 15 a 17 en donde los aminoácidos que corresponden a 196L y/o 198L de la SEQ ID NO: 3 se mutan a 196D y 198D respectivamente.
19. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 15 a 18 que comprende mutaciones que corresponden a 19Q→M, 20G→D, 21S→Q, 83A→S, 84G→Q, 85R→W, 87E→A, 99A→V, 196L→D y 198L→D utilizando el número de la SEQ ID NO: 3.
20. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 15 a 17 que consiste de o incluye cualquiera de la SEQ ID NOs: 63 a 80.
21. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 14 a 19 que consiste de o incluye SEQ ID Nos: 17 o 62.
22. Un polipéptido como se reivindica en cualquier reivindicación precedente que comprende una “etiqueta” en su terminal C.
23. Un polipéptido como se reivindica en la reivindicación 22, en donde dicha etiqueta es un residuo cisteína.
24. Un polipéptido como se reivindica en cualquier reivindicación precedente en donde el polipéptido se asocia con por lo menos una cadena polialquilenglicol.
25. Un polipéptido como se reivindica en la reivindicación 24 en donde la cadena o cadenas polialquilenglicol se une/unen covalentemente al polipéptido.
26. Un polipéptido como se reivindica en la reivindicación 24 o reivindicación 25 en donde la cadena o cadenas polialquilenglicol comprenden por lo menos dos unidades de repetición de polietilenglicol.
27. Un polipéptido como se reivindica en cualquier reivindicación precedente asociada con un agente terapéutico.
28. Un polipéptido como se reivindica en la reivindicación 27 en donde el polipéptido se liga covalentemente a un agente terapéutico.
29. Un polipéptido como se reivindica en la reivindicación 28 en donde el agente terapéutico se liga covalentemente al terminal C del polipéptido.
30. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 27 a 29 en donde el agente terapéutico es una molécula efectora inmune.
31. Un polipéptido como se reivindica en la reivindicación 30 en donde la molécula efectora inmune es una citoquina.
32. Un polipéptido como se reivindica en la reivindicación 31 en donde la molécula efectora inmune es IL-4, IL-10 o IL-13.
33. Un complejo multivalente que comprende por lo menos dos polipéptidos como se reivindica en cualquiera de las reivindicaciones 1 a 32, dicho complejo multivalente tiene un KD para un pMHC Clase I dado de menos de o igual a 1 µM y/o una constante de disociación (koff) para el dicho pMHC Clase I dado de 2 S-1 o menos.
34. Un complejo multivalente como se reivindica en la reivindicación 33 en donde los polipéptidos se liga mediante una cadena de polímero no peptídica o una secuencia ligadora peptídica.
35. Un complejo multivalente como se reivindica en la reivindicación 33 en donde la cadena de polímero o secuencia ligadora peptídica se extiende entre los residuos de aminoácido de cada polipéptido que no se ubican en el dominio de unión pMHC Clase I de los polipéptidos.
36. Un complejo multivalente como se reivindica en cualquiera de las reivindicaciones 34 o 35 en la que los polipéptidos se ligan mediante una cadena de polialquilenglicol o un ligador peptídico derivado de un dominio de multimerización humano.
37. Un complejo multivalente como se reivindica en la reivindicación 36 en donde un radical separador de alquileno divalente se ubica entre la cadena polialquilenglicol y su punto de unión a un polipéptido del complejo.
38. Un complejo multivalente como se reivindica en la reivindicación 36 o reivindicación 37 en donde la cadena polialquilenglicol comprende por lo menos dos unidades de repetición de polietilenglicol.
39. Un complejo multivalente como se reivindica en cualquiera de las reivindicaciones 33 a 38 que es un dímero o tetrámero.
40. Un complejo multivalente que comprende por lo menos dos polipéptidos como se reivindica en cualquiera de las reivindicaciones 33 a 39 en donde (i) por lo menos uno de dichos polipéptidos se asocia con un agente terapéutico como se reivindica en cualquiera de las reivindicaciones 16 a 21.
41. Un polipéptido o complejo multivalente como se reivindica en cualquier reivindicación precedente que es soluble.
42. Un ácido nucleico aislado que codifica un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 32.
43. Un ácido nucleico aislado que codifica como se reivindica en la reivindicación 42 que se ha adaptado para expresión en alto nivel en una célula anfitriona.
44. Un vector que incorpora un ácido nucleico como se reivindica en la reivindicación 42 o reivindicación 43.
45. Una célula aislada o una partícula que presenta por lo menos un polipéptido como se define en cualquiera de las reivindicaciones 1 a 21.
46. Una composición farmacéutica que comprende un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 26, o un complejo multivalente como se reivindica en cualquiera de las reivindicaciones 33 a 39, o una pluralidad de células o partículas como se reivindica en la reivindicación 45, junto con un portador farmacéuticamente aceptable.
47. El uso de un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 26, o un complejo multivalente como se reivindica en cualquiera de las reivindicaciones 33 a 39, o una pluralidad de células o partículas como se reivindica en la reivindicación 45 en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune, preferiblemente dicho medicamento se adapta para administración parenteral.
48. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 26, o un complejo multivalente como se reivindica en cualquiera de las reivindicaciones 33 a 39,
28 29 30
o una pluralidad de células o partículas como se reivindica en la reivindicación 45 para uso en un método terapéutico.
49. Una composición farmacéutica que comprende un polipéptido como se reivindica en cualquiera de las reivindicaciones 27 a 32, o un complejo multivalente como se reivindica en la reivindicación 40, junto con un portador farmacéuticamente aceptable.
50. El uso de un polipéptido como se reivindica en cualquiera de las reivindicaciones 27 a 32, o un complejo multivalente como se reivindica en la reivindicación 40 en la fabricación de un medicamento para el tratamiento de una enfermedad autoinmune, preferiblemente dicho medicamento se adapta para administración parenteral.
51. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 27 a 32, o un complejo multivalente como se reivindica en la reivindicación 40 para uso en un método terapéutico.
52. Un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 26, o un complejo multivalente como se reivindica en cualquiera de las reivindicaciones 33 a 39,
o una pluralidad de células o partículas como se reivindica en la reivindicación 45 para uso en un método de tratamiento de enfermedad autoinmune que comprende administrar a un sujeto que sufre de tal enfermedad autoinmune una cantidad efectiva del polipéptido, o complejo multivalente, o la pluralidad de células o partículas.
53. El uso de un polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 26, o un complejo multivalente como se reivindica en la reivindicación 33 a 39, o una pluralidad de células o partículas como se reivindica en la reivindicación 45, en la preparación de una composición para el tratamiento de enfermedad autoinmune.
54. Un polipéptido como se reivindica en la reivindicación 27 a 32 o un complejo multivalente como se reivindica en la reivindicación 40 para uso en un método de tratamiento de enfermedad autoinmune que comprende administrar a un sujeto que sufre de tal enfermedad autoinmune una cantidad efectiva del polipéptido o complejo multivalente.
55. El uso de un polipéptido como se reivindica en cualquiera de las reivindicaciones 27 a 32, o un complejo multivalente como se reivindica en la reivindicación 40, en la preparación de una composición para el tratamiento de enfermedad autoinmune.
56. Un método para identificar una variante de alta afinidad de una molécula ILT dad que tiene la propiedad de unir a un pMHC Clase I dado CARACTERIZADO PORQUE dicho polipéptido tiene un KD para el dicho pMHC Clase I dado de menos de o igual a 1µM y/o tiene una constante de disociación (koff) para la dicha molécula pMHC Clase I dada de 2 S-1 o más lento y dicho polipéptido tiene por lo menos a 45% de identidad y/o 55% de similitud con SEQ ID NO: 7 y dicho polipéptido inhibe CD8 une al pMHC dado a un grado mayor que el polipéptido SEQ ID NO: 3 dicho método comprende:
31
(i) La producción de una colección de moléculas ILT que comprende una o más mutaciones en la secuencia de aminoácido comparado con la molécula ILT Tipo Intacto correspondiente; y
(ii) Poner en contacto dichas moléculas ILT mutadas con el pMHC Clase I objetivo bajo
5 condiciones adecuadas para permitir la unión de la molécula ILT mutada al pMHC Clase I objetivo; y
(iii) Medir el KD y/o koff de las interacciones; y
(iv) Seleccionar los polipéptidos con las características de unión deseadas.
57. Un método para producir un polipéptido como se reivindica en cualquiera de las 10 reivindicaciones 1 a 23 que comprende:
(i) transformar una célula anfitriona con un vector como se reivindica en la reivindicación 43; y
(ii) cultivar las células transformadas bajo condiciones adecuadas para la expresión del
polipéptido como se reivindica en cualquiera de las reivindicaciones 1 a 23; y 15 (iii) recuperar el polipéptido expresado.
58. Un método como se reivindica en la reivindicación 57 en donde las células anfitrionas son células E. coli.
59. Un método como se reivindica en la reivindicación 57 en donde las células anfitrionas son células de levadura.
20 60. Un método como se reivindica en la reivindicación 57 en donde las células anfitrionas son células Pichia pastoris.
32
Patentes similares o relacionadas:
COMPOSICIONES Y PROCEDIMIENTOS PARA EL TRATAMIENTO Y DIAGNÓSTICO DE TRASTORNOS INMUNITARIOS, del 15 de Diciembre de 2011, de MILLENNIUM PHARMACEUTICALS, INC.: Un anticuerpo que se une específicamente a un péptido codificado por la secuencia de nucleótidos de la SEC ID N.º: 2 o un péptido codificado por el gen […]
MUTEÍNAS GP130 SOLUBLES CON ACTIVIDAD DE UNIÓN MEJORADA, del 9 de Diciembre de 2011, de CONARIS RESEARCH INSTITUTE AG: Un polipéptido que comprende (a) la parte extracelular completa de la glucoproteína gp130 o (b) variantes o fragmentos de dicha parte extracelular, siendo dicho […]
 MOLÉCULAS DE ADHESIÓN VASCULAR Y MODULACIÓN DE SU FUNCIÓN, del 24 de Junio de 2011, de MERCK SERONO SA: Un polipéptido que pertenece a una subfamilia de la Superfamilia de Inmunoglobulinas humanas, seleccionado entre el grupo que consiste en: a) […]
MOLÉCULAS DE ADHESIÓN VASCULAR Y MODULACIÓN DE SU FUNCIÓN, del 24 de Junio de 2011, de MERCK SERONO SA: Un polipéptido que pertenece a una subfamilia de la Superfamilia de Inmunoglobulinas humanas, seleccionado entre el grupo que consiste en: a) […]
PÉPTIDOS TERAPÉUTICOS QUE COMPRENDEN SECUENCIAS DERIVADAS DE CDR2 O CDR3 DE TREM-1 Y EL USO DE LOS MISMOS PARA INHIBIR SEPSIS, del 1 de Junio de 2011, de NOVO NORDISK A/S UNIVERSITE HENRI POINCARÉ - NANCY 1: Polipéptido o derivado, que es capaz de actuar como antagonista de la proteína TREM-1 tal y como se define en SEC ID Nº. 1, que comprende la secuencia de aminoácidos […]
MOLÉCULAS DENOMINADAS LDCAM, del 3 de Marzo de 2011, de IMMUNEX CORPORATION: Una composición que incluye una proteína que comprende los aminoácidos 39374 de SEQ ID NO: 2 y un diluyente o vehículo farmacéuticamente aceptable, en la que dicha proteína […]
SITIO DE ENLAZAMIENTO DEL LIGANDO DE RAGE Y USOS DEL MISMO, del 11 de Febrero de 2011, de THE TRUSTEES OF COLUMBIA UNIVERSITY IN THE CITY OF NEW YORK: Un péptido enlazado a un anticuerpo o a una porción de un anticuerpo, en donde el péptido es un fragmento de sRAGE que comprende los aminoácidos […]
 NUEVAS SECUENCIAS DE POLINUCLEÓTIDOS Y POLIPÉPTIDOS Y SUS USOS, del 27 de Enero de 2011, de IMCLONE LLC: Un oligonucleótido antisentido aislado, en el que dicho oligonucleótido inhibe la expresión del polinucleótido de la SEQ ID NO:1 o SEQ ID […]
NUEVAS SECUENCIAS DE POLINUCLEÓTIDOS Y POLIPÉPTIDOS Y SUS USOS, del 27 de Enero de 2011, de IMCLONE LLC: Un oligonucleótido antisentido aislado, en el que dicho oligonucleótido inhibe la expresión del polinucleótido de la SEQ ID NO:1 o SEQ ID […]
COMPOSICION FARMACEUTICA PARA EL TRATAMIENTO DE CANCER, del 24 de Enero de 2011, de PROYECTO DE BIOMEDICINA CIMA, S.L. INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE: La invención se relaciona con composiciones terapéuticas para el tratamiento del cáncer y, más concretamente, con composiciones que comprenden un ligando agonista […]