MICROSENSOR PARA LA DETECCION DE D-AMINOACIDOS.
Un microelectrodo para medir y/o detectar la concentración de D-serina,
y dicho microelectrodo comprende:
- un medio para la oxidación de dicha D-serina, por lo que se genera peróxido de hidrógeno, y dicho medio es una D-aminoácido oxidasa de una levadura o un microorganismo elegido del grupo que comprende Rhodotorula gracilis DAAO (RgDAAO), Trigonopsis variabilis DAAO, V. luteoalbum DAAO, F. oxisporum DAAO,
- un medio para optimizar la detección de dicho peróxido de hidrógeno, y dicho medio es un medio para la catálisis de la oxidación del peróxido de hidrógeno, y
- un medio para reducir las interferencias, y dicho medio limita la oxidación de los compuestos distintos del peróxido de hidrógeno
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06291523.
Solicitante: CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE (CNRS)
UNIVERSITE CLAUDE BERNARD - LYON 1
UNIVERSITE PARIS XI
UNIVERSITE D'INSUBRIA.
Nacionalidad solicitante: Francia.
Dirección: 3, RUE MICHEL-ANGE,75794 PARIS CEDEX 16.
Inventor/es: PILONE, MIRELLA, MARINESCO,STEPHANE, PERNOT,PIERRE, MOTHET,JEAN-PIERRE, CESPUGLIO,RAYMOND, SCHUVAILO,OLEG, SOLDATKIN,ALEXEY, POLLEGIONI,LOREDANO.
Fecha de Publicación: .
Fecha Solicitud PCT: 27 de Septiembre de 2006.
Fecha Concesión Europea: 13 de Enero de 2010.
Clasificación Internacional de Patentes:
- C12Q1/00B6
Clasificación PCT:
- C12Q1/00 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones.
- G01N27/327 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 27/00 Investigación o análisis de materiales mediante el empleo de medios eléctricos, electroquímicos o magnéticos (G01N 3/00 - G01N 25/00 tienen prioridad; medida o ensayo de variables eléctricas o magnéticas o de las propiedades eléctricas o magnéticas de los materiales G01R). › Electrodos bioquímicos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Microsensor para la detección de D-aminoácidos.
La presente invención se refiere al campo de los microsensores y los microdispositivos sensores.
De manera más precisa, la invención se refiere a un microsensor o microelectrodo para la medida de D-serina, y a un método electroquímico para detectar y/o medir un D-aminoácido, en particular D-serina, más específicamente in vitro, ex vivo y/o in vivo.
Existe especialmente la necesidad de sensores de D-aminoácidos que se puedan usar para la medida in vivo. Por ejemplo, para D-serina, que se ha demostrado recientemente que está presente en el Sistema Nervioso Central (SNC), en la corteza, el hipocampo o el cerebelo en desarrollo.
Este D-aminoácido se ha implicado recientemente en varias patologías tales como esquizofrenia, enfermedad de Alzheimer, dolor crónico o isquemia cerebral. Así, existe la necesidad de agentes farmacológicos capaces de interferir con la síntesis, la liberación, el catabolismo y/o el sistema de absorción de la D-serina en el SNC, así como de métodos fiables para la detección de la D-serina in vivo e in vitro.
Un método conocido para medir la concentración extracelular de D-serina es la microdiálisis. Este método es pesado, caro y difícil de emplear. Además, implica el uso de sondas relativamente grandes, que pueden provocar lesiones que pueden comprometer la medida.
Además, el propio principio de este método, que comprende las etapas de dializar el medio extracelular, recogerlo y analizar su contenido, puede inducir una perturbación en la funcionalidad fisiológica de la muestra debido a la circulación de líquido extracelular exógeno, que puede cambiar la concentración local de la D-serina así como de otros metabolitos pequeños.
También se conocen métodos electroquímicos para detectar D-serina, por ejemplo en la industria alimentaria. Estos métodos usan sensores que tienen un tamaño milimétrico o centimétrico, lo cual en general no es compatible con el uso in vivo. P.ej., Johansson, E. et al. J. Biomat. Appl. 1993, Vol. 8, páginas 146-173.
El campo de los microsensores es de interés creciente. Así, existe una necesidad general de sensores fiables, baratos, pequeños, precisos, selectivos y/o versátiles, y más en particular de sensores que se puedan usar in vivo y/o que permitan medir en tiempo real los cambios en la concentración de un compuesto.
Tal como se ha discutido anteriormente, existe la necesidad especial de un dispositivo para detectar D-aminoácidos, y en particular D-serina, in vivo y/o que permita medir en tiempo real su concentración, por ejemplo para desarrollar un método para hallar agentes farmacológicos capaces de interferir con la síntesis, la liberación y/o la eliminación de D-aminoácidos, y de manera más específica de D-serina en el sistema nervioso central (SNC).
En un primer aspecto, la materia de la presente invención es un microelectrodo para medir y/o detectar la concentración de D-serina, y dicho microelectrodo comprende:
El microelectrodo de la invención puede tener un límite de detección de 300 nM o menos de D-serina.
El microelectrodo presenta una buena selectividad. Por ejemplo, las disoluciones de serotonina, dopamina, L-serina y glicocola a 10 µM (concentraciones mucho mayores que las concentraciones fisiológicas de estas moléculas), no generan señales superiores a un 5% de las detectadas a la misma concentración de D-serina.
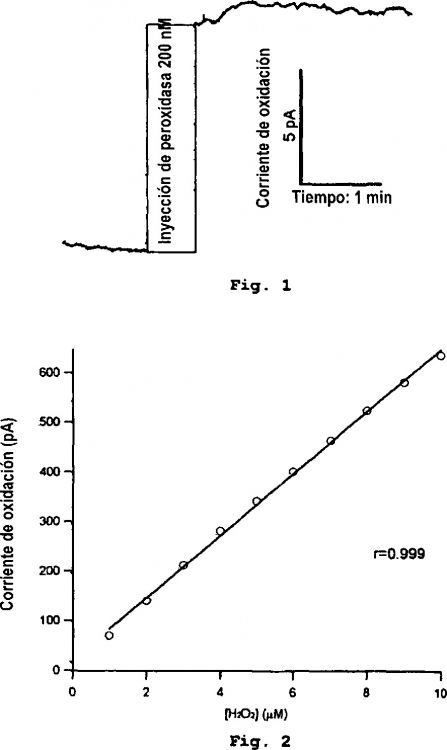
La Figura 1 muestra un experimento de ejemplo en el que se inyectó peróxido de hidrógeno 200 nM en la cámara de registro. La inyección produce un escalón en la corriente de oxidación en el electrodo de trabajo.
La Figura 2 muestra la calibración del microbiosensor de la invención a concentraciones crecientes de peróxido de hidrógeno. La respuesta del microelectrodo es lineal con la concentración entre 10 nM y al menos 10 µM de peróxido de hidrógeno.
"Microelectrodo", en la presente invención, significa un electrodo de pequeño tamaño, en particular un electrodo que tiene un diámetro medio menor de 1 mm, en especial menor de 500 µm, más en particular menor de 250 µm, en especial menor de 150 µm, y de manera más específica menor de 100 µm, o incluso menor de 50 µm.
La D-aminoácido oxidasa (DAAO) puede ser una flavoenzima que contiene una molécula de dinucleótido de flavina-adenina unida de manera covalente o no covalente como cofactor, que es el sitio de la reacción redox.
De manera más precisa, el medio para la oxidación del D-aminoácido puede ser al menos una D-aminoácido oxidasa (DAAO) que no necesita la adición de un cofactor en el medio para oxidar el D-aminoácido. La DAAO puede tener un cofactor natural o artificial que está unido firmemente al resto de apoproteína (es decir, no se produce apoproteína inactiva en las condiciones del ensayo), y/o una actividad específica elevada.
La D-aminoácido oxidasa puede tener una actividad específica elevada, que puede ser de al menos 20, en particular al menos 40, o incluso al menos 55 unidades/mg para al menos un, o solamente un, D-aminoácido específico. De manera más precisa, la D-aminoácido oxidasa puede tener una actividad específica elevada, que puede ser de al menos 20, en particular al menos 40, o incluso al menos 55 unidades/mg para D-serina, y/o al menos 50, en particular al menos 75, o incluso al menos 100 unidades/mg para D-alanina. Una unidad de DAAO se define como la cantidad de enzima que convierte 1 µmol de D-alanina por minuto a 25ºC.
"Derivados" significa, en la presente invención, una enzima que tiene al menos un 65%, en particular al menos un 75%, más en particular al menos un 85%, de manera notable al menos un 90%, incluso al menos un 95%, aún más en particular al menos un 99% de identidad de aminoácidos con la enzima correspondiente. Los derivados tienen el mismo tipo de actividad, por ejemplo una D-aminoácido oxidasa, en particular con una eficacia del mismo orden, es decir, al menos un 50%, más en especial al menos un 75%, en particular al menos un 100%, incluso más de un 150% de la eficacia de la enzima original. La eficacia de la enzima se puede definir como la proporción kcat/km, ensayada con un electrodo de oxígeno a pH 8,5 y 25ºC, a una saturación de oxígeno ([O2] = 0,253 mM) [G. Molla, C. Vegezzi, M.S. Pilone, L. Pollegioni, Overexpression in Escherichia coli of a recombinant chimeric Rhodotorula gracilis D-amino acid oxidase, Prot. Express. Purif., 14 (1998) 289-294].
La D-serina es un sustrato de la D-aminoácido oxidasa (DAAO). La D-serina puede ser natural o sintética.
El medio para la oxidación del D-aminoácido se puede inmovilizar en el electrodo mediante:
Reivindicaciones:
1. Un microelectrodo para medir y/o detectar la concentración de D-serina, y dicho microelectrodo comprende:
2. Un microelectrodo según la reivindicación 1, en el que el medio para la oxidación del D-aminoácido es una D-aminoácido oxidasa (DAAO) que no necesita la adición de un cofactor en el medio para oxidar el D-aminoácido, y/o que muestra una actividad específica elevada.
3. Un microelectrodo según las reivindicaciones 1 ó 2, en el que el medio para la oxidación del D-aminoácido está inmovilizado en el electrodo mediante:
4. Un microelectrodo según cualquiera de las reivindicaciones 1 a 3, en el que el medio para optimizar la detección de dicho peróxido de hidrógeno se elige de:
5. Un microelectrodo según la reivindicación 4, en el que el metal se elige del grupo de metales nobles que comprende platino, oro, rutenio, rodio, paladio, iridio, osmio, y de otros metales como hierro, cromo, níquel, tungsteno.
6. Un microelectrodo según cualquiera de las reivindicaciones 1 a 5, en el que el medio para reducir las interferencias es limitar la oxidación de los compuestos distintos del peróxido de hidrógeno, que se pueden oxidar en el electrodo, en particular limitando el acceso y/o el contacto de estos compuestos con el electrodo.
7. Un microelectrodo según cualquiera de las reivindicaciones 1 a 6, en el que el medio para reducir las interferencias se elige de:
8. Un microelectrodo según cualquiera de las reivindicaciones 1 a 7, en el que el electrodo se elige del grupo que comprende:
9. Un microelectrodo según cualquiera de las reivindicaciones 1 a 8, el cual es un electrodo de fibra de carbono cubierto por una capa de rutenio, una capa de PPD y una capa de D-aminoácido oxidasa (DAAO).
10. Un dispositivo para detectar y/o medir la concentración de D-serina en un medio, en particular in vivo, que comprende un electrodo según cualquiera de las reivindicaciones 1 a 9.
11. Un método para detectar y/o medir la concentración de D-serina en un medio que comprende las siguientes etapas:
12. Un método para fabricar un microelectrodo que comprende las siguientes etapas:
Patentes similares o relacionadas:
SENSOR DE NITRÓGENO UREICO EN SANGRE (BUN), del 13 de Julio de 2011, de ABBOTT POINT OF CARE, INC: Dispositivo para detectar urea en una muestra, que comprende: (a) un sensor con el que puede ponerse en contacto una muestra que se sospecha que contiene urea, incluyendo […]
 ELECTRODO PARA BIOSENSOR, del 22 de Diciembre de 2010, de ABBOTT LABORATORIES: Una tira de electrodos desechable de un solo uso para la unión al circuito de lectura de señales de un sistema sensor para detectar una corriente representativa de un analito […]
ELECTRODO PARA BIOSENSOR, del 22 de Diciembre de 2010, de ABBOTT LABORATORIES: Una tira de electrodos desechable de un solo uso para la unión al circuito de lectura de señales de un sistema sensor para detectar una corriente representativa de un analito […]
 BIOSENSOR DE CREATININA ESTABLE PARA TRES ENZIMAS, del 12 de Abril de 2010, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un método para preparar un biosensor de tres enzimas de uso múltiple para la determinación amperométrica de creatinina en líquidos biológicos, […]
BIOSENSOR DE CREATININA ESTABLE PARA TRES ENZIMAS, del 12 de Abril de 2010, de SIEMENS HEALTHCARE DIAGNOSTICS INC.: Un método para preparar un biosensor de tres enzimas de uso múltiple para la determinación amperométrica de creatinina en líquidos biológicos, […]
 BIOSENSOR, del 13 de Enero de 2010, de MATSUSHITA ELECTRIC INDUSTRIAL CO., LTD.: Biosensor que comprende una primera placa aislante de base que tiene un electrodo de trabajo, una segunda placa aislante de base que tiene […]
BIOSENSOR, del 13 de Enero de 2010, de MATSUSHITA ELECTRIC INDUSTRIAL CO., LTD.: Biosensor que comprende una primera placa aislante de base que tiene un electrodo de trabajo, una segunda placa aislante de base que tiene […]
 BIOSENSOR, del 7 de Enero de 2010, de CCI CORPORATION
ULTIZYME INTERNATIONAL LTD: Biosensor para medir la concentración de grasas neutras en base al valor de la corriente que fluye en un sistema de electrodos, que comprende: un sustrato aislante; […]
BIOSENSOR, del 7 de Enero de 2010, de CCI CORPORATION
ULTIZYME INTERNATIONAL LTD: Biosensor para medir la concentración de grasas neutras en base al valor de la corriente que fluye en un sistema de electrodos, que comprende: un sustrato aislante; […]
Dispositivo para la detección de analitos, del 1 de Julio de 2020, de TECHLAB, INC.: Un dispositivo para detectar por lo menos una sustancia de interés en una muestra líquida, comprendiendo el dispositivo: (a) una unidad que […]
Sistema y dispositivos de ensayo de actividad enzimática, del 1 de Julio de 2020, de Københavns Universitet (KU): Un dispositivo de actividad enzimática adecuado para la determinación de la actividad de degradación enzimática de los biopolímeros en una muestra líquida, […]
Sistema y método para medir una concentración de analito corregida usando un sensor electroquímico, del 20 de Mayo de 2020, de CILAG GMBH INTERNATIONAL: Un método para determinar una concentración de un analito en una muestra, el método comprendiendo: introducir una muestra que incluye un analito en una […]