Métodos de uso de miARN para la detección de muerte celular in vivo.
Un método de detección y cuantificación de miARN libres de células específicos de células,
tejido y/u órganos enel fluido corporal para la evaluación de la muerte celular in vivo en diferentes tejidos y órganos, en donde la muertecelular in vivo está asociada con un trastorno de un tejido y/u órgano concreto que comprende:el análisis de una muestra de fluido corporal seleccionada entre sangre, suero y orina obtenida de un sujetopara determinar una o más secuencias específicas de miARN, en donde dicho análisis comprende la etapa dedetectar dicho miARN con un cebador y/o sonda que es sustancialmente complementario a una parte de dichassecuencias de miARN específicas.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2008/009991.
Solicitante: TROVAGENE, INC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 11055 FLINTKOTE AVENUE SAN DIEGO, CA 92121 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MELKONYAN, HOVSEP, S., UMANSKY, SAMUIL, R., SHEKHTMAN,EUGENE M, SCHEINKER,VLADIMIR S.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2415245_T3.pdf
Fragmento de la descripción:
Métodos de uso de miARN para la detección de muerte celular in vivo
Campo de la invención La invención proporciona métodos no invasivos para el aislamiento y la detección de pequeños ARN libres de células, en particular, microARN (miARN o miRNA por sus siglas en inglés) en secuencias de fluidos corporales seleccionados entre sangre, suero y orina. Más específicamente, la presente invención abarca métodos para detectar in vivo la muerte celular mediante el análisis de orina, sangre o suero para detectar los niveles de miARN para el diagnóstico clínico y el seguimiento del tratamiento.
Antecedentes de la invención La muerte celular es un componente normal del desarrollo y el funcionamiento de los organismos multicelulares. Al ser un proceso natural, la muerte celular está implicada en la patología de numerosas enfermedades causadas por factores internos. La muerte celular también acompaña a enfermedades causadas por agentes físicos, químicos, o biológicos externos.
Existen dos tipos principales de muerte celular, la necrosis y la apoptosis, marcados por diferentes características morfológicas y moleculares (Kerr et al., Br. J. Cancer. 26, 239-257 (1972) ; Umansky, Theor. Biol. 97, 591-602 (1982) ; Umansky et al., Adv Pharmacol. 41, 383-407 (1997) ; Ameisen, Cell Death Differ. 11, 4-10 (2004) ; Lockshin y col. Int J Biochem Cell Biol. 36, 2405-19 (2004) ; Kroemer G., et al., Cell Death and Differentiation 12, 1463-1467 (2005) ) . Se considera que la necrosis es el fracaso metabólico catastrófico que resulta directamente del deterioro molecular y/o estructural severo y conduce a la inflamación y al deterioro secundario a las células circundantes. La apoptosis es un fenómeno biológico mucho más prevalente que la necrosis y puede ser inducida por señales específicas tales como hormonas, citoquinas, por la ausencia de señal específica, tal como factores de crecimiento o de adhesión, o por deterioro molecular que no causa la pérdida catastrófica de la integridad. La apoptosis es el resultado de una respuesta celular activa que implica la iniciación de una cascada ordenada y específica de eventos moleculares. La apoptosis conduce a la aparición de condensación y marginación de la cromatina, fragmentación nuclear, contracción celular, formación de ampollas en la membrana y fragmentación internucleosomal enzimática de ADN nuclear características (Umansky et al., Biochim Biophys Acta. 655, 9-17 (1981) ; Arends et al., Am J Pathol. 136, 593-608 (1990) ) . También se han descrito otras formas más raras de muerte celular, caracterizadas por la morfología específica, por ejemplo, la denominada muerte celular por autofagia (Bredesen et al., Stroke. 38 (Supl 2) : 652-660 (2007) .
Con independencia de un mecanismo específico y del tipo de muerte celular, los métodos para detectar tipos de células que están muriendo son importantes para el diagnóstico de diversas enfermedades, críticos para la enfermedad y el seguimiento del tratamiento, y útiles para el diagnóstico diferencial. Además, los métodos capaces de detección de muerte celular específica in vivo son útiles para el desarrollo de fármacos destinados a la prevención o la inducción de la muerte celular, así como para el análisis de la citotoxicidad de los fármacos recientemente desarrollados.
Existen algunas pruebas clínicas para el diagnóstico de la muerte celular excesiva relacionada con la enfermedad basadas en la detección de marcadores específicos de tejido, tales como, por ejemplo, antígenos, enzimas y otras proteínas en la sangre o en otros fluidos corporales. La medición de la actividad de las enzimas específicas del hígado en la sangre, por ejemplo, es un método ampliamente utilizado para la evaluación de la muerte de hepatocitos (Amacher, et al., Regul Toxicol Pharmacol. Abril, 27 (2) :119-130 (1988) ; Salaspuro, et al., Enzyme. 37 :87-107 (1987) ; Herlong, Hosp. Pract. (Off Ed) 29 (11) :32-38 (1994) ) . La evaluación del nivel de antígenos específicos de cardiomiocitos también se ha utilizado para el diagnóstico del infarto de miocardio (Mair et al., Clin Lab Med. Chem. 37:1077-1084 (1999) ; Nunes et al., Rev Port Cardiol. 20:785-788 (2001) ) . Sin embargo, el número de tales técnicas se limita a enfermedades en las que se conocen un marcador y un método de detección para el análisis para proporcionar resultados específicos de tejido significativos. (Oh S et al., Curr Gastroenterol Rep. 3:1218 (2001) ; Rochling et al., Clin Cornerstone. 3 (6) :1-12 (2001) ) . Otros métodos requieren una biopsia invasiva de tejidos específicos de los que se sospecha que tienen una situación de enfermedad para obtener una muestra para su análisis. Sin embargo, una biopsia de algunos órganos y tejidos, por ejemplo, el cerebro es altamente invasiva y a menudo difícil de realizar.
Es bien sabido que la apoptosis, o muerte celular programada, que es una forma importante de muerte celular en el organismo mamífero, está acompañada por la fragmentación internucleosómica de ADN nuclear. Muchos laboratorios han demostrado que una parte de este ADN aparece en la sangre (Lo YM Ann NY Acad Sci. 945: 1-7 (2001) ; Lichtenstein et al., Ann NY Acad Sci. 945:239-249 (2001) ; Taback et al., Curr Opin Mol Ther. 6:273-278 (2004) ; Bischoff et al., Hum Reprod Update. 8:493-500, (2002) ) . También se ha demostrado que este ADN fragmentado, llamado ADN transrrenal (Tr-ADN) cruza la barrera renal y puede detectarse en la orina. (Botezatu et al., Clin Chem. 46:1078-1084, (2000) ; Su et al., J. Mol Diagn. 6:101-107 (2004) ; Su et al., Ann NY Acad Sci. 1022:81-89 (2004) .
Su, Y. et al., (2003) Annals of the New York Academy of Sciences vol. 3º págs. 81-89 describe que una pequeña porción de ADN de células apoptóticas escapa a la degradación completa, aparece en la sangre en forma de fragmentos de tamaño oligonucleosomal, se excreta en la orina, y se puede utilizar con fines diagnósticos.
Swarup V. et al., (2007) FEBS Letters vol. 581, núm. 5 págs. 795-799, describen cómo se ha informado de que el aumento de los niveles de ácidos nucleicos circulantes en plasma (libres de células) en algunos trastornos clínicos, y sugieren que esto podría proporcionar una herramienta no invasiva para la detección precoz de varias enfermedades humanas.
Aunque tanto el ADN de plasma libre de células y el Tr-ADN se pueden usar como herramientas de diagnóstico, éstos proporcionan un enfoque bastante limitado en la evaluación de los eventos específicos de tejido, tales como la muerte celular. Por lo tanto los métodos de análisis que son no invasivos, y ofrecen una gama más amplia de indicaciones de la patología específica, debido a su capacidad para detectar los niveles de las células que mueren en los tejidos y órganos concretos, serían útiles para el diagnóstico y el seguimiento del estado de diversas enfermedades o afecciones patológicas en los pacientes. Además, los métodos analíticos específicos de tejido que proporcionan los medios para el seguimiento de la respuesta de un paciente a una terapia de la enfermedad serían útiles para determinar la eficacia de la terapia, y en el caso de tratamiento con fármacos, la dosificación óptima requerida para la administración del fármaco.
Para hacer frente a estos problemas, la presente invención se centra en el uso de micro ARN (miARN) como una herramienta de diagnóstico para controlar la muerte celular in vivo en fluidos corporales, tales como, por ejemplo, suero y orina. A diferencia del ADN de plasma libre de células y del Tr-ADN, muchos miARN exhiben perfiles de expresión específicos de células, tejidos y órganos (Liang et al, Genomics, 8: 166 (2007) ; Lukiw et al, Neuroreport. 18:297-300 (2007) ; Lagos-Quintana et al, Curr Biol. 12:735-739 (2002) ; Chen y col., Nat. Genet. 38:228-233 (2006) ; Beuvink et al, J. Nucleic Acids Res. 35:e52 (2007) ) . Por otra parte, se ha demostrado la correlación de los perfiles específicos de miARN de células y tejidos con diferentes patologías y tipos de tumores (Visone R., et al Oncogene. 26:7590-7595 (2007) ; Nelson et al, Neuropathol Exp. Neurol. 66:461-468 (2007) ; Negrini et al, J Cell Sci. 120:1833-1840 (2007) ; Chang et al, Annu Rev. Genómica Hum Genet. 8:215-239 (2007) ; Jay et al, Cell Biol. 26:293300 (2007) ) .
Por lo tanto, la presente invención proporciona métodos para medir in vivo la muerte celular mediante la detección de miARN específicos de tejido, característicos de una patología específica, en fluidos corporales, seleccionados entre sangre, suero y orina. Los presentes métodos basados en la detección de miARN en los fluidos corporales se utilizan para el desarrollo ulterior de pruebas de diagnóstico o de seguimiento.
Compendio de la invención La presente invención... [Seguir leyendo]
Reivindicaciones:
1. Un método de detección y cuantificación de miARN libres de células específicos de células, tejido y/u órganos en el fluido corporal para la evaluación de la muerte celular in vivo en diferentes tejidos y órganos, en donde la muerte celular in vivo está asociada con un trastorno de un tejido y/u órgano concreto que comprende:
el análisis de una muestra de fluido corporal seleccionada entre sangre, suero y orina obtenida de un sujeto para determinar una o más secuencias específicas de miARN, en donde dicho análisis comprende la etapa de detectar dicho miARN con un cebador y/o sonda que es sustancialmente complementario a una parte de dichas secuencias de miARN específicas.
2. El método de la reivindicación 1, en donde la muerte celular in vivo excesiva o insuficiente está asociada con un trastorno de un tejido concreto.
3. El método de la reivindicación 1, en donde dicha etapa de análisis de una muestra incluye una técnica seleccionada del grupo que consiste de hibridación, reacción con sonda por ciclos, reacción en cadena de la polimerasa, reacción en cadena de la polimerasa anidada, PCR para analizar polimorfismos de conformación de cadenas individuales y reacción en cadena de la ligasa.
4. El método de la reivindicación 1, en donde se reduce la degradación del ácido nucleico en una muestra de orina.
5. El método de la reivindicación 4, en donde la reducción de la degradación del ácido nucleico comprende la inhibición de la actividad nucleasa mediante la adición uno o varios inhibidores de ARNasa, la inactivación por calor,
o mediante el tratamiento de dicha muestra de orina con un compuesto seleccionado del grupo que consiste en: guanidina-HCl, isotiocianato de guanidina, N-lauroilsarcosina, y dodecilsulfato de sodio.
6. El método de la reivindicación 1, en donde una muestra de orina obtenida se ha mantenido en la vejiga menos de 12 horas.
7. El método de la reivindicación 1, en donde dicho trastorno es
(a) una infección por patógeno, preferiblemente en donde dicho patógeno es un virus, y más preferiblemente en donde dicho virus es un virus de Epstein-Barr,
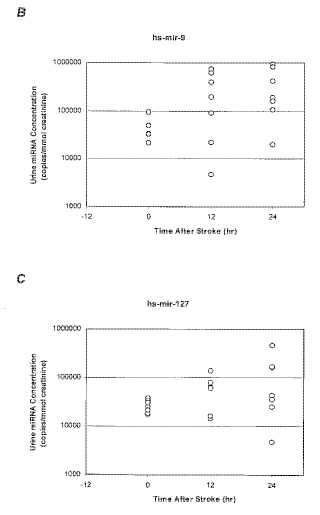
(b) un infarto cerebral,
(c) la enfermedad de Alzheimer,
(d) la enfermedad de Parkinson, o
(e) asociado con el embarazo y/o patología fetal, opcionalmente en donde dicho trastorno fetal es el síndrome de Down.
8. Un método de detección miARN libres de células en orina, que se originan de zonas distintas de sistema urinario, en un sujeto como resultado de un trastorno asociado con la muerte celular excesiva en un tejido u órgano, que comprende:
el análisis de una muestra de orina obtenida de un sujeto para determinar una o más secuencias específicas de miARN en donde dicho análisis comprende la etapa de detectar dicho miARN con un cebador y/o sonda que es sustancialmente complementario a una parte de dichas secuencias de miARN específicas.
9. Un método para el seguimiento de una enfermedad y/o tratamiento en un sujeto, en donde la enfermedad es un trastorno asociado con la muerte celular excesiva o insuficiente en un tejido u órgano, mediante análisis cuantitativo de los miARN libres de células específicas en un fluido corporal, que comprende:
el análisis de muestras de fluido corporal seleccionadas entre sangre, suero y orina, obtenida dicha muestra periódicamente de un sujeto para determinar una o más secuencias específicas de miARN que son específicos de/expresados en exceso en las células, tejido u órgano de interés, en donde dicho análisis comprende la etapa de detectar dichos miARN con cebadores y/o sondas que son sustancialmente complementaria a una parte de dichas secuencias de miARN específicas.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]