Métodos de distinción de isómeros mediante espectrometría de masas.
Un método de distinción de isómeros de dimetilarginina, el cual consiste en:
La ionización de una muestra para generar iones; La selección de iones con una relación masa/carga (miz) en un rango miz; La fragmentación de dichos iones seleccionados para producir iones hijos; y La detección tanto de dimetilarginina asimétrica (AOMA) como de dimetilarginina simétrica (SOMA) en la muestra a través de la detección tanto de una señal miz de iones hijos característica de AOMA, como de una señal miz de iones hijos característica de SOMA, donde la muestra no se somete a separación cromatográfica de forma previa a la ionización de la misma.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/005279.
Solicitante: PerkinElmer Health Sciences, Inc.
Nacionalidad solicitante: Estados Unidos de América.
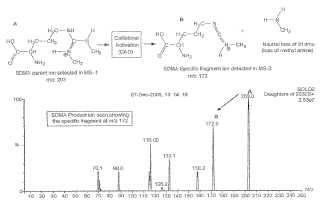
Dirección: 549 Albany Street Boston MA 02118 ESTADOS UNIDOS DE AMERICA.
Inventor/es: CERDA,Blas.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N24/00 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › Investigación o análisis de materiales por utilización de la resonancia magnética nuclear, de la resonancia paramagnética electrónica o de otros efectos de spin.
- G01N33/68 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
PDF original: ES-2392629_T3.pdf
Fragmento de la descripción:
MÉTODOS DE DISTINCiÓN DE ISÓMEROS MEDIANTE ESPECTROMETRíA DE MASAS
La presente invención se refiere, entre otras cosas, a la distinción de isómeros moleculares mediante espectrometría de masas. Por ejemplo, la presente descripción revela un método para la detección de uno o ambos isómeros de dimetilarginina mediante espectrometría de masas en tándem. [0002] Martens -Lobenhoffer et al, Clin Chem vol. 52 nº 3 2006, pp. 488-493 revela un método de distinción de isómeros de dimetilarginina consistente en la ionización de una muestra para generar iones, la selección de iones con una relación masa/carga, la fragmentación de dichos iones seleccionados, así como la detección tanto de ADMA como de SDMA a través de la detección de iones hijos. Dicha publicación revela asimismo un método para diagnosticar una enfermedad caracterizada por la alteración de los niveles de ADMA o SDMA mediante la medición de los niveles de isómeros de dimetilarginina por espectrometría de masas. Esta publicación revela, además, el empleo de la técnica de separación cromatográfica de forma previa a la ionización. [0003] La presente invención proporciona un método para la distinción de isómeros de dimetilarginina, el cual se halla de conformidad con la reivindicación independiente 1. Otro aspecto de la invención se refiere a un método para el diagnóstico de una enfermedad caracterizada por la alteración de los niveles de ADMA o SDMA, conforme a la reivindicación independiente 17, o a un método de evaluación de la respuesta por parte de un determinado sujeto a un agente terapéutico, estando dicho método de conformidad con la reivindicación 22. Otro aspecto de la invención ofrece un kit para la detección de ADMA y SDMA, tal y como se indica en la reivindicación 23. En las reivindicaciones dependientes se describen aspectos adicionales de la invención. [0004] Dichos métodos tienen diversas aplicaciones y se pueden emplear para la detección de dimetilarginina en una muestra (p. ej., una muestra procedente de una síntesis o de un sujeto) . En el marco de los diagnósticos, estos métodos pueden utilizarse para obtener un perfil metabólico para un sujeto (p. ej., un humano) . Un perfil metabólico se trata de información que incluye referencias sobre el estatus de uno o ambos miembros de un par de isómeros de un metabolito, como, por ejemplo, tanto de dimetilarginina asimétrica (ADMA) como de dimetilarginina simétrica (SDMA) , los dos isómeros de dimetilarginina:
(ADMA)
y
""C-NH /
/ \
H, \ H, C-CHz E
/ /1 \
e-CH H-~ CM,
# \ \
o NHa CH:ao
(SDMA)
En algunas realizaciones, un perfil metabólico incluye información sobre otras moléculas, por ejemplo, otros metabolitos. El perfil metabólico resultante puede emplearse para evaluar el estado de salud de un sujeto (p. ej., un humano) , como la presencia o ausencia de una enfermedad, por ejemplo, una enfermedad vascular (p. ej., una enfermedad cardiovascular o hipertensiva) . [0005] En un sentido, la presente invención revela un método para la distinción de isómeros de dimetilarginina. Dicho método comprende los siguientes pasos: la ionización de una muestra para generar iones, la selección de iones con una relación masa/carga (miz) en un rango miz, la fragmentación de dichos iones seleccionados para producir iones hijos, así como la detección tanto de dimetilarginina asimétrica (ADMA) como de dimetilarginina simétrica (SDMA) en la muestra a través de la detección tanto de una señal miz de iones hijos en una miz característica de ADMA, como de una señal miz de iones hijos en una miz característica de SDMA. [0006] En otro sentido, la presente invención revela un método para la distinción de isómeros de dimetilarginina, el cual comprende los siguientes pasos: la ionización de una muestra para generar iones, la selección de iones con una relación masa/carga (miz) en un rango miz, la fragmentación de dichos iones seleccionados para producir iones hijos, así como la detección tanto de la presencia de una señal miz de iones hijos en una miz de aproximadamente 46, como de la presencia de una señal miz de iones hijos en una miz de aproximadamente 172, donde una señal miz de iones hijos en una miz de aproximadamente 46 indica que la muestra está compuesta de dimetilarginina asimétrica (ADMA) , y donde una señal miz de iones hijos en una miz de aproximadamente 172 indica que la muestra está compuesta de dimetilarginina simétrica (SOMA) . El rango miz puede ser de aproximadamente 203. [0007] En otro sentido, la presente invención revela un método para la detección de dimetilarginina simétrica (SOMA) , el cual comprende los siguientes pasos: la ionización de una muestra para generar iones, la selección de iones con una relación masa/carga (miz) en un rango miz, la fragmentación de dichos iones seleccionados para producir iones hijos, así como la detección de dimetilarginina simétrica (SOMA) en la muestra a través de la detección de una señal miz de iones hijos en una miz de aproximadamente 172. El rango miz puede ser de aproximadamente 203. [0008] En otro sentido, la presente invención revela un método de dimetilarginina asimétrica (AOMA) . Oicho método comprende los siguientes pasos: la ionización de una muestra para generar iones, la selección de iones con una relación masa/carga (miz) en un rango miz, la fragmentación de dichos iones seleccionados para producir iones hijos, así como la detección de dimetilarginina asimétrica (AOMA) en la muestra a través de la detección de una señal miz de iones hijos en una miz de aproximadamente 46. El rango miz puede ser de aproximadamente 203. [0009] En algunas realizaciones de los métodos descritos anteriormente, se añade un patrón interno a la muestra de forma previa a la ionización de la misma. El patrón interno puede ser, o contener, un isómero de dimetilarginina que incluya al menos un átomo pesado. El patrón interno puede contener o ser un isómero SOMA de referencia con al menos un átomo pesado y un isómero AOMA de referencia con al menos un átomo pesado, donde los isómeros SOMA y AOMA de referencia tienen pesos atómicos distintos el uno del otro. [0010] En otro sentido, la presente invención revela un método para la detección de isómeros de dimetilarginina, el cual comprende los siguientes pasos: el suministro de una muestra que incluya uno o más patrones internos, donde al menos un patrón interno sea un isómero de dimetilarginina que contenga al menos un átomo pesado; la ionización de una muestra para generar iones; la selección de iones con un rango miz que se corresponda con el rango adecuado para aislar isómeros de dimetilarginina (p. ej., obtenidos de manera natural) y la selección de iones en uno o más rangos miz adicionales, siendo los rangos adecuados para aislar dicho o dichos patrones internos; la fragmentación de los iones seleccionados para producir iones hijos; la detección de dimetilarginina asimétrica (AOMA) ylo dimetilarginina simétrica (SOMA) en la muestra a través de la detección de una o más señales miz de iones hijos características de AOMA ylo una o más señales miz de iones hijos características de SOMA mediante el empleo de los iones hijos; y la detección de uno o más patrones internos.
En algunas realizaciones, el rango miz que se corresponde con el rango adecuado para aislar isómeros de dimetilarginina es de aproximadamente 203. En algunas realizaciones, la muestra incluye un primer patrón interno que se trata de un isómero SDMA con al menos un átomo pesado y un segundo patrón interno que se trata de un isómero ADMA con al menos un átomo pesado, donde los isómeros SDMA y ADMA tienen diferentes pesos atómicos. En algunas realizaciones, la muestra incluye un primer patrón interno que se trata de un isómero SDMA con al menos un átomo pesado y un segundo patrón interno que se trata de un isómero ADMA con al menos un átomo pesado, donde los isómeros SDMA y ADMA tienen el mismo peso atómico. [0012] En algunas realizaciones de los métodos descritos anteriormente, el método puede incluir asimismo el paso consistente en medir el nivel de SDMA ylo ADMA en la muestra. [0013] En algunas realizaciones de los métodos descritos anteriormente, la muestra que se ioniza puede tratarse de una muestra biológica. La muestra biológica puede ser, o contener, sangre, suero, plasma, linfa, líquido amniótico, saliva, líquido cefalorraquídeo, secreción lagrimal, mucosidad, orina, esputo o sudor. [0014] En algunas realizaciones de los métodos descritos anteriormente, la muestra que se ioniza puede contener... [Seguir leyendo]
Reivindicaciones:
1. Un método de distinción de isómeros de dimetilarginina, el cual consiste en: La ionización de una muestra para generar iones; La selección de iones con una relación masa/carga (miz) en un rango miz; La fragmentación de dichos iones seleccionados para producir iones hijos; y La detección tanto de dimetilarginina asimétrica (AOMA) como de dimetilarginina simétrica (SOMA) en la muestra a través de la detección tanto de una señal miz de iones hijos característica de AOMA, como de una señal miz de iones hijos característica de SOMA, donde la muestra no se somete a separación cromatográfica de forma previa a la ionización de la misma.
2. El método según la reivindicación 1, donde la detección tanto de una señal miz de iones hijos característica de AOMA, como de una señal miz de iones hijos característica de SOMA comprende la detección tanto de la presencia de una señal miz de iones hijos en una miz de aproximadamente 46, como de la presencia de una señal miz de iones hijos en una miz de aproximadamente 172, donde una señal miz de iones hijos en una miz de aproximadamente 46 indica que la muestra está compuesta de dimetilarginina asimétrica (AOMA) , y donde una señal miz de iones hijos en una miz de aproximadamente 172 indica que la muestra está compuesta de dimetilarginina simétrica (SOMA) .
3. El método según las reivindicaciones 1 o 2, donde el rango miz es de aproximadamente 203.
4. El método según las reivindicaciones 1 a 3, donde la muestra comprende uno o más patrones internos y donde al menos un patrón interno es un isómero de dimetilarginina que contiene al menos un átomo pesado.
5. El método según la reivindicación 4, donde éste comprende:
La selección de iones con un rango miz que se corresponda con el rango adecuado para aislar isómeros de dimetilarginina y la selección de iones en uno o más rangos miz adicionales, siendo los rangos adecuados para aislar dicho o dichos patrones internos; y La detección de uno o más patrones internos.
6. El método según la reivindicación 5, donde la muestra incluye un primer patrón interno que se trata de un isómero SOMA con al menos un átomo pesado y un segundo patrón interno que se trata de un isómero AOMA con al menos un átomo pesado, donde los isómeros SOMA y AOMA tienen diferentes pesos atómicos.
7. El método según la reivindicación 5, donde la muestra incluye un primer patrón interno que se trata de un isómero SOMA con al menos un átomo pesado y un segundo patrón interno que se trata de un isómero AOMA con al menos un átomo pesado, donde los isómeros SOMA y AOMA tienen el mismo peso atómico.
8. El método según las reivindicaciones 1 a 7, que incluye asimismo la medición del nivel tanto de SOMA como de AOMA en la muestra.
9. El método según las reivindicaciones 1 a 8, donde la muestra que se ioniza se trata de una muestra biológica.
10. El método según las reivindicaciones 1 a 9, donde uno o más analitos son detectados.
11. El método según la reivindicación 10, donde dichos analitos son biomoléculas metabólicas.
12. El método según las reivindicaciones 10 u 11, donde dichos analitos se seleccionan a partir del grupo compuesto de aminoácidos yacilcarnitinas.
13. El método según las reivindicaciones 10 u 11, donde dichos analitos se seleccionan a partir del grupo compuesto de citrulina, dimetilamina, arginina, ornitina, homocisteína y creatina.
14. El método según las reivindicaciones 1 a 13, donde la muestra no se modifica químicamente de forma previa a la ionización de la misma.
15. El método según las reivindicaciones 1 a 14, donde se mide el nivel de una señal en una miz de aproximadamente 46, así como el de una señal en una miz de aproximadamente 172,
16. El método según las reivindicaciones 1 a 15, donde la muestra incluye ácido oxálico.
17. Un método para diagnosticar una enfermedad caracterizada por la alteración de
los niveles de AOMA o SOMA, el cual consiste en: El suministro de una muestra biológica procedente de un sujeto; La ionización de dicha muestra biológica para generar iones; La selección de iones con una relación masa/carga (miz) en un rango miz; La fragmentación de dichos iones seleccionados para producir iones hijos; y La medición del nivel de AOMA como una función de una señal miz de iones hijos en una miz de aproximadamente 46 y del nivel de SOMA como una función de una señal miz de iones hijos en una miz de aproximadamente 172, donde la alteración del nivel tanto de AOMA como de SOMA en la muestra biológica en relación con el nivel en una muestra de referencia constituye una indicación de que el sujeto padece, o se halla en riesgo de desarrollar, una enfermedad caracterizada por la alteración de los niveles de AOMA o SOMA, donde dicha enfermedad caracterizada por la alteración de los niveles de AOMA o SOMA es preeclampsia, aterosclerosis, diabetes, hipercolesterolemia, insuficiencia renal o hipertensión, y donde la muestra biológica no se somete a separación cromatográfica de forma previa a la ionización de la misma.
18. El método según la reivindicación 17, donde la enfermedad caracterizada por la alteración de los niveles de AOMA o SOMA es preeclampsia.
19. El método según las reivindicaciones 17 o 18, que incluye asimismo la adición de ácido oxálico a la muestra biológica.
20. Un método de evaluación de la respuesta por parte de un determinado sujeto a un agente terapéutico, el cual consiste en:
El suministro de una muestra biológica procedente de un sujeto tratado con un agente terapéutico; La ionización de dicha muestra biológica para generar iones; La selección de iones con una relación masa/carga (miz) en un rango miz; La fragmentación de dichos iones seleccionados para producir iones hijos; y La medición tanto del nivel de AOMA como una función de una señal miz de iones hijos en una miz de aproximadamente 46, como del nivel de SOMA como una función de una señal miz de iones hijos en una miz de aproximadamente 172, donde la muestra biológica no se somete a separación cromatográfica de forma previa a la ionización de la misma, y donde el mismo nivel o el incremento del nivel tanto de AOMA como de SOMA en la muestra biológica en relación con el nivel en una muestra biológica del sujeto obtenida de forma previa al tratamiento constituye una indicación de que el sujeto no responde a dicho tratamiento, y donde el descenso del nivel tanto de AOMA como de SOMA en la muestra biológica en relación con la muestra biológica del sujeto obtenida de forma previa al tratamiento constituye una indicación de que el sujeto sí responde a dicho tratamiento.
21. El método según la reivindicación 20, que incluye asimismo la adición de ácido oxálico a la muestra biológica.
22. El método según las reivindicaciones 17 a 21, donde el sujeto es un humano.
23. Un kit para la detección de dimetilarginina asimétrica (AOMA) y dimetilarginina simétrica (SOMA) , el cual comprende tanto AOMA como SOMA, donde tanto AOMA como SOMA incluyen al menos un isótopo de átomo pesado, y ácido oxálico.
Patentes similares o relacionadas:
Inmunomoduladores, del 29 de Julio de 2020, de BRISTOL-MYERS SQUIBB COMPANY: Un compuesto de la fórmula (I) **(Ver fórmula)** o una sal farmacéuticamente aceptable del mismo, en donde: A se selecciona de **(Ver fórmula)** en donde: […]
Métodos y composiciones para el diagnóstico y pronóstico de lesión renal e insuficiencia renal, del 29 de Julio de 2020, de Astute Medical, Inc: Un método para evaluar el estado renal en un sujeto, que comprende: realizar una pluralidad de ensayos configurados para detectar una […]
Neuregulina para tratar la insuficiencia cardíaca, del 29 de Julio de 2020, de Zensun (Shanghai) Science & Technology, Co., Ltd: Neuregulina para usar en un método para tratar la insuficiencia cardíaca crónica en un paciente, donde el paciente tiene un nivel plasmático de NT-proBNP […]
Procedimiento para evaluación de la función hepática y el flujo sanguíneo portal, del 15 de Julio de 2020, de The Regents of the University of Colorado, a body corporate: Procedimiento in vitro para la estimación del flujo sanguíneo portal en un individuo a partir de una única muestra de sangre o suero, comprendiendo el procedimiento: […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Método para llevar a cabo el seguimiento de la enfermedad de Gaucher, del 15 de Julio de 2020, de Centogene GmbH: Un método para determinar la evolución de la enfermedad de Gaucher en un sujeto, que comprende la etapa de determinar en varios puntos en el […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos de monitorización terapéutica de profármacos de ácido fenilacético, del 24 de Junio de 2020, de Immedica Pharma AB: Glicerilo tri-[4-fenilbutirato] (HPN-100) para su uso en un método para tratar un trastorno del ciclo de la urea en un sujeto que tiene discapacidad […]