METODOS Y DISPOSITIVOS PARA LA ELIMINACION DE PSORALENOS DE PRODUCTOS SANGUINEOS.
SE DESCRIBEN METODOS Y DISPOSITIVOS PARA LA ELIMINACION DE PSORALENO Y PRODUCTOS DE PSORALENO DE PRODUCTOS SANGUINEOS.
LOS METODOS INCLUYEN PONER EN CONTACTO UN PRODUCTO SANGUINEO TRATADO CON PSORALENO Y RADIACION CON UNA RESINA CAPAZ DE ABSORBER PSORALENOS Y FOTOPRODUCTOS DE PSORALENO. EL PROCESO DE ELIMINACION ES PARTICULARMENTE ADECUADO PARA SU UTILIZACION CON CONCENTRADOS DE PLAQUETAS Y DE PLASMA PUESTO QUE EL PROCESO NO EJERCE UN EFECTO ADVERSO SIGNIFICATIVO SOBRE LA FUNCION DE LOS FACTORES DE COAGULACION. LOS METODOS Y DISPOSITIVOS PUEDEN SER INCORPORADOS CON SISTEMAS DE AFERESIS Y OTROS DISPOSITIVOS Y PROCEDIMIENTOS UTILIZADOS HABITUALMENTE PARA PROCESAR PRODUCTOS SANGUINEOS PARA TRANSFUSION
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US96/09846.
Solicitante: CERUS CORPORATION.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: SUITE 300, 2525 STANWELL DRIVE,CONCORD, CA 94520.
Inventor/es: HEI,DEREK,J.
Fecha de Publicación: .
Fecha Concesión Europea: 9 de Diciembre de 2009.
Clasificación Internacional de Patentes:
- A61K35/14 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 35/00 Preparaciones medicinales que contienen sustancias de constitución indeterminada o sus productos de reacción. › Sangre; Sangre artificial (perfluorocarbonos A61K 31/02; sangre del cordón umbilical A61K 35/51; hemoglobina A61K 38/42).
- A61L2/00P2R2
- A61M1/36R
Clasificación PCT:
- A61L2/00 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › Procedimientos o aparatos para desinfectar o esterilizar materiales u objetos distintos a los productos alimenticios y a las lentes de contacto; Sus accesorios (pulverizadores de desinfectantes A61M; esterilización de envases o del contenido del envase asociado a su contenedor B65B 55/00; tratamiento del agua, agua residual o de alcantarilla C02F; desinfección del papel D21H 21/36; dispositivos de desinfección para retretes E03D; artículos que incluyen accesorios para la desinfección, ver las subclases apropiadas para estos artículos, p. ej. H04R 1/12).
- B01D61/00 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › Procedimiento de separación que utilizan membranas semipermeables, p. ej. diálisis, ósmosis o ultrafiltración; Aparatos, accesorios u operaciones auxiliares, especialmente adaptados para ello (separación de gases o vapores por difusión B01D 53/22).
- C12M1/12 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12M EQUIPOS PARA ENZIMOLOGIA O MICROBIOLOGIA (instalaciones para la fermentación de estiércoles A01C 3/02; conservación de partes vivas de cuerpos humanos o animales A01N 1/02; aparatos de cervecería C12C; equipos para la fermentación del vino C12G; aparatos para preparar el vinagre C12J 1/10). › C12M 1/00 Equipos para enzimología o microbiología. › con medios de esterilización, filtración o diálisis.
Clasificación antigua:
- B01D61/00 B01D […] › Procedimiento de separación que utilizan membranas semipermeables, p. ej. diálisis, ósmosis o ultrafiltración; Aparatos, accesorios u operaciones auxiliares, especialmente adaptados para ello (separación de gases o vapores por difusión B01D 53/22).
- C12M1/12 C12M 1/00 […] › con medios de esterilización, filtración o diálisis.
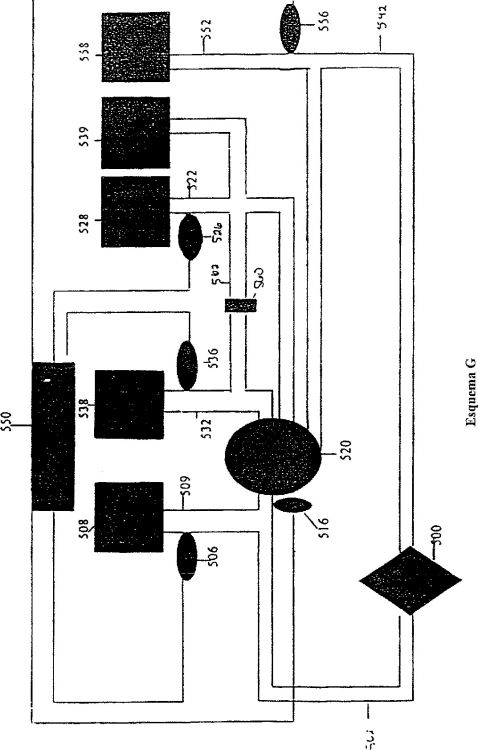
Fragmento de la descripción:
Métodos y dispositivos para la eliminación de psoralenos de productos sanguíneos.
Campo de la invención
La presente invención se refiere a métodos y dispositivos para la eliminación de sustancias de productos sanguíneos y particularmente a métodos y dispositivos para la eliminación de psoralenos y fotoproductos de psoralenos de plasma que contiene plaquetas sin afectar considerablemente la función plaquetaria.
Antecedentes
La contaminación por agentes patógenos dentro del suministro de sangre sigue siendo un problema médico importante en todo el mundo. Aunque los métodos de ensayo mejorados para la hepatitis B (HBV), hepatitis C (HCV) y HIV han reducido notablemente la incidencia de enfermedades asociadas a las transfusiones, el público está perdiendo confianza en la seguridad del suministro de sangre debido a la publicidad de casos de transmisión de estos virus relacionada con las transfusiones.
Por ejemplo, la reciente introducción de una prueba sanguínea para HCV reducirá la transmisión de este virus; sin embargo, solamente posee una sensibilidad de 67% para la detección de unidades sanguíneas infecciosas probables. El HCV es responsable del 90% de la hepatitis asociada a transfusiones. Melnick, J.L., Abstracts of Virological Safety Aspects of Plasma, Cannes, 3-6 de noviembre (1992) (página 9). Se estima que, con la prueba implementada, el riesgo de infección es de 1 en 3300 unidades transfundidas.
Similarmente, si bien se implementan ensayos serológicos más sensibles para HIV-1 y HBV, a pesar de ello estos agentes pueden ser transmitidos por donantes de sangre seronegativos. International Forum: Vox Sang 32:346 (1977). Ward, J.W., et al., N. Engl. J. Med., 318:473 (1988). Hasta un 10% del total de hepatitis relacionada con transfusiones y el 25% de los casos de ictericia severos se deben al HBV transmitido por donantes negativos del antígeno de superficie de la hepatitis B (HBasAg). Hasta ahora, el Centro de Control de Enfermedades (CDC) ha informado sobre quince casos de infecciones con HIV asociadas a transfusión entre receptores de sangre previamente ensayada como negativa para el anticuerpo contra el HIV-1.
Además, otros virus, bacterias y agentes no se ensayan rutinariamente, y siguen siendo una potencial amenaza para la seguridad de las transfusiones. Schmunis, G.A., Transfusion 31:547-557 (1992). Además, los ensayos no asegurarán la seguridad del suministro de sangre contra futuros agentes patógenos desconocidos que puedan ingresar a la población donante dando como resultado la transmisión asociada a la transfusión antes de que se puedan implementar pruebas sensibles.
Aún si las pruebas de seroconversión fueran un control suficiente, pueden no ser prácticas en la aplicación. Por ejemplo, el CMV (un virus del herpes) y el parvovirus B19 en seres humanos, son comunes. Cuando aparecen en adultos sanos e inmunocompetentes, casi siempre resultan en seroconversión asintomática. Debido a que una proporción tan grande de la población es seropositiva, la exclusión de unidades positivas produciría una limitación considerable del suministro de sangre.
Un abordaje alternativo para eliminar la transmisión de enfermedades virales a través de los productos sanguíneos es desarrollar un medio para inactivar agentes patógenos en productos de transfusión. El desarrollo de una tecnología efectiva para inactivar agentes patógenos infecciosos en productos sanguíneos ofrece el potencial de mejorar la seguridad del suministro de sangre, y tal vez hacer más lenta la introducción de nuevas pruebas, tal como la recientemente introducida prueba del HIV-2, para agentes patógenos de baja frecuencia. En última instancia, la tecnología de descontaminación podría reducir considerablemente el costo de los productos sanguíneos e incrementar la disponibilidad de productos sanguíneos escasos.
Para que sea útil, semejante método de inactivación i) no debe afectar negativamente la función para la que el producto sanguíneo es transfundido, ii) debe inactivar completamente los agentes patógenos existentes en el producto sanguíneo y iii) no debe afectar negativamente a los receptores del producto sanguíneo. Se han informado varios métodos para la inactivación o eliminación de agentes virales en productos sanguíneos libres de eritrocitos. Sin embargo, la mayoría de estas técnicas son completamente incompatibles con el mantenimiento de la función de las plaquetas, un producto sanguíneo importante. Los ejemplos de estas técnicas son: calor (Hilfenhous, J., et al., J. Biol. Std. 70:589 (1987)), tratamiento con disolventes/detergentes (Horowitz. B., et al., Transfusion 25:516 (1985)), irradiación gamma (Moroff. G.. et al.. Transfusion 26:453 (1986)), radiación UV combinada con beta propriolactona (Prince A.M., et al., Reviews of Infect. Diseases 5:92-107 (1983)), luz láser visible en combinación con hematoporfirinas (Matthews J.L., et al., Transfusion 28:81-83 (1988); North J., et al., Transfusion 32:121-128 (1992)), uso de los colorantes fotoactivos ftalocianina de aluminio y merocianina 540 (Sieber F., et al., Blood 73:345-350 (1989); Rywkin S., et al., Blood 78(Suppl I):352a (Abstract) (1991)) o radiación UV sola (Proudouz, K.N., et al., Blood 70:589 (1987)).
Otros métodos inactivan agentes virales por tratamiento con furocumarinas tales como psoralenos en presencia de luz ultravioleta. Los psoralenos son compuestos tricíclicos formados por condensación lineal de un anillo de furano con una cumarina. Los psoralenos se pueden intercalar entre los pares de bases de ácidos nucleicos de doble hebra formando aductos covalentes con bases pirimidínicas por absorción de luz ultravioleta de onda larga (UVA). G. D. Cimino et al., Ann. Rev. Biochem. 54:1151 (1985); Hearst et al., Quart. Rev. Biophys. 17:1 (1984). Si hay una segunda pirimidina adyacente a un monoaducto de psoraleno-pirimidina y en la cadena opuesta, la absorción de un segundo fotón puede conducir a la formación de un diaducto que actúa como un entrecruzamiento entre cadenas. Se incorporan a la presente memoria como referencia S. T. Isaacs et al., Biochemistry 16:1058 (1977); S. T. Isaacs et al., Trends in Photobiology (Plenum) páginas 279-294 (1982), J. Tessman et al., Biochem. 24:1669 (1985), Hearst et al., Patentes Estadounidenses Nos. 4.124.598, 4.169.204 y 4.196.281.
Los psoralenos unidos covalentemente actúan como inhibidores de la replicación de ADN y tienen así el potencial de interrumpir el proceso de replicación. Debido a esta capacidad de unirse al ADN, los psoralenos son de particular interés con relación a la resolución de los problemas inherentes a la creación y mantenimiento de un suministro de sangre libre de patógenos. Se ha demostrado que algunos psoralenos conocidos inactivan virus en algunos productos sanguíneos. H. J. Alter et al., The Lancet, (ii:1446) (1988); L. Lin et al., Blood 74:517 (1989) (concentrados descontaminantes de plaquetas); G. P. Wisehahn et al., Patentes Estadounidenses Nos. 4.727.027 y 4.748.120, incorporadas a la presente memoria como referencia, describen el uso de una combinación de 8-metoxipsoraleno (8-MOP) e irradiación. P. Morel et al., Blood Cells 18:27 (1992), demuestran que 300 µg/ml de 8-MOP junto con 10 horas de irradiación con luz ultravioleta pueden inactivar eficazmente virus en suero humano. Otros investigadores han presentado estudios similares que utilizan 8-MOP y aminometiltrimetil psoraleno (AMT). Dodd RY et al., Transfusion 31:483-490 (1991); Margols-Nunno, H. et al., Thromb Haemostas 65:1162 (Abstract) (1991). En efecto, se ha establecido la fotoinactivación de un amplio espectro de microorganismos, incluidos HBV, HCV y HIV, en condiciones diferentes de las usadas en la presente invención y usando derivados de psoraleno previamente conocidos. [Hanson, C. V., Blood Cells, 18:7-24 (1992); Alter, H. Et al., The Lancet ii: 1446 (1989); Margolis-Nunno, H et al., Thromb Haemostas 65:1162 (Abstract) (1991)].
La fotoinactivación por psoralenos es sólo factible si la capacidad del psoraleno de inactivar virus es suficiente para asegurar un margen de seguridad en el que se producirá la inactivación completa. Por otra parte, el psoraleno no debe ser tal que pueda causar un daño a los productos sanguíneos. Los métodos recién descritos, cuando se aplican utilizando psoralenos conocidos, requieren el uso de procedimientos difíciles y caros para evitar ocasionar daños a los productos sanguíneos. Por ejemplo, algunos compuestos y protocolos han requerido la eliminación...
Reivindicaciones:
1. Un recipiente para utilizar en la eliminación de al menos una sustancia seleccionada de psoraleno y su fotoproducto de un producto sanguíneo, que comprende:
a) una envoltura biocompatible;
b) una resina capaz de eliminar el psoraleno o su fotoproducto de un producto sanguíneo, estando dicha resina contenida dentro de dicha envoltura biocompatible; y
c) un medio para retener dicha resina dentro de dicha envoltura biocompatible,
donde la resina comprende una resina adsorbente de poliestireno hiper-reticulado que se produce entrecruzando cadenas de poliestireno lineales en solución o en un estado hinchado con un agente bifuncional para producir puentes reticulantes conformacionalmente restringidos, y que no requiere prehumectación para la adsorción; y tal que el producto sanguíneo tras la eliminación de la sustancia es apropiado para el uso in vivo, y donde el recipiente es un dispositivo de eliminación por lotes.
2. El recipiente de la reivindicación 1, en el que dicho medio de retención comprende un recinto de malla dispuesto dentro de dicha envoltura biocompatible, conteniendo dicho recinto de malla dicha resina y adaptado para permitir que el producto sanguíneo se ponga en contacto con dicha resina.
3. El recipiente de la reivindicación 1, en el que dicho medio de retención comprende un filtro de malla colocado en una línea de entrada/salida y en comunicación fluida con dicha envoltura biocompatible.
4. El recipiente de la reivindicación 1, en el que la resina es no iónica, macroporosa y macrorreticular.
5. El recipiente de la reivindicación 1, en el que la resina comprende una red de poliestireno reticulada con dicloruro de p-xileno, éter monoclorodimetílico, 1,4-bisclorometildifenilo, 4,4'-bis-(clorometil)bifenilo, dimetilformal, p,p'-bisclorometil-1,4-difenilbutano o tris-(clorometil)-mesitileno.
6. El recipiente de la reivindicación 1, en el que el medio para retener la resina es una red de fibras.
7. El recipiente de la reivindicación 6, en el que la resina se adhiere a fibras de la red de fibras.
8. El recipiente de la reivindicación 1, en el que la envoltura biocompatible comprende una bolsa de sangre.
9. El recipiente de la reivindicación 4, en el que la resina es: un copolímero poliaromático con puente metilénico de estireno y divinilbenceno que posee una superficie media de 1100 m2/g y un diámetro de poro medio de 46 Å y un diámetro de tamaño de partículas en el intervalo de 300 a 850 µm.
10. Un método para utilizar un recipiente de acuerdo con una cualquiera de las reivindicaciones anteriores, donde el método comprende añadir un producto sanguíneo que contiene el psoraleno o su fotoproducto al recipiente para ponerse en contacto con la resina, y adsorber al menos una porción de dicho psoraleno o su fotoproducto del producto sanguíneo en la resina.
11. El método de la reivindicación 10, en el que el psoraleno es un aminopsoraleno.
12. El método de la reivindicación 11, en el que el aminopsoraleno es 4'-(4-amino-2-oxa)butil-4,5',8-trimetilpsoraleno.
13. El método de la reivindicación 10, en el que el psoraleno es un psoraleno bromado.
14. El método de la reivindicación 10, en el que el psoraleno es una amina cuaternaria.
15. El método de la reivindicación 14, en el que el psoraleno con función amina cuaternaria es 4'-(trietilamino)metil-4,5',8-trimetilpsoraleno.
16. El método de una cualquiera de las reivindicaciones 10 a 15, en el que el producto sanguíneo es un producto sanguíneo plaquetario y en el que el recipiente es además para utilizar en la eliminación por lotes de dicho psoraleno o su fotoproducto del producto sanguíneo plaquetario.
17. El método de una cualquiera de las reivindicaciones 10 a 15, en el que el producto sanguíneo es un producto sanguíneo plasmático y en el que el recipiente es para utilizar en la eliminación por lotes de dicho psoraleno o su fotoproducto del producto sanguíneo plasmático.
18. El método de la reivindicación 10, en el que el adsorbente posee una capacidad suficiente de adsorción tal que el contacto de dicho producto sanguíneo con dicho aparato elimina dicho psoraleno a un nivel tal que menos del 1% de la cantidad original del psoraleno añadido al producto sanguíneo permanece como sustancia libre.
19. El método de la reivindicación 10 a 15, en el que el producto sanguíneo es un producto sanguíneo con glóbulos rojos.
20. El método de una cualquiera de las reivindicaciones 10 a 19 para formar un producto sanguíneo.
Patentes similares o relacionadas:
Sorbente polimérico para la eliminación de impurezas de sangre completa y productos sanguíneos, del 17 de Junio de 2020, de Cytosorbents Corporation: Un método para tratar la sangre y los productos sanguíneos almacenados que maximiza la vida útil y/o minimiza una complicación relacionada con la transfusión […]
Método para activar células T auxiliares, del 10 de Junio de 2020, de OTSUKA PHARMACEUTICAL CO., LTD.: Una composición para su uso en el tratamiento o prevención del cáncer mediante la activación de células T auxiliares en un sujeto, en donde dicha composición […]
Composiciones, usos y preparación de lisados de plaquetas, del 27 de Mayo de 2020, de EMORY UNIVERSITY: Una composición que comprende componentes de lisado de plaquetas con una concentración de fibrinógeno de menos de 20 μg/ml.
Procedimiento para obtener células dendríticas inmunoestimulantes, del 4 de Marzo de 2020, de Transimmune AG: Un procedimiento para inducir la diferenciación de monocitos contenidos en una cantidad extracorpórea de una muestra de sangre de sujeto mamífero en células […]
Inmunoterapia mediante la utilización de células capaces de co-expresar un antígeno diana y CD1d y pulsadas con un ligando de CD1d, del 8 de Enero de 2020, de RIKEN: Un inmunoinductor para un antígeno diana, que comprende una célula que co-expresa antígeno diana y CD1d, en donde el antígeno diana y la célula […]
Péptidos terapéuticos, del 25 de Diciembre de 2019, de DANA-FARBER CANCER INSTITUTE, INC.: Composición que comprende un anticuerpo o fragmento de anticuerpo que se une inmunoespecíficamente a la secuencia A relacionada con polipéptido de clase I de […]
Propiedades inmunomoduladoras de las células progenitoras adultas multipotentes y usos de las mismas, del 25 de Diciembre de 2019, de ABT Holding Company: Células para la utilización en la prevención o tratamiento complementario de un neoplasma benigno de células de médula ósea, un trastorno mieloproliferativo, un […]
Tratamiento del cáncer utilizando un receptor de antígeno quimérico anti-CD19 humanizado, del 10 de Diciembre de 2019, de NOVARTIS AG: Dominio de unión anti-CD19 humanizado, en el que dicho dominio de unión anti-CD 19 humanizado comprende una secuencia de aminoácidos de un scFv seleccionada de […]