METODO DE SELECCION, PROCESO PARA LA PURIFICACION DE OLIGOMEROS DE A-BETA NO-DIFUSIBLES, ANTICUERPOS SELECTIVOS CONTRA DICHOS OLIGOMEROS DE A-BETA NO-DIFUSIBLES Y UN PROCESO PARA LA FABRICACION DE DICHOS ANTICUERPOS.
Método de detección de auto-anticuerpos que tienen especificidad por el epitope de estructura de oligómero de Aß(X-38 .
. 43) globular no-difusible en una muestra derivada de un sujeto, método que comprende el contacto de la muestra con el oligómero de Aß(X-38 .. 43) globular no-difusible o un derivado marcado o reticulado de este, en donde X se selecciona del grupo que consiste de los números 1 .. 24, y la detección de un complejo formado por el anticuerpo y el oligómero o derivado, la presencia del complejo que indica la presencia de los auto-anticuerpos
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2006/001984.
Solicitante: ABBOTT GMBH & CO. KG.
Nacionalidad solicitante: Alemania.
Dirección: MAX-PLANCK-RING 2,65205 WIESBADEN.
Inventor/es: KELLER, PATRICK, HILLEN, HEINZ, EBERT, ULRICH, STRIEBINGER,ANDREAS, BARGHORN,STEFAN.
Fecha de Publicación: .
Fecha Concesión Europea: 24 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07K14/47A3
- C07K16/18 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra materiales animales o humanos.
Clasificación PCT:
- A61K38/17 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › que provienen de animales; que provienen de humanos.
- C07K14/47 C07K […] › C07K 14/00 Péptidos con más de 20 aminoácidos; Gastrinas; Somatostatinas; Melanotropinas; Sus derivados. › de mamíferos.
- C07K16/18 C07K 16/00 […] › contra materiales animales o humanos.
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Fragmento de la descripción:
Método de selección, proceso para la purificación de oligómeros de Aß no-difusibles, anticuerpos selectivos contra dichos oligómeros de Aß no-difusibles y un proceso para la fabricación de dichos anticuerpos.
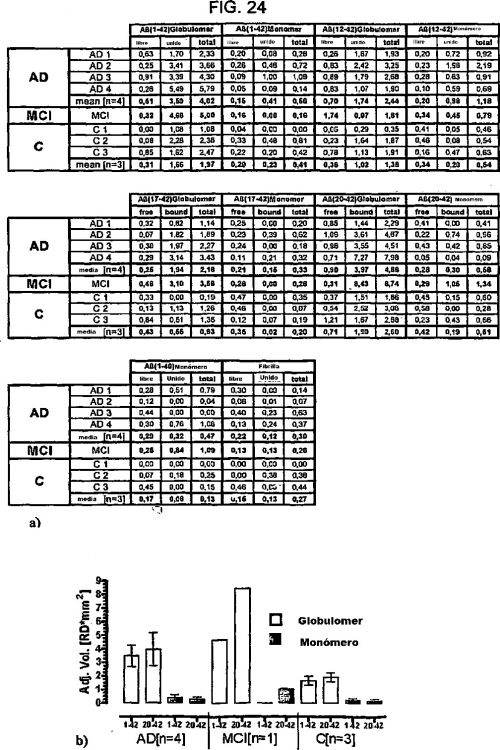
La presente invención se relaciona con los métodos de selección de auto-anticuerpos que tienen especificidad por el epitope de estructura de oligómero de Aß(X-38.. 43) globular no-difusible ("globulomer.").
La enfermedad de Alzheimer (AD) es un trastorno de demencia y neurodegenerativo común caracterizado por una pérdida progresiva de habilidades cognitivas y por rasgos neuropatológicos característicos que comprenden depósitos amiloides extracelulares, ovillos neurofibrilares intracelulares y pérdida neuronal en varias regiones del cerebro (Mattson, M.P. Pathways towards and away from Alzheimer's disease. Nature 430, 631-639 (2004); Hardy, J. & Selkoe, D.J. The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science 297, 353-356 (2002)). Los constituyentes principales de los depósitos amiloides son péptidos ß amiloides.
Una de las características de la patología en la enfermedad de Alzheimer es la excesiva formación de amiloide ß (Aß) 1-42 que se agrega y es el principal constituyente de las placas características. El Aß(1-42) se deriva de la proteína precursora del amiloide (APP), y el procesamiento anormal de APP, que conduce a una mayor producción de Aß(1-42), ha sido un objeto de investigación intensiva en el pasado. La hipótesis de la cascada amiloide por Hardy y Higgins (Hardy, J.A. & Higgins, G.A. Alzheimer's disease: the amyloid cascade hypothesis. Science 256, 184-185 (1992)) postuló que el aumento de la producción de Aß(1-42) conduce a su agregación en fibrillas de tamaño aumentado (iniciando con las así llamadas protofibrilllas) y en última instancia, a depósitos como placas, y esos depósitos fibrosos de Aß son la causa de los síntomas neuropatológicos en la enfermedad de Alzheimer. Esta hipótesis fue la más favorecida, hasta hace poco, aunque la correlación de la demencia y la carga de placa amiloide es más bien pobre en pacientes con AD (Katzman, R. et al. Clinical, pathological, and neurochemical changes in dementia: a subgroup with preserved mental status and numerous neocortical plaques. Ann Neurol 23, 138-144 (1988); Naslund, J. et al. Correlation between elevated levels of amyloid beta-peptide in the brain and cognitive decline. JAMA 283, 1571-1577 (2000)). Es de destacar que hallazgos similares se han realizado en el síndrome de Down, lo que sugiere la intervención de los mismos mecanismos.
Los oligómeros, en primer lugar, descritos sólo como intermedios del proceso de formación de fibrillas y placas, se han discutido recientemente como importantes especies tóxicas a lo largo de la patología AD. La aparición de Aß oligomérico, soluble en el cerebro de pacientes con AD (Kuo, Y.M. et al. Water-soluble Abeta (N-40, N-42) oligomers in normal and Alzheimer disease brains. J Biol Chem 271, 4077-4081 (1996)) se correlaciona mejor con los síntomas de AD que los de la carga de placa (Kuo, Y.M. et al. Watersoluble Abeta (N-40, N-42) oligomers in normal and Alzheimer disease brains. J Biol Chem 271, 4077-4081 (1996); McLean, C.A. et al. Soluble pool of Abeta amyloid as a determinant of severity of neurodegeneration in Alzheimer's disease. Ann Neurol 46, 860-866 (1999)). Esto ha llevado a que se revise la hipótesis de la cascada amiloide (Hardy, J. & Selkoe, D.J. The amyloid hypothesis of Alzheimers disease: progress and problems on the road to therapeutics. Science 297, 353-356 (2002)).
La posibilidad de que agrupaciones solubles como el globulomer de Aß(1-42), en lugar de aglomerados fibrilares insolubles, pueden inducir alteraciones neuronales tempranas en AD ha ganado mucha atención dado que las observaciones iniciales de una correlación robusta entre los niveles corticales de Aß prefibrilar soluble y el grado de pérdida neuronal y la severidad de deficiencia cognitiva (McLean, C.A. et al. Soluble pool of Abeta amyloid as a determinant of severity of neurodegeneration in Alzheimer's disease. Ann Neurol 46, 860-866 (1999); Lue, L.F. et al. Soluble amyloid beta peptide concentration as a predictor of synaptic change in Alzheimer's disease. Am J Pathol. 155, 853-862 (1999); Wang, J., Dickson, D.W., Trojanowski, J.Q. & Lee, V.M. The levels of soluble versus insoluble brain A beta distinguish Alzheimer's disease from normal and pathologic aging. Exp Neurol 158, 328-337 (1999)).
Un trabajo reciente mostró la posibilidad de generar formas oligoméricas, solubles de Aß in vitro (Lambert, M.P. et al. Diffusible, nonfibrillar ligands derived from Abeta 1-42 are potent central nervous system neurotoxins. Proc. Natl. Acad. Sci U. S. A 95, 6448-6453 (1998); Walsh, D.M. et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature 416, 535-539 (2002)). Algunas de estas formas oligoméricas, solubles de Aß demostraron ser perjudiciales para las neuronas en enlace específico a las espinas sinápticas (Lacor, P.N. et al. Synaptic targeting by Alzheimer's-related amyloid ß oligomers. J Neurosci 24, 10191-10200 (2004)). Esta interacción específica puede ser responsable de la inhibición observada de potenciación a largo plazo (LTP) del hipocampo, un paradigma experimental para la plasticidad y memoria sináptica (Lambert, M.P. et al. Diffusible, nonfibrillar ligands derived from Abeta 1-42 are potent central nervous system neurotoxins. Proc. Natl. Acad. Sci U. S. A 95, 6448-6453 (1998); Walsh, D.M. et al. Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature 416, 535-539 (2002)).
Otra evidencia de un papel clave de las formas Aß solubles en la patogénesis de AD llega de los informes que la deficiencia cognitiva se desarrolla bien antes de la deposición de Aß insoluble en ratones transgénicos para APP humana (Buttini, M. et al. Modulation of Alzheimer-like synaptic and cholinergic deficits in transgenic mice by human apolipoprotein E depends on isoform, aging, and overexpression of amyloid beta peptides but not on plaque formation. J Neurosci 22, 10539-10548 (2002); Hsia, A.Y. et al. Plaque-independent disruption of neural circuits in Alzheimer's disease mouse models. Proc. Natl. Acad Sci U. S. A 96, 3228-3233 (1999); Mucke, L. et al. High-level neuronal expression of abeta 1-42 in wild-type human amyloid protein precursor transgenic mice: synaptotoxicity without plaque formation. J Neurosci 20, 4050-4058 (2000)). Desde entonces, muchos investigadores han utilizado preparaciones sintéticas de Aß para el modelo de neurotoxicidad mediada de Aß soluble (revisado en Walsh, D.M. & Selkoe, D.J. Deciphering the molecular basis of memory failure in Alzheimer's disease. Neuron 44, 181-193 (2004)).
Sin embargo, la tendencia intrínseca de los péptidos de Aß (especialmente Aß(1-42)) a aglomerarse rápidamente en soluciones acuosas a una variedad de estructuras polimerizadas, incluyendo oligómeros soluble, protofibrilllas y fibrillas (Stine, W.B., Jr., Dahlgren, K.N., Krafft, G.A. & LaDu, M.J. In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis. J Biol Chem 278, 11612-11622 (2003)), hace imposible atribuir los efectos neurotóxicos observados a una forma específica de asociación de Aß multimérica. Por consiguiente, recientemente varios grupos se han probado para aislar agrupaciones de Aß(1-42) solubles y probar su actividad neurotóxica. Lambert y sus colaboradores (Lambert, M.P. et al. Diffusible, nonfibrillar ligands derived from Abeta1-42 are potent central nervous system neurotoxins. Proc. Natl. Acad. Sci U. S. A 95, 6448-6453 (1998)) describieron una mezcla de pequeños agregados de Aß(1-42) solubles (4-18 kDa en SDS-PAGE), que denominaron "ligandos difusibles derivados de Aß" (ADDLs). Fueron capaces de demostrar que las concentraciones tan bajas como 500 nM de ADDLs causaron muerte neuronal en cultivos celulares y la LTP casi completamente bloqueada (Lambert, M.P. et al. Diffusible, nonfibrillar ligands derived from Abeta 1-42 are potent central nervous system neurotoxins. Proc. Natl. Acad. Sci U. S. A 95, 6448-6453 (1998); Wang, H.W. et al. Soluble oligomers of beta amyloid 1-42 inhibit long-term potentiation but not long-term depression in rat dentate gyrus. Brain Res 924, 133-140 (2002)).
En otra metodología los oligómeros no-sintéticos de Aß se liberaron en el medio por...
Reivindicaciones:
1. Método de detección de auto-anticuerpos que tienen especificidad por el epitope de estructura de oligómero de Aß(X-38 .. 43) globular no-difusible en una muestra derivada de un sujeto, método que comprende el contacto de la muestra con el oligómero de Aß(X-38 .. 43) globular no-difusible o un derivado marcado o reticulado de este, en donde X se selecciona del grupo que consiste de los números 1 .. 24, y la detección de un complejo formado por el anticuerpo y el oligómero o derivado, la presencia del complejo que indica la presencia de los auto-anticuerpos.
2. El método de la reivindicación 1, en donde el sujeto se supone que tiene una amiloidosis y la detección de los auto-anticuerpos es para diagnosticar la enfermedad de Alzheimer en el sujeto.
3. El método de la reivindicación 1 o 2, que además comprende someter la muestra a condiciones apropiadas para inducir la disociación de los complejos anticuerpo/antígeno antes de poner en contacto de la muestra con el oligómero de Aß(X-38 .. 43) globular no-difusible o derivado.
4. El método de cualquiera de las reivindicaciones 1 a 3, en donde la muestra es plasma, sangre total, sangre total seca o suero.
5. El método de cualquiera de las reivindicaciones 1 a 3, en donde la muestra es líquido cerebrorraquídeo.
6. El método de cualquiera de las reivindicaciones 1 a 5, en donde el oligómero es un oligómero de Aß(X-40) globular no-difusible.
7. El método de cualquiera de las reivindicaciones 1 a 5, en donde el oligómero es un oligómero de Aß(X-42) globular no-difusible.
8. El método de cualquiera de las reivindicaciones 1 a 7, en donde X se selecciona del grupo que consiste de los números 8 .. 24, 12 .. 24, o 12 .. 20.
9. El método de cualquiera de las reivindicaciones 1 a 7, en donde el oligómero de Aß(X-38 .. 43) globular no-difusible es un oligómero de Aß (20-42) globular no-difusible.
10. El método de cualquiera de las reivindicaciones 1 a 9, en donde el oligómero es soluble.
11. El método de cualquiera de las reivindicaciones 1 a 9, en donde el oligómero se aplica sobre una fase sólida.
Patentes similares o relacionadas:
Anticuerpos anti-alfa-sinucleína y procedimientos de uso, del 29 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un anticuerpo anti-alfa-sinucleína humana que comprende (a) HVR-H1 que comprende la secuencia de aminoácidos de SEQ ID NO: 21; (b) HVR-H2 que […]
Terapia basada en anticuerpos de la amiloidosis por transtiretina (TTR) y anticuerpos de origen humano para ese propósito, del 22 de Julio de 2020, de Neurimmune Holding AG: Un anticuerpo anti-transtiretina (TTR) de origen humano o un fragmento de unión a antígeno del mismo, que es capaz de unirse a especies de TTR mutadas, mal plegadas, […]
Polipéptidos biparatópicos antagonistas de la señalización WNT en células tumorales, del 15 de Julio de 2020, de Boehringer Ingelheim International GmbH & Co. KG: Un polipéptido que se une específicamente a LRP5 o LRP6, que comprende - un primer dominio variable individual de inmunoglobulina seleccionado del grupo de dominios […]
PTPRS y proteoglicanos en enfermedad autoinmune, del 15 de Julio de 2020, de LA JOLLA INSTITUTE FOR ALLERGY AND IMMUNOLOGY: Una proteína recombinante no enzimática que comprende una secuencia de aminoácidos de un dominio extracelular de PTPRS, donde la proteína comprende tanto el dominio 1 (Ig1) […]
Redirectores de células T específicas de antígenos, del 1 de Julio de 2020, de THE JOHNS HOPKINS UNIVERSITY: Una nanoparticula que comprende en su superficie: (A) un anticuerpo que se une especificamente a un antigeno de celula diana o epitopo del mismo; y (B) un resto […]
Anticuerpos scFv que pasan las capas epitelial y/o endotelial, del 1 de Julio de 2020, de ESBATech, an Alcon Biomedical Research Unit LLC: Un anticuerpo monocatenario (scFv) que comprende: (a) un dominio variable de la cadena ligera (VL) que tiene tres regiones CDR de VL no […]
Terapia de combinación para tratamiento de enfermedad, del 24 de Junio de 2020, de Mereo BioPharma 5, Inc: Un anticuerpo antagonista del ligando 4 tipo delta (DLL4) para su uso en un procedimiento para tratar el cáncer, inhibir el crecimiento tumoral, mejorar […]
Formulación anti-IFNAR1 estable, del 24 de Junio de 2020, de ASTRAZENECA AB: Una formulacion de anticuerpo que comprende: a. De 100 mg/ml a 200 mg/ml de anifrolumab; b. Lisina HCl 40 mM a 60 mM; c. Trehalosa […]