Método para producir una estructura porosa de polisfosfato cálcico.
Método para producir una estructura porosa de polifosfato cálcico,
que comprende los pasos de mezclar fosfato monocálcico (MCP) con ácido silícico, y sinterizar la mezcla a una temperatura o temperaturas predeterminadas durante un tiempo predeterminado, obteniéndose un polifosfato cálcico poroso. El método permite obtener un biomaterial poroso de porosidad regulable, que además presenta la capacidad de activar las plaquetas de un plasma rico en plaquetas y producir la liberación de factores de crecimiento de las plaquetas.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201201225.
Solicitante: BIOTECHNOLOGY INSTITUTE, I MAS D, S.L.
Nacionalidad solicitante: España.
Inventor/es: ANITUA ALDECOA,EDUARDO.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61F2/08 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61F FILTROS IMPLANTABLES EN LOS VASOS SANGUINEOS; PROTESIS; DISPOSITIVOS QUE MANTIENEN LA LUZ O QUE EVITAN EL COLAPSO DE ESTRUCTURAS TUBULARES, p. ej. STENTS; DISPOSITIVOS DE ORTOPEDIA, CURA O PARA LA CONTRACEPCION; FOMENTACION; TRATAMIENTO O PROTECCION DE OJOS Y OIDOS; VENDAJES, APOSITOS O COMPRESAS ABSORBENTES; BOTIQUINES DE PRIMEROS AUXILIOS (prótesis dentales A61C). › A61F 2/00 Filtros implantables en los vasos sanguíneos; Prótesis, es decir, elementos de sustitución o de reemplazo para partes del cuerpo; Dispositivos para unirlas al cuerpo; Dispositivos para proporcionar permeabilidad o para evitar que colapsen las estructuras tubulares del cuerpo, p. ej. stents (como artículos cosméticos, ver las subclases apropiadas, p. ej. pelucas o postizos, A41G 3/00, A41G 5/00, uñas artificiales A45D 31/00; prótesis dentales A61C 13/00; materiales para prótesis A61L 27/00; riñones artificiales A61M 1/14; corazones artificiales A61M 60/00). › Músculos; Tendones; Ligamentos.
- A61L27/12 A61 […] › A61L PROCEDIMIENTOS O APARATOS PARA ESTERILIZAR MATERIALES U OBJECTOS EN GENERAL; DESINFECCION, ESTERILIZACION O DESODORIZACION DEL AIRE; ASPECTOS QUIMICOS DE VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS; MATERIALES PARA VENDAS, APOSITOS, COMPRESAS ABSORBENTES O ARTICULOS QUIRURGICOS (conservación de cuerpos o desinfección caracterizada por los agentes empleados A01N; conservación, p. ej. esterilización de alimentos o productos alimenticios A23; preparaciones de uso medico, dental o para el aseo A61K). › A61L 27/00 Materiales para prótesis o para revestimiento de prótesis (prótesis dentales A61C 13/00; forma o estructura de las prótesis A61F 2/00; empleo de preparaciones para la fabricación de dientes artificiales A61K 6/80; riñones artificiales A61M 1/14). › Materiales que contienen fósforo, p. ej. apatito.
- C01B25/40 QUIMICA; METALURGIA. › C01 QUIMICA INORGANICA. › C01B ELEMENTOS NO METALICOS; SUS COMPUESTOS (procesos de fermentación o procesos que utilizan enzimas para la preparación de elementos o de compuestos inorgánicos excepto anhídrido carbónico C12P 3/00; producción de elementos no metálicos o de compuestos inorgánicos por electrólisis o electroforesis C25B). › C01B 25/00 Fósforo; Sus compuestos (C01B 21/00, C01B 23/00 tienen prioridad; perfosfatos C01B 15/16). › Polifosfatos.
- C04B35/447 C […] › C04 CEMENTOS; HORMIGON; PIEDRA ARTIFICIAL; CERAMICAS; REFRACTARIOS. › C04B LIMA; MAGNESIA; ESCORIAS; CEMENTOS; SUS COMPOSICIONES, p. ej. MORTEROS, HORMIGON O MATERIALES DE CONSTRUCCION SIMILARES; PIEDRA ARTIFICIAL; CERAMICAS (vitrocerámicas desvitrificadas C03C 10/00 ); REFRACTARIOS (aleaciones basadas en metales refractarios C22C ); TRATAMIENTO DE LA PIEDRA NATURAL. › C04B 35/00 Productos cerámicos modelados, caracterizados por su composición; Composiciones cerámicas (que contienen un metal libre, de forma distinta que como agente de refuerzo macroscópico, unido a los carburos, diamante, óxidos, boruros, nitruros, siliciuros, p. ej. cermets, u otros compuestos de metal, p. ej. oxinitruros o sulfuros, distintos de agentes macroscópicos reforzantes C22C ); Tratamiento de polvos de compuestos inorgánicos previamente a la fabricación de productos cerámicos. › a base de fosfatos.
Fragmento de la descripción:
Sector de la técnica La invención se refiere a un método para producir una estructura porosa de polifosfato cálcico que sirva como biomaterial utilizable en regeneración ósea u otras aplicaciones de diferentes campos de la medicina.
Estado de la técnica Los procedimientos de regeneración ósea son una práctica frecuente en ortopedia, odontología y otros campos de la medicina para tratar pacientes que han sufrido perdida ósea debido a trauma, infecciones o tumores. En los procedimientos de regeneración ósea suelen utilizarse biomateriales para conseguir ciertos efectos: servir de material de relleno, servir de soporte para la regeneración ósea, favorecer la regeneración ósea, entre otros. Los biomateriales son materiales que se caracterizan por ser capaces de interactuar con el sistema biológico del paciente, estando más concretamente diseñados para actuar interfacialmente con sistemas biológicos con el fin de evaluar, tratar, aumentar o reemplazar algún tejido, órgano o función del cuerpo (Planell E, Gil M, Ginebra M. Biomateriales. En: Viladot V. Lecciones básicas de 1a
biomecánica del aparato locomotor. ed. Barcelona: Springer-Verlag Iberica: 2000. p. 291-304) .
En el campo de la regeneración ósea, el mejor biomaterial es el hueso autólogo, es decir, el hueso proveniente del propio paciente. Sin embargo, el hueso autólogo presenta limitaciones en cantidad y forma, y además exige una cirugía aparte para ser obtenido, lo que aumenta el riesgo de complicaciones quirúrgicas. Por ello, con el avance del tiempo y la tecnología han ido surgiendo alternativas al uso de hueso autólogo que resultan menos traumáticas para el paciente. De forma especialmente relevante, los fosfatos cálcicos forman una alternativa eficiente al hueso autólogo ya que se caracterizan por ser biocompatibles, osteoconductores y reabsorbibles. De entre los fosfatos cálcicos, los ortofosfatos cálcicos han prevalecido en ocupar el interés de la comunidad científica; no obstante, los polifosfatos cálcicos (también denominados metafosfatos cálcicos) son otra alternativa biocompatible y reabsorbible.
Normalmente, para optimizar la regeneración ósea catalizada por un biomaterial es necesario que éste sea poroso, a semejanza del hueso, que es también poroso. Es decir, es necesario que el biomaterial sea capaz de ser convertido o conformado en una estructura porosa. En el caso de utilizarse polifosfato cálcico, la generación de estructuras porosas del mismo se realiza mediante un tratamiento térmico de fosfato monocálcico (MCP) , es decir, de Ca (H2P04) 2.H20 o Ca (H2P04) . En el estado de la técnica se conocen diversos ejemplos de métodos de fabricación de estructuras porosas de pOlifosfato cálcico basadas en este tratamiento.
Un ejemplo de método, descrito en Pilliar RM, et al. Biomaterials 2001 ;22:963-973, es el siguiente: se calienta el MCP a 500°C durante 10 horas y luego se funde a 1100°C durante una hora; seguidamente, se enfría muy rápidamente el material para producir un compuesto amorfo; entonces, se seleccionan las partículas que presenten un tamaño de granulo dentro de un rango adecuado; finalmente, se calientan las partículas seleccionadas a una temperatura de 970°C durante 2 horas.
En otro ejemplo, la solicitud de patente W09745147A1 describe un método de obtención de poli fosfato cálcico poroso para su uso en la regeneración de la interfase entre el hueso y otros tejidos conectivos, donde dicho método comprende también varios pasos de calentamiento de un monofosfato cálcico para sintetizar finalmente una estructura porosa de polifosfato cálcico. En el método se emplea ácido clorhídrico para disolver parte del polifosfato cálcico y contribuir a la formación de porosidad. El polifosfato cálcico obtenido presenta una forma cristalina exclusivamente de tipo beta.
En otro ejemplo, la patente US7494614 describe un método de producir estructura porosa de polifosfato cálcico beta que incluye también varios pasos de calentamiento. En resumen, se procesa monofosfato cálcico (MCP) para producir polifosfato cálcico amorfo a temperatura final de 11 OO°C. El pOlifosfato cálcico amorfo se tritura en gránulos, eligiéndose después los gránulos que presentan un diámetro dentro de un rango. Los gránulos seleccionados se introducen dentro de un molde. Seguidamente, se calienta el contenido del molde a varias temperaturas hasta producir la cristalización del polifosfato cálcico amorfo.
En otro ejemplo aún, la solicitud de patente W003055418A 1 describe la producción de estructuras porosas de varios fosfatos cálcicos mediante la ejecución de varios pasos de calentamiento de un material inicial. Además, se utilizan ácidos orgánicos o inorgánicos como catalizadores, por ejemplo ácido clorhídrico, para disolver parte del material y ayudar en la formación de una estructura porosa.
Por otra parte, según evoluciona la tecnología están apareciendo nuevos requisitos que deben cumplir los biomateriales utilizados en regeneración ósea. Así, una característica que va tornándose cada vez más deseable en los nuevos biomateriales es que presenten cierta o mucha capacidad para, puestos en contacto con una formulación rica en plaquetas, favorecer la activación de las plaquetas de dicha formulación de manera que se libere su contenido de factores de crecimiento y se provoque también la formación de fibrina (la activación de plaquetas y la formación de fibrina son necesarias para fomentar la regeneración de los tejidos) . Evidentemente, no todos los biomateriales presentan esta capacidad. Por ejemplo, en un estudio reciente de Cho HS, Park SY, Kim S, et al. titulado "Effect of different bone substitutes on the concentration of growth factors in platelet-rich plasma" (J Biomed Appl 2008;22:545557) , se ha estudiado la capacidad de dos cerámicas utilizadas muy comúnmente como biomaterial en regeneración ósea (la hidroxiapatita y el pOlifosfato cálcico) para activar las plaquetas. Los resultados de dicho estudio apuntan a que ninguno de estos materiales es capaz de activar las plaquetas.
La presente invención tiene como objetivo proponer un nuevo procedimiento de obtención de una estructura porosa de polifosfato cálcico, que solucione al menos uno de los problemas anteriores.
Es decir, por un lado el procedimiento deberá ser sencillo de ejecutar y deberá comprender pocos pasos en comparación con los procedimientos conocidos en el estado de la técnica.
Además, al menos en alguno de sus modos de realización, el procedimiento deberá permitir obtener un nuevo biomaterial que, en contacto con una formulación rica en plaquetas, tenga capacidad de activar plaquetas contenidas en dicha formulación para liberar su contenido de factores de crecimiento e inducir la formación de fibrina.
El biomaterial obtenido mediante el procedimiento de la invención podrá ser apto para ser utilizado en regeneración ósea y en otras aplicaciones de diferentes campos de la medicina.
Descripción breve de la invención Con el objetivo de resolver uno o más de los problemas descritos anteriormente, se propone un método para producir una estructura porosa de polifosfato cálcico, que comprende los pasos de mezclar fosfato monocálcico (MCP) con ácido silícico y de sinterizar la mezcla a una temperatura o temperaturas predeterminadas durante un tiempo predeterminado, obteniéndose un polifosfato cálcico poroso. Por sinterizar se entiende calentar la mezcla a una temperatura inferior a la temperatura de fusión de la mezcla.
La ventaja de partir de una mezcla de fosfato monocálcico (MCP) con ácido silícico, en lugar de partir de MCP sin mezclar, como es conocido en el estado de la técnica, es que variando la proporción entre ácido silícico y el MCP y variando la temperatura de sinterización es pOSible conseguir biomateriales de diferente porosidad y de diferente fase cristalina (beta o beta+gamma) . Además, el biomaterial resultante presenta la capacidad de activar las plaquetas de un posible compuesto rico en plaquetas en contacto con el biomaterial, gracias a la presencia de los iones de silicio en el biomaterial. El método según la invención es además un método de sencilla ejecución.
Descripción breve de las figuras Los detalles de la invención se aprecian en las figuras que se acompañan, no pretendiendo éstas ser limitativas del alcance de la invención:
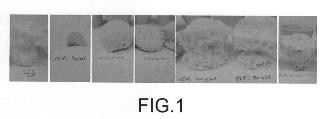
La Figura 1 muestra diferentes fotografías de biomateriales obtenidos según el método de la invención a diferentes proporciones de mezcla de MCP y ácido silícico. La Figura 2 muestra una fotografía de un material fundido obtenido tras una sinterización a 1000ºC. La Figura 3 muestra una fotografía de un biomaterial obtenido con un precalentamiento...
Reivindicaciones:
1. Método para producir una estructura porosa de polifosfato cálcico, que comprende los pasos de:
mezclar fosfato monocálcico (MCP) con ácido silícico;
sinterizar la mezcla a una temperatura o temperaturas predeterminadas durante un tiempo predeterminado, obteniéndose un polifosfatb cálcico poroso.
2. Método, según la reivindicación 1, que se caracteriza por que se mezcla fosfato monocálcico (MCP) con ácido silícico en una proporción peso/volumen menor o igual a 100 g/mI.
3. Método, según la reivindicación 2, que se caracteriza por que se mezcla fosfato monocálcico (MCP) con ácido silícico en una proporción peso/volumen entre 1 y 50 g/mI.
4. Método, según la reivindicación 1, que se caracteriza por que la sinterización se realiza a una temperatura inferior a 980°C.
5. Método, según la reivindicación 4, que se caracteriza por que la sinterización se realiza a una temperatura de entre 500 y 750°C.
6. Método, según la reivindicación 5, que se caracteriza por que comprende un paso de calentar la mezcla a una temperatura inferior a 200°C, el cual se ejecuta previo a la sinterización.
7. Método, según la reivindicación 1, que se caracteriza por que la sinterización se realiza durante un tiempo mayor o igual a 2 horas.
8. Método, según la reivindicación 7, que se caracteriza por que la sinterización se realiza durante un tiempo de entre 5 y 10 horas.
9. Método, según la reivindicación 1, que se caracteriza por que en el paso de mezclar fosfato monocálcico (MCP) con ácido silícico se mezcla también una fuente de iones de calcio.
10. Método, según la reivindicación 1, que se caracteriza por que comprende al paso de añadir una fuente de iones de calcio después de la fase de sinterización.
11. Método, según la reivindicación 10, que se caracteriza por que la fuente de iones de calcio comprende carbonato cálcico.
12. Método, según la reivindicación 10, que se caracteriza por que la fuente de iones de calcio comprende hidróxido cálcico.
13. Método, según la reivindicación 1, que se caracteriza por que comprende el paso previo de obtener ácido silícico hidrolizando una fuente de iones de silicio en solución acuosa ácida con una relación entre el volumen de dicha fuente de iones de silicio y el volumen total de la solución de entre el 1 y el 99%.
14. Método, según la reivindicación 13, que se caracteriza por que la relación entre el volumen de la fuente de iones de silicio y el volumen total de la solución es de entre el 10 Yel 90%.
15. Método, según la reivindicación 1, que se caracteriza por que durante la sinterización se realiza una compactación de la mezcla para dotar al material de una forma determinada.
16. Método, según la reivindicación 1, que se caracteriza por que comprende el paso previo de añadir al MCP y/o al ácido silícico iones con efecto biológico.
17. Método, según la reivindicación 1, que se caracteriza por que comprende el paso de mezclar la estructura porosa obtenida tras la sinterización con soluciones o líquidos que contienen iones con efecto biológico.
18. Un fosfato cálcico que se caracteriza por que presenta una porosidad mayor o igual de 30%, preferiblemente entre 40 y 80%, con una población de macro-poros mayor o igual a 40%, preferiblemente entre 50 y 75%, una población de meso-poros mayor o igual que 10%,
preferiblemente entre 10 Y 50%, Y una población de micro-poros mayor o igual a 4%, preferiblemente entre 5 y 30%.
19. Un material de relleno de espacios óseos, que comprende una estructura porosa de polifosfato cálcico fabricada según el método de la 10 reivindicación 1.
20. Un medio de soporte para el crecimiento celular, que comprende una estructura porosa de polifosfato cálcico fabricada según el método de la reivindicación 1.
21. Un material de refuerzo de matrices orgánicas, que comprende una estructura porosa de polifosfato cálcico fabricada según el método de la reivindicación 1.
22. Un material matriz para recibir la carga de un medicamento, proteína o factor de crecimiento y permitir la liberación de los mismos sobre él, que comprende una estructura porosa de polifosfato cálcico fabricada según el método de la reivindicación 1.
Patentes similares o relacionadas:
Elemento de fijación, del 22 de Julio de 2020, de Hadisaputro, Magdalena Linie Maya Sari: Elemento de fijación para conectar un ligamento a una parte ósea de un ser humano o animal, que comprende: un elemento de acoplamiento […]
Prótesis para defecto de la pared muscular y sistema de implementación, del 1 de Julio de 2020, de BARD SHANNON LIMITED: Un dispositivo médico para la reparación y el refuerzo de un defecto de la pared muscular y que comprende, en combinación: (a) una prótesis implantable […]
Prótesis implantable, del 8 de Abril de 2020, de C.R. BARD, INC.: Una prótesis implantable para subsanar un defecto de la pared abdominal, donde la prótesis implantable comprende: un parche de reparación tisular blando […]
Implante compuesto para reparación quirúrgica, del 11 de Diciembre de 2019, de SYNOVIS LIFE TECHNOLOGIES, INC.: Un implante compuesto biocompatible para reparación de tejido blando incluyendo: un andamiaje que permite el crecimiento celular interno en él; y un […]
Implante de fibrocartílago obtenido mediante ingeniería de tejidos, del 6 de Noviembre de 2019, de RUTGERS, THE STATE UNIVERSITY OF NEW JERSEY: Un implante de fibrocartílago artificial que comprende: un andamiaje biorreabsorbible arqueado o toroidal ; una red de fibras […]
Método de fijación de un tendón artificial y un producto, del 28 de Agosto de 2019, de Bioservo Technologies Aktiebolag: Un método de fijación de un tendón artificial a un dispositivo de soporte que tiene un material de soporte , donde el tendón artificial […]
Implante reabsorbible, del 29 de Julio de 2019, de UNIVERSIDADE DE SANTIAGO DE COMPOSTELA: Implante reabsorbible. La invención se refiere a un implante para aplicación en salud animal para la resolución de RLCCr mediante la técnica de […]
 Ligamento artificial para una luxación acromioclavicular, del 26 de Junio de 2019, de Calvosa, Giuseppe: Ligamento artificial acromioclavicular ,
cuyo ligamento artificial comprende un cuerpo principal alargado fabricado de material biocompatible,
[…]
Ligamento artificial para una luxación acromioclavicular, del 26 de Junio de 2019, de Calvosa, Giuseppe: Ligamento artificial acromioclavicular ,
cuyo ligamento artificial comprende un cuerpo principal alargado fabricado de material biocompatible,
[…]