MÉTODO DE PRODUCCIÓN DE CISTACEAS MICORRIZADAS CON TRUFA DE DESIERTO.
Método de producción de plantas de la familia Cistaceae micorrizadas con las diferentes especies de trufa de desierto.
El método se sirve del cultivo de semillas/explantos en condiciones fotoautotróficas. El material vegetal se somete a una adaptación progresiva a una humedad relativa decreciente hasta valores ambientales.
La inoculación del hongo micorrícico es a base de esporas y/o micelio. El inóculo se elabora a temperatura ambiente o en frío para favorecer la adhesión de los propágulos a la matriz porosa inerte tras su homogenización. La aplicación del inóculo se lleva a cabo durante la fase de trasplante a maceta.
La fase de aclimatación es de 7 a 12 días. Se obtienen valores de supervivencia del 95 %. De 30 a 40 días después de la aclimatación el porcentaje de micorrización se establece en valores del 70 al 80 %.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201100216.
Solicitante: THADER BIOTECHNOLOGY S.L.
Nacionalidad solicitante: España.
Inventor/es: HONRUBIA GARCIA, MARIO, ANDRINO DE LA FUENTE,Alberto, MORTE GÓMEZ,Asunción.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A01H4/00 NECESIDADES CORRIENTES DE LA VIDA. › A01 AGRICULTURA; SILVICULTURA; CRIA; CAZA; CAPTURA; PESCA. › A01H NOVEDADES VEGETALES O PROCEDIMIENTOS PARA SU OBTENCION; REPRODUCCION DE PLANTAS POR TECNICAS DE CULTIVO DE TEJIDOS. › Reproducción de plantas por técnicas de cultivo de tejidos.
Fragmento de la descripción:
OBJETO DE LA INVENCIÓN
La presente invención se encuadra dentro del campo técnico de la producción in vitro y ex vitro de planta micorrizada con las diferentes especies de trufa del desierto.
Se trata de un método de producción de planta que asegura el establecimiento de la síntesis micorrícica de las plantas procedentes de semilla y de explantos micropropagados de especies de los diferentes géneros de la familia Cistaceae (gen. Lechea, Fumana, Helianthemum, Crocanthemum, Hudsonia, Tuberaria, Halimium y Cistus según Guzmán y Vargas de 2009) con los géneros de hongos micorrícicos que forman el grupo denominado de trufas del desierto (gen. Terfezia, Tirmania, Picoa, Balsamia, Delatreopsis, Delastria, Leucangium, Mattirolomyces y Tuber) .
ANTECEDENTES DE LA INVENCIÓN
Las trufas del desierto son hongos hipogeos comestibles que se hallan asociados simbióticamente a especies de cistáceas y Pinus. La simbiosis micorrícica es una estrategia nutricional que la mayoría de las plantas y algunas especies de hongos han desarrollado para asegurar su mutuo beneficio. Las primeras reciben los nutrientes y el agua que los segundos han tomado del suelo prospectado. A su vez, las plantas cierran el contrato simbiótico con el aporte de carbohidratos al hongo simbionte (Harley y Smith, 1983) .
El tipo de micorriza que establecen las especies fúngicas englobadas en el grupo de trufas del desierto junto con las especies de cistáceas es variable. Se ha descrito, en cultivo in vitro, la presencia de un manto externo de células fúngicas junto a red de Hartig (ectomicorriza) , mientras que en fase de invernadero y/o campo la colonización es principalmente intercelular e intracelular (endomicorriza) . Esta diversidad estratégica de micorriza no depende de la especie fúngica, sino más bien de las condiciones de cultivo (Fortas y Chevalier, 1992; Gutiérrez et al., 2003) .
Las especies de cistáceas asociadas a trufas del desierto son plantas que responden a condiciones xerofiticas marcadas, zonas donde la escasez de agua, en forma de precipitaciones, es norma (50-380 mm) . Este hecho pone de manifiesto la más que extensible aplicación en terrenos semiáridos improductivos hasta la fecha, permitiendo revalorizar socio-económicamente entornos rurales (Honrubia et al., 2007; Murcia et al., 2002; Murcia et al., 2003)
La distribución biogeográfica de las trufas del desierto está limitada a las zonas áridas y semiáridas de los diferentes países de que forman la cuenca Mediterránea, la Península Arábiga, Irán, Irak, Siria, Sudáfrica, Norte América, Japón y China (Morte et al., 2008)
El interés suscitado por las trufas del desierto estriba en su equilibrado contenido en proteínas, aminoácidos esenciales, minerales y fibra, complementados con una alta concentración de compuestos antioxidantes (Honrubia et al., 2007) .
La recolección silvestre de las trufas del desierto está en continua regresión debido a la gradual pérdida del hábitat natural de las mismas, como consecuencia de la actividades humanas (Morte et al., 2008) . Estas circunstancias plantean la necesidad de conservar los hábitats truferos, junto con el establecimiento de protocolos y métodos de producción viables para responder así a los posibles planes de restauración de los hábitats, así como de la implantación anteriormente comentada de plantaciones que revaloricen las zonas rurales.
Los aspectos biotecnológicos implicados en la producción de la planta micorrizada están asociados a la ecología cambiante de las plantas hospedantes. Se contemplan una serie de factores críticos para el establecimiento de la simbiosis mi corrí cica. Las características del suelo son muy variadas, prestando especial atención a su textura, tipo de pH, conductividad, contenido en materia orgánica y relación CIN.
Actualmente se registran altas tasas de mortandad que acaecen durante el proceso de aclimatación en los protocolos de cultivo in vitro, por lo tanto no existe un método a gran escala y económicamente viable, que permita transferir plantas de la familia Cistaceae desde el cultivo in vitro a maceta.
El hecho es que tanto plántulas provenientes de semilla, como explantos, tras su cultivo en condiciones in vitro, son expuestos a condiciones de estrés biótico (microflora) y abióticos (luz, temperatura, humedad ambiental) . Por ello, necesitan de una fase de aclimatación para su establecimiento y posterior supervivencia (Deb y Imchen, 2010) . En general, las plantas crecidas en condiciones in vitro presentan estomas no funcionales, débil sistema radicular y pobre desarrollo de ceras y cutícula (Mathur et al., 2008) . El proceso de aclimatación favorece las adaptaciones necesarias a nivel morfológico y metabólico de las plantas al medio externo (Pospósilová et al., 1999) .
Aquellos factores abióticos implicados en el crecimiento de la planta in vitro y que influyen directamente sobre la calidad de la aclimatación serían los siguientes: una intensidad lumínica no adecuada provoca la fotoinhibición y el blanqueamiento de las clorofilas, al no disponer de un aparato fotosintético funcional (Van Huylenbroeck, 1994; Van Huylenbroeck et al., 1995) ; la humedad ambiental está directamente implicada en el retraso del desarrollo de ceras, cutícula, estomas no funcionales, causas de las altas tasas de transpiración que tienen lugar al extraer las plantas de los envases de cultivo (Chen y Chen, 2002; Pospósilová et al., 1999) . Para paliar esta rápida desecación se ha propuesto el uso de compuestos antitranspirantes y de retardantes en el crecimiento para mejorar las tasas de supervivencia asociadas a la aclimatación (Chandra et al., 2010) . En general, la toma de agua y solutos por parte de la planta está muy limitada por la pobre capacidad de conducción de las raíces (Fila et al., 1998; Short et al., 1985) . El origen del alto valor de humedad relativa se debe a la baja tasa de intercambio de gases con el exterior, que tiene lugar en el interior de los botes de cultivo (Chen y Chen, 2002; Huang y Chen, 2005) ; la concentración de carbohidratos, presente de forma habitual en la composición de los medios de cultivo in vitro de semillas y explantos, afecta negativamente debido al hecho de cambiar en un breve espacio de tiempo de una nutrición heterótrofa a autótrofa (Wainwright y Scrace, 1989) . Para salvar esta problemática algunos cultivos in vitro se han desarrollado de forma fotoautotrófica (Kozai, 1991) ; los niveles de ácido abscísico son un parámetro que juega un papel importante en el balance hídrico de la planta, así como en su adaptación a las diferentes situaciones de estrés (Finkelstein y Gibson, 2002; Hetherington, 2001) . Esta hormona vegetal se transporta vía xilema hacia los tallos donde pone en marcha el mecanismo de regulación de la pérdida de agua por transpiración, así como la regulación del crecimiento de las hojas (Hronková et al., 2003) .
Los factores bióticos pueden generar situaciones de estrés causadas por las comunidades microbianas presentes en los suelos de forma natural, pero ausentes en los cultivos in vitro. Este hecho pone de manifiesto la inadaptación de las plántulas al ambiente biótico externo (Chandra et al., 2010) . Se empieza a trabajar sobre el uso de microorganismos durante el cultivo in vitro. Este proceso toma el nombre de bioendurecimiento (Srivastava et al., 2002) . Mediante estos protocolos emergentes se utilizan bacterias endófitas y hongos vesículo-arbusculares para mejorar las tasas de supervivencia durante la aclimatación (Chandra et al., 2010) de plantas micorrícicas.
DESCRIPCIÓN DE LA INVENCIÓN
La siguiente invención describe un método para la producción de plantas de las especies de la familia Cistaceae micorrizadas con las diferentes especies de trufa del desierto. El método se basa en la producción fotoautotrófica in vitro y ex vitro de semillas y explantos de material vegetal que se adaptan durante su cultivo a un endurecimiento paulatino derivado de las condiciones cambiantes a las que son sometidas hasta el transplante definitivo a maceta. Gracias a este endurecimiento progresivo, la fase de aclimatación se supera exitosamente. La planta en maceta se pone en contacto con inóculo esporal y/o miceliar embebido en una matriz porosa que facilita la adhesión de los propágulos fúngicos y el desarrollo y colonización de las raíces, aún no suberizadas de las plántulas.
La aplicación de este método de producción de planta soluciona definitivamente el problema que lleva consigo la alta...
Reivindicaciones:
1. Método de producción de plantas de la familia Cistaceae (gen. Lechea, Fumana, Helianthemum, Crocanthemum, Hudsonia, Tuberaria, Halimium y Cistus) micorrizadas con especies de trufa de desierto (gen. Terfezia, Tirmania, Picoa, Balsamia, Delatreopsis, Delastria, Leucangium, Mattirolomyces y Tuber) caracterizado por presentar dos etapas. La primera etapa se denomina de semillado y micropropagación, en ésta el material vegetal proviene de semilla y/o explanto; su cultivo se realiza en condiciones fotoautotróficas; el material vegetal se expone a condiciones decrecientes de humedad relativa descritas por una curva exponencial decreciente. El término de la primera etapa está definido por la conservación del estado juvenil del sistema radicular junto con un porte adecuado de la plántula para su trasplante La segunda etapa se denomina de inoculación y aclimatación, en ésta se aplica el inóculo esporal y/o miceliar coincidiendo con el momento del trasplante de las plántulas que provienen de la primera etapa. El inóculo se somete a un corto tratamiento de frío para favorecer la adhesión de los propágulos micorrícicos a los poros y cavidades de la perlita utilizada como soporte inerte. La progresiva adaptación a de las plántulas a una humedad relativa decreciente favorece que la aclimatación se acorte significativamente. Al final de esta etapa se obtienen plantas de la familia Cistaceae micorrizadas con especies de trufa de desierto con un alto porcentaje de micorrización.
2.
2. 30 % del recipiente. Este volumen de perlita se riega con una solución nutritiva de medio Murashige y Skoog sin fuente hidro carbonada con un pH que oscile entre 5 y 8 en función de la especie a cultivar. El riego de la perlita se realiza de tal modo que el
potencial hídrico del sustrato regado oscile entre O y -2 KPa. A la boca del recipiente se le ajusta una tapa plástica perforable y desechable. Tras el auto clavado del conjunto, recipiente, sustrato regado y tapa, se retira ésta, depositándose las semillas previamente desinfectadas o los explantos previamente seleccionados. La densidad del cultivo depende de la superficie disponible en el recipiente, evitando que solapen en el recipiente las áreas del dosel de cada plántula. A continuación se ajusta la tapa a la boca del recipiente para iniciar el cultivo de las semillas y/o explantos. Los recipientes con semillas/explantos se ubican en condiciones de cultivo: 16-26 oC.
3. 65 % humedad relativa.
35. 400 ppm de CO2.
9. 295 ~mol*m-2*s-l; 0, 1 -0, 7 mis velocidad del viento. A continuación, se lleva a cabo una adaptación progresiva de las plántulas/explantos a las condiciones ambientales externas gracias a las perforaciones de 0, 5 a 1 mm de diámetro que se realizan en la superficie de la tapa plástica perforable, una vez se produce la emergencia y desarrollo del sistema radicular, hipocótilo, epicótilo y cotiledones. El número de perforaciones se establece en función del volumen del recipiente. La pérdida de humedad obtenida con este método viene descrita por una curva exponencial decreciente. Dependiendo de la fenología de cada especie de la familia Cistaceae se estima que el periodo de estancia en el recipiente está definido por la conservación del estado juvenil del sistema radicular junto con un porte adecuado de altura para su trasplante, factores que limitan la elección del recipiente de cultivo.
3. Método de producción de plantas de la familia Cistaceae (gen. Lechea, Fumana, Helianthemum, Crocanthemum, Hudsonia, Tuberaria, Halimium y Cistus) micorrizadas con especies de trufa de desierto (gen. Terfezia, Tirmania, Picoa, Balsamia, Delatreopsis, Delastria, Leucangium, Mattirolomyces y Tuber) según la reivindicación 1 que presenta una segunda etapa de inoculación y aclimatación caracterizada por procederse al trasplante de las plántulas que provienen de la primera etapa al sustrato de cultivo. La textura de dicho sustrato se establece de tal modo que facilite el drenaje y mantenga el potencial hídrico en la zona de máxima densidad radicular entre -15 y -30 KPa. La preparación del inóculo micorrícico se realiza a partir de dos tipos de propágulos en medio
líquido, esporas y/o hifas de micelio. Se lleva a cabo con un corto tratamiento de frío (5 a 8 oC; 30 a 60 minutos) entre perlita y los posibles propágulos micorrícicos, para favorecer la adhesión de los propágulos a los poros y cavidades de la perlita una vez que la fase líquida sea absorbida por la perlita y 5 evaporada por acción del enfriamiento. Durante el trasplante se ponen en contacto las raíces juveniles de la plántula con el inóculo micorrícico preparado previamente, el porcentaje a aplicar es del 5 al 10 % del volumen del contenedor final. La fase de aclimatación tiene lugar en condiciones de cultivo de semilla/explanto durante 7 a 12 días con una supervivencia del 95 % de las
plántulas inoculadas y trasplantadas. Tras la aclimatación las plántulas se exponen a las siguientes condiciones: <40°C; >20% humedad relativa.
35. 400 ppm de CO2.
29. 1000 ¡.¡.mol*m-2*s-1; velocidad del viento variable. Tras los primeros 30 a 40 días después de la inoculación y trasplante se obtienen porcentajes de micorrización del 70 al 80 % en las raíces.
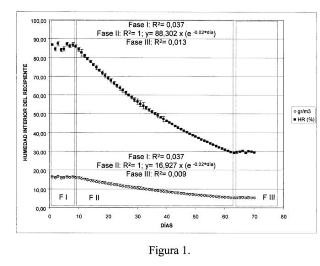
100, 00 ~~~"IT""~~~~~~::""", "~:=-::=~~="", , ~~="'''~''''''~''''~''''~''''''T., r'···=······=·····=···===, --, ii Fase 1: R2= 0, 037
'i Fase 11: R2= 1; y= 88, 302 x (e -O.02*día)
90, 00
alti~!t-+!i;--=~=.. -._______F_a__s_e_II~I:~R~2__0~, 0__1~3_____+-+II_______ ~ 80, 00
W 1
H -f.
Z ~ 70, 00
:: 'tt¡
Ü
w
~ 60, 00
w
¡i ~"
e
o::
o gr/m3
O
50, 00 ++-----+;!--------, --------;--;----. ----t
ji: • HR (%)
W
¡. ........
~
¡:
40, 00
e
- ..
oC (
e
........ ii "
w
::E 30, 00 +---'¡ -·---~----------------~.............. r_;iIi, ~~.. -... -~-----j-~
::J
J:
i, 'i, ' F 11 R2Fas1e 1: R1 6=902, 07 ( o02*d' )
, " ase: =; y= , x e -. la ,
20, 00
b~ ~~ -Fase 111: R2= O, OOg i
, OQ , , ~~~ ,
10, 00
, ': ~~0 (5.~~~~0ó00~~~~~~~ , i F 1 ii F 11 ~~~~~~~~~~~ FIII! L ...................... ..! ¡................................................." ..........................., ......... ~.....
0, 00
o 10 20 30 40 50 60 70 80
DíAS
Figura 1.
, " , , , 1111111'" 1IIIIiIWlII~_
ÁREA FOLIAR (cm2)
2, 5 -r-----------..., .... ~------___, rr__-------____,
1, 5
Figura 3.
LONGITUD DE LA RAíz (cm)
Figura 4.
CONCENTRACiÓN CLOROFILA TOTAL (mg/gr hoja)
3~________________~~________________~______________
~
Figura 5.
CONCENTRACiÓN CLOROFILA a (rng/gr hoja)
Figura 6.
CONCENTRACiÓN CLOROFILA b (rng/gr hoja)
0, 6 -r------------, , ¡r----------_----------,
Figura 7.
CONCENTRACiÓN XANTÓFILAS y CAROTENOIDES (rng/gr hoja)
Figura 8.
CONCENTRACiÓN DE CLOROFILA (SPAD502)
Figura 9.
Patentes similares o relacionadas:
SISTEMA DE REACTOR PARA EL CULTIVO IN VITRO DE MATERIAL VEGETAL, KIT PARA TRANSFORMAR UN RECEPTÁCULO EN UN REACTOR APTO PARA DICHO SISTEMA, Y MÉTODO PARA EL CULTIVO IN VITRO DE MATERIAL VEGETAL MEDIANTE DICHO SISTEMA DE REACTOR, del 4 de Junio de 2020, de INSTITUT DE RECERCA I TECNOLOGIA AGROALIMENTARIES: Comprende un receptáculo para el cultivo del material vegetal, una tapa para cerrar una abertura de dicho receptáculo , y medios para permitir la […]
Producción de semillas de cereales híbridas, del 3 de Junio de 2020, de Limagrain Europe: Un procedimiento para limitar la proporción de semillas de cereales autofecundadas macho en un surtido de semillas de un campo que contiene un rodal […]
SISTEMA DE REACTOR PARA EL CULTIVO IN VITRO DE MATERIAL VEGETAL, KIT PARA TRANSFORMAR UN RECEPTÁCULO EN UN REACTOR APTO PARA DICHO SISTEMA, Y MÉTODO PARA EL CULTIVO IN VITRO DE MATERIAL VEGETAL MEDIANTE DICHO SISTEMA DE REACTOR, del 29 de Mayo de 2020, de INSTITUT DE RECERCA I TECNOLOGIA AGROALIMENTARIES: Sistema de reactor para el cultivo in vitro de material vegetal, kit para transformar un receptáculo en un reactor apto para dicho sistema, y método […]
Muestreo de embriones para análisis molecular, del 13 de Mayo de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un método para analizar un embrión aislado de una planta monocotiledónea que comprende: a. cortar un trozo de tejido de escutelo de un embrión inmaduro […]
Producción de tapsigarginas por cultivo en suspensión de células de Thapsia, del 6 de Mayo de 2020, de PHYTON HOLDINGS, LLC: Método de producción de lactonas sesquiterpénicas de la familia de tapsigargina, comprendiendo el método las etapas de: (a) cultivar células vegetales […]
Apoyo para cultivar material biológico, del 8 de Enero de 2020, de ViVi B.V: Recipiente para cultivar material biológico, comprendiendo un sustrato inerte sólido , un medio de crecimiento y material biológico dispuesto […]
Producción de ingenol, ésteres de ingenol y/o derivados de tiglian-3-ona mediante cultivos en suspensión de células vegetales de Euphorbiaceae, del 18 de Diciembre de 2019, de PHYTON HOLDINGS, LLC: Método para producir ingenol, ésteres de ingenol y/o derivados de tiglian-3-ona, comprendiendo el método las etapas de: (a) cultivar células vegetales obtenidas […]
Biorreactor, del 27 de Mayo de 2019, de Evonik Advanced Botanicals SAS: Un biorreactor de inmersión temporal para la producción in vitro de biomasa vegetal diferenciada que comprende: una cámara de crecimiento […]