MÉTODO PARA TRATAR ENFERMEDADES DESMIELINIZANTES.
El uso de un anticuerpo contra IL-18Rα en el que el anticuerpo tiene un dominio de unión de antígeno que comprende seis CDR con una secuencia de aminoácidos que consiste en:
SEQ ID NO: 5 que representa la cadena pesada de CDR1, SEQ ID NO: 6 que representa la cadena pesada de CDR2, SEQ ID NO: 7 que representa la cadena pesada de CDR3, SEQ ID NO: 8 que representa la cadena ligera de CDR1, SEQ ID NO: 9 que representa la cadena ligera de CDR2 y SEQ ID NO: 10 que representa la cadena ligera de CDR3 en la fabricación de un medicamento para el tratamiento de una enfermedad desmielinizante
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/051692.
Solicitante: UNIVERSITY OF ZURICH.
Nacionalidad solicitante: Suiza.
Dirección: OFFICE VICE PRESIDENT OF RESEARCH RÁMISTRASSE 71 8006 ZÜRICH SUIZA.
Inventor/es: BECHER,Burkhard.
Fecha de Publicación: .
Fecha Solicitud PCT: 21 de Febrero de 2007.
Clasificación Internacional de Patentes:
- C07K16/28H
Clasificación PCT:
- A61K39/395 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- A61P25/02 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › A61P 25/00 Medicamentos para el tratamiento de trastornos del sistema nervioso. › para neuropatías periféricas.
- C07K16/28 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2358929_T3.pdf
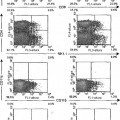
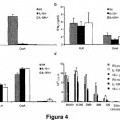
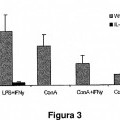
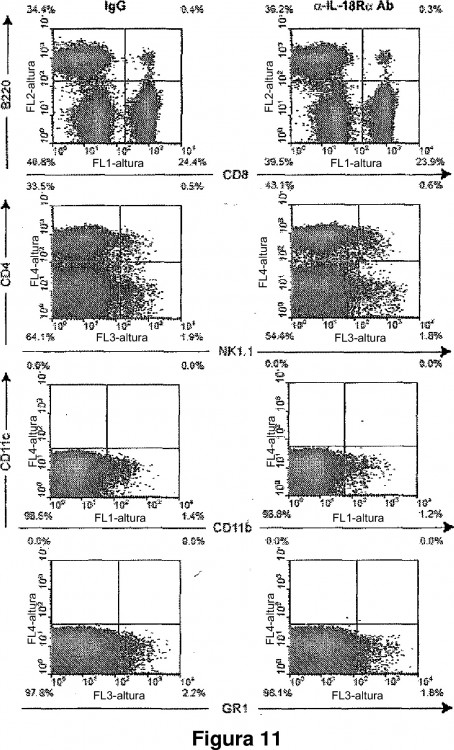
Fragmento de la descripción:
La presente invención se refiere a un nuevo tratamiento terapéutico o profiláctico en sujetos humanos. La presente invención surge en parte del descubrimiento de que los antagonistas de IL-18R son eficaces in vivo para tratar enfermedades.
De acuerdo con esto, la invención proporciona un método para tratar, prevenir o mejorar los síntomas de enfermedades desmielinizantes (tales como la esclerosis múltiple) en un sujeto, preferiblemente un sujeto humano, comprendiendo dicho método administrar al sujeto una cantidad terapéuticamente eficaz de un antagonista de IL-18R. La invención también se refiere al uso de un antagonista de IL-18R en la fabricación de un medicamento para el tratamiento de enfermedades desmielinizantes (tales como la esclerosis múltiple).
ANTECEDENTES
Las enfermedades desmielinizantes son un grupo de patologías que implican anormalidades en las capas de mielina del sistema nervioso. Muchos trastornos metabólicos congénitos afectan al desarrollo de las capas de mielina, principalmente en el SNC, y la desmielinización es una característica de muchos trastornos neurológicos.
La enfermedad desmielinizante inflamatoria crónica más conocida del sistema nervioso central en humanos es la esclerosis múltiple. El inicio de la esclerosis múltiple (EM) sucede típicamente de los 20 a los 40 años. A las mujeres les afecta aproximadamente dos veces más a menudo que a los hombres. A lo largo del tiempo, la EM puede originar la acumulación de diversas discapacidades neurológicas. Se piensa que la discapacidad clínica en la EM es la consecuencia de un daño inflamatorio repetido que resulta en la consecuente pérdida de mielina y axones, lo que conduce a una atrofia de los tejidos.
La EM se manifiesta con síntomas físicos (recaídas y progreso en la discapacidad), inflamación del sistema nervioso central (SNC), atrofia cerebral y deficiencia cognitiva. Los síntomas que se presentan incluyen déficits focales sensoriales, debilidad focal, problemas visuales, desequilibrio y fatiga. Pueden aparecer disfunción sexual y disfunción del esfínter. Aproximadamente la mitad de los pacientes con EM pueden experimentar deficiencia cognitiva
o depresión.
La EM está considerada en la actualidad como una enfermedad multi-fásica y en la que aparecen periodos de latencia clínica (remisiones) entre los brotes. Las remisiones varían en su extensión y pueden durar algunos años pero frecuentemente no son permanentes.
Se separan en cuatro los cursos de la enfermedad: esclerosis múltiple con recaídas y remisiones (RR), progresiva secundaria (SP), progresiva primaria (PP) y con recaída progresiva (RP). Más del 80% de los pacientes con EM muestran inicialmente un curso RR con brote clínico de síntomas neurológicos, seguido de una recuperación que puede ser completa o no (Lublin and Reingold, Neurology, 1996, 46:907-911).
Durante la EM-RR, la acumulación de discapacidad origina una recuperación incompleta de las recaídas. Aproximadamente, la mitad de los pacientes con EM-RR cambian a un curso progresivo, denominado EM-SP, 10 años después del inicio de la enfermedad. Durante la fase PS, el empeoramiento de la discapacidad origina la acumulación de síntomas residuales después del brote, aunque también de la contínua progresión entre los brotes (Lublin and Reingold, más arriba). El 10% de los pacientes con EM tienen EM-PP que está caracterizada por la progresión contínua de los síntomas desde el inicio de la enfermedad. Menos del 5% de los pacientes tienen EM-PR y se considera a menudo que tienen la misma prognosis que la EM-PP. Se piensa que pueden estar implicados diferentes mecanismos patógenos en diferentes sub-grupos de pacientes y tener un amplio rango de implicaciones para la clasificación de la enfermedad (Lassmann et al, 2001, Trends Mol. Med., 7, 115-121; Lucchinetti et al, Curr. Opin. Neurol., 2001, 14, 259-269).
El inicio de la EM se define por la aparición de los primeros síntomas neurológicos de la disfunción del SNC. Los avances en el análisis del fluido cerebroespinal (FCE) y la formación de imágenes por resonancia magnética (MRI) han simplificado el procedimiento diagnóstico y facilitado el diagnóstico precoz (Noseworthy et al, The New England Journal de Medicine, 2000, 343, 13, 938-952). El Panel Internacional sobre el Diagnóstico de la EM se focalizó en la revisión de criterios que facilitaran el diagnóstico de la EM y que se incluyera la MRI con los métodos de diagnóstico clínico y para-clínico (Mc Donald et al, 2001, Ann. Neurol, 50:121-127).
**(Ver fórmula)**
Los documentos WO 2006/009114 y WO 02/32374 describen un anticuerpo contra IL18R, y consideran el tratamiento de la enfermedad desmielinizante con estos anticuerpos, entre otras enfermedades. Los documentos WO 03/008452 y B. Sergi et al, "Interleukin 18 receptor", Journal of Biological regulators and homeostatic agents 2004, 18: 35-61 presentan resultados contradictorios que no incitan a continuar con el tratamiento de enfermedades desmielinizantes con anticuerpos contra IL-18R.
Los tratamientos actualmente disponibles para el tratamiento de la esclerosis múltiple actúan esencialmente contra los síntomas de la enfermedad. Consecuentemente, hay una gran necesidad de terapias alternativas que proporcionen mejores beneficios clínicos a los pacientes.
RESUMEN DE LA PRESENTE INVENCIÓN
La presente invención se refiere a un nuevo tratamiento terapéutico o profiláctico en sujetos humanos. La presente invención surge en parte del descubrimiento de que los antagonistas de lL-18R son eficaces in vivo para tratar enfermedades.
De acuerdo con esto, la invención proporciona un método para tratar, prevenir o mejorar los síntomas de enfermedades desmielinizantes en un sujeto, preferiblemente un sujeto humano, comprendiendo dicho método administrar al sujeto una cantidad terapéuticamente eficaz de un antagonista de IL-18R. En un aspecto particular, la enfermedad desmielinizante es la esclerosis múltiple. La invención también se refiere al uso de un antagonista de IL-18R en la fabricación de un medicamento para el tratamiento de una enfermedad desmielinizante. En un aspecto particular, la enfermedad desmielinizante es la esclerosis múltiple.
En un aspecto particular, la invención se basa en el método o el uso que se define anteriormente en el que el sujeto está afectado por esclerosis múltiple con recaídas y remisiones (RR), esclerosis múltiple progresiva secundaria (PS), esclerosis múltiple progresiva primaria (PP) o esclerosis múltiple con recaída progresiva (RP).
En un aspecto particular, el antagonista es un anticuerpo que se une selectivamente a IL18-R, en particular al dominio extra-celular de IL18-R. Más específicamente, el anticuerpo se une selectivamente al polipéptido de SEQ ID NO: 2, e incluso más específicamente, el anticuerpo se une selectivamente a los residuos 1-329 de SEQ ID NO: 2, o los residuos 19-329 de SEQ ID NO: 2, o los residuos de 330 a 350 de SEQ ID NO: 2 o los residuos de 351 a 541 de SEQ ID NO: 2. En un aspecto particular, el anticuerpo se une selectivamente a los residuos 19219 de SEQ ID N: 2, o los residuos 122-329 de SEQ ID N: 2. En otro aspecto particular, el anticuerpo se une selectivamente a los residuos 19-132 de SEQ ID N: 2, o los residuos 122219 de SEQ ID N: 2, o los residuos 213-329 de SEQ ID N: 2.
Otro objeto de la presente invención se basa en el método o el uso que se define anteriormente en el que el anticuerpo se une selectivamente a un epítopo localizado en el dominio extracelular de IL-18R humano. En un aspecto particular, el epítopo está localizado dentro de los aminoácidos 19 a 329 de SEQ ID NO: 2, o dentro de los residuos de aminoácidos 19 a 219 de SEQ ID NO: 2, o dentro de los residuos de aminoácidos 122 a 329 de SEQ ID NO:
2. En otro aspecto particular, el epítopo está localizado dentro de los aminoácidos 19-132 de SEQ ID N: 2, o 122-219 de SEQ ID N: 2, o 213-329 de SEQ ID N: 2.
Otro objeto de esta invención se basa en el método o el uso que se define anteriormente en el que el anticuerpo tiene un dominio de unión de antígeno que comprende CDR con una secuencia de aminoácidos seleccionada entre el grupo que consiste en: SEC ID NO: 5, de la SEQ ID NO: 6, de la SEQ ID NO: 7, de la SEQ ID NO: 8, de la SEQ ID NO: 9 y la SEC ID NO: 10. En un aspecto particular, el anticuerpo comprende un dominio VH que... [Seguir leyendo]
Reivindicaciones:
1. El uso de un anticuerpo contra IL-18R en el que el anticuerpo tiene un dominio de unión de antígeno que comprende seis CDR con una secuencia de aminoácidos que consiste en: SEQ ID NO: 5 que representa la cadena pesada de CDR1, SEQ ID NO: 6 que representa la cadena pesada de CDR2, SEQ ID NO: 7 que representa la cadena pesada de CDR3, SEQ ID NO: 8 que representa la cadena ligera de CDR1, SEQ ID NO: 9 que representa la cadena ligera de CDR2 y SEQ ID NO: 10 que representa la cadena ligera de CDR3 en la fabricación de un medicamento para el tratamiento de una enfermedad desmielinizante.
2. El uso de acuerdo con la reivindicación 1, en el que dicha enfermedad desmielinizante es la esclerosis múltiple.
3. El uso de acuerdo con las reivindicaciones 1 ó 2, en el que el sujeto está afectado por esclerosis múltiple con recaídas y remisiones (RR), esclerosis múltiple progresiva secundaria (PS), esclerosis múltiple progresiva primaria (PP) o esclerosis múltiple con recaída progresiva (RP).
4. El uso de acuerdo con la reivindicación 1, en el que el anticuerpo se une selectivamente al polipéptido de SEQ ID NO: 2.
5. El uso de acuerdo con la reivindicación 4, en el que el anticuerpo comprende un dominio VH que comprende una secuencia de aminoácidos de SEQ ID NO: 3 y un dominio VL que comprende una secuencia de aminoácidos de SEQ ID NO: 4.
6. El uso de acuerdo con la reivindicación 4, en el que el anticuerpo comprende un dominio VH que comprende una secuencia de aminoácidos de SEQ ID NO: 3 y un dominio VL que comprende una secuencia de aminoácidos de SEQ ID NO: 4, internamente denominado Ab1 y compite con un anticuerpo seleccionado entre:
clon de IL-18R Anti-humano Monoclonal 70614, clon de IL-18R Anti-humano Monoclonal 70625, clon de IL-18R Anti-humano Monoclonal B-E43 y/o clon de IL-18R Anti-humano Monoclonal H44 para la unión a IL-18R humano.
7. El uso de acuerdo con cualquiera de las reivindicaciones 1 a 6, en el que el anticuerpo contra IL-18R se administra junto con un segundo agente terapéutico para tratar o prevenir la EM.
8. El uso de acuerdo con la reivindicación 7, en el que el anticuerpo contra lL18R se administra junto con corticosteroides, fármacos inmunodepresivos, agente neuroprotectores, fármacos inmunomoduladores o interferones.
9. El uso de acuerdo con la reivindicación 8, en el que el anticuerpo contra IL18R se administra junto con interferón-beta, preferiblemente con interferón beta-1a.
10. Un producto que comprende un anticuerpo contra IL-18R en el que el anticuerpo tiene un dominio de unión de antígeno que comprende seis CDR con una secuencia de aminoácidos que consiste en: SEQ ID NO: 5 que representa la cadena pesada de CDR1, SEQ ID NO: 6 que representa la cadena pesada de CDR2, SEQ ID NO: 7 que representa la cadena pesada de CDR3, SEQ ID NO: 8 que representa la cadena ligera de CDR1, SEQ ID NO: 9 que representa la cadena ligera de CDR2 y SEQ ID NO: 10 que representa la cadena ligera de CDR3 y un corticosteroide, un fármaco inmunodepresivo, un agente neuroprotector, un fármaco inmunomodulador o un interferón como una preparación combinada para el uso simultáneo, separado o secuencial en la terapia de la esclerosis múltiple en un mamífero, preferiblemente un sujeto humano.
11. El producto de acuerdo con la reivindicación 10, en el que el interferón es interferón-beta, preferiblemente el interferón beta-1a.
Patentes similares o relacionadas:
ANTICUERPOS MONOCLONALES FRENTE A EPHA2 Y PROCEDIMIENTOS DE USO DE LOS MISMOS, del 8 de Febrero de 2012, de MEDIMMUNE, LLC: Un anticuerpo aislado que se une específicamente a EphA2 con una Koff inferior a 3 x 10 -3 s -1 e induce fosforilación de la EphA2, en el […]
APLICACIONES TERAPÉUTICAS Y DIAGNÓSTICAS BASADAS EN LA FUNCIÓN DEL GEN CXCR-4 EN LA TUMORIGÉNESIS, del 3 de Febrero de 2012, de NORTHWEST BIOTHERAPEUTICS, INC.: Una composición farmacéutica para el tratamiento de la oncogénesis, que comprende un ácido nucleico antisentido complementario a al menos […]
MÉTODO PARA PURIFICAR ANTICUERPOS, del 3 de Febrero de 2012, de F. HOFFMANN-LA ROCHE AG: Método de purificación de una inmunoglobulina a partir de agregados de inmunoglobulina, que consta de las siguientes etapas: a) preparar una […]
ANTICUERPO BIESPECÍFICO QUE SUSTITUYE AL FACTOR VIII, del 13 de Diciembre de 2011, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Anticuerpo que reconoce un enzima proteolítico y un sustrato del mismo, en el que dicho anticuerpo es un anticuerpo biespecífico que puede actuar como cofactor que aumenta la […]
ANTICUERPOS HUMANIZADOS CONTRA EL RECEPTOR DE INTERFERON ALFA 1 (IFNAR-1), del 21 de Noviembre de 2011, de MEDAREX, INC.: Un anticuerpo humanizado, o fragmento de unión a antígeno del mismo, que se une específicamente al receptor de IFN alfa 1, que comprende: una región variable […]
USOS DE LA CITOQUINA IL-23 DE MAMÍFERO; REACTIVOS RELACIONADOS, del 2 de Noviembre de 2011, de SCHERING CORPORATION: El uso de un agonista de la IL-23 en la preparación de un medicamento para tratar una herida o para mejorar la cicatrización de heridas, en el que el agonista comprende: […]
CÉLULAS CON DEPRESIÓN O DELECIÓN DE LA ACTIVIDAD DE LA PROTEÍNA QUE PARTICIPA EN EL TRANSPORTE DE GDP-FUCOSA, del 5 de Julio de 2011, de KYOWA HAKKO KIRIN CO., LTD.: Una célula en la cual la actividad de un transportador de GDP-fucosa está suprimida o más disminuida que en su célula parental, donde la célula se selecciona entre los […]
COMPOSICIONES FARMACÉUTICAS DE ANTICUERPOS PARA ENFERMEDADES CAUSADAS POR VIRUS, del 3 de Junio de 2011, de THERANOR SPRL: Una composición farmacéutica para usar en el tratamiento de una enfermedad causada por virus de la gripe en seres humanos, conteniendo dicha composición una […]