MÉTODO DE DISCRIMINACIÓN DE AL MENOS DOS POBLACIONES CELULARES Y APLICACIÓN.
Un método de discriminación y de recuento de al menos dos poblaciones de elementos biológicos portadores de características biológicas específicas,
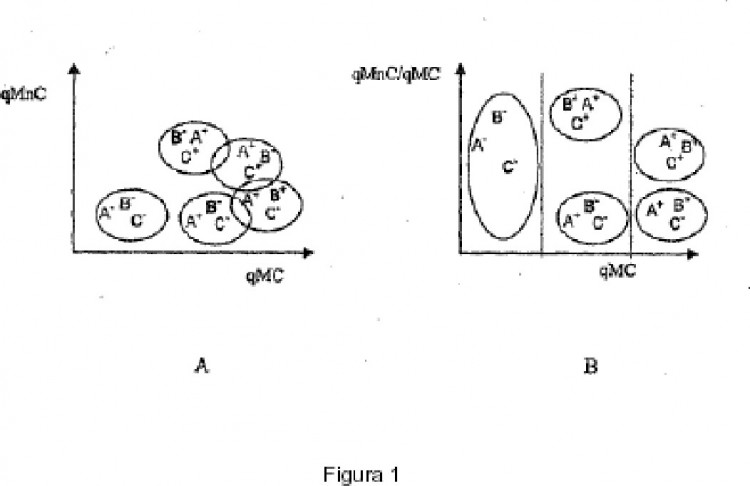
eventualmente presentes en una muestra, que comprende - el marcaje simultáneo de dichas poblaciones de elementos biológicos por tres sondas diferentes, detectables o convertidas en detectables por tres marcadores diferentes, de los cuales dos de dichos marcadores (marcadores solapantes o MC) presentan cada uno un espectro de emisión, dichos espectros de emisión se solapan y el tercero (marcador no solapante o MnC) presenta un espectro de emisión que no solapa los espectros de los otros dos marcadores (espectro de emisión no solapante); - la medida por todos los medios apropiados, de la cantidad total de marcador no solapante (qMnC), en una banda de detección elegida en el espectro de emisión de dicho marcador no solapante; - la medida por todos los medios apropiados, de la cantidad total de marcadores solapantes (qMC) en una banda de detección común a los espectros de emisión de dichos marcadores solapantes, - el establecimiento de la relación (R) de la cantidad total de marcadores no solapantes con respecto a la cantidad total de marcadores solapantes [R = (qMnC) / (qMC)] - el establecimiento por todos los medios de un diagrama que presenta la relación (R) en función de la cantidad de elementos biológicos marcados por el marcador solapante [R = f(qMC)]
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/FR2006/002645.
Solicitante: HORIBA ABX SAS.
Nacionalidad solicitante: Francia.
Dirección: RUE DU CADUCEE PARC EUROMEDECINE, F-34000 MONTPELLIER FRANCIA.
Inventor/es: LEFEVRE, DIDIER, VERIAC, SYLVIE, LACOMBE,Francis, BELLOC,Francis.
Fecha de Publicación: .
Fecha Solicitud PCT: 5 de Diciembre de 2006.
Clasificación Internacional de Patentes:
- G01N15/14G
- G01N33/50D
- G01N33/50D6
- G01N33/569H
- G01N33/58D
Clasificación PCT:
- G01N15/14 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 15/00 Investigación de características de partículas; Investigación de la permeabilidad, del volumen de los poros o del área superficial efectiva de los materiales porosos (identificación de microorganismos C12Q). › Investigación por medios electroópticos.
- G01N33/50 G01N […] › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › Análisis químico de material biológico, p. ej. de sangre o de orina; Ensayos mediante métodos en los que interviene la formación de uniones bioespecíficas con grupos coordinadores; Ensayos inmunológicos (procedimientos de medida o ensayos diferentes de los procedimientos inmunológicos en los que intervienen enzimas o microorganismos, composiciones o papeles reactivos a este efecto, procedimientos para preparar estas composiciones, procedimientos de control sensibles a las condiciones del medio en los procedimientos microbiológicos o enzimáticos C12Q).
- G01N33/569 G01N 33/00 […] › para microorganismos, p. ej. protozoarios, bacterias, virus.
- G01N33/58 G01N 33/00 […] › en los que intervienen sustancias marcadas (G01N 33/53 tiene prioridad).
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2357035_T3.pdf
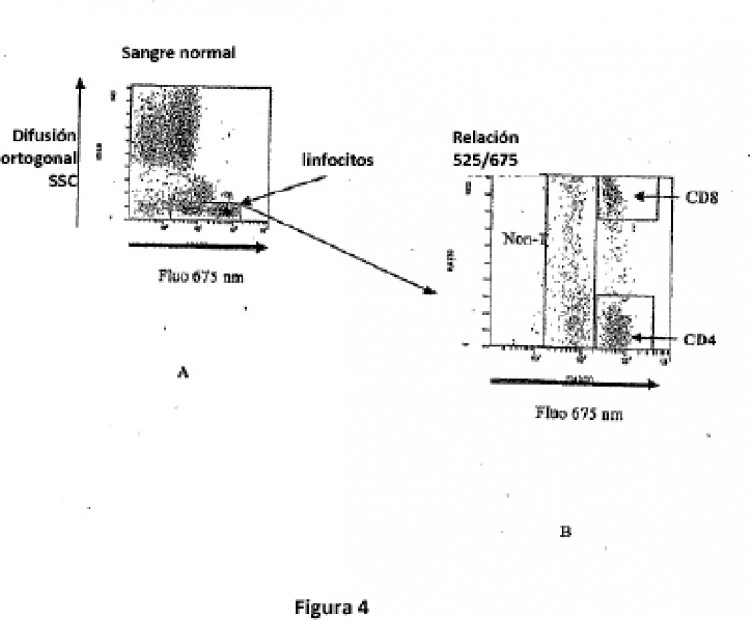
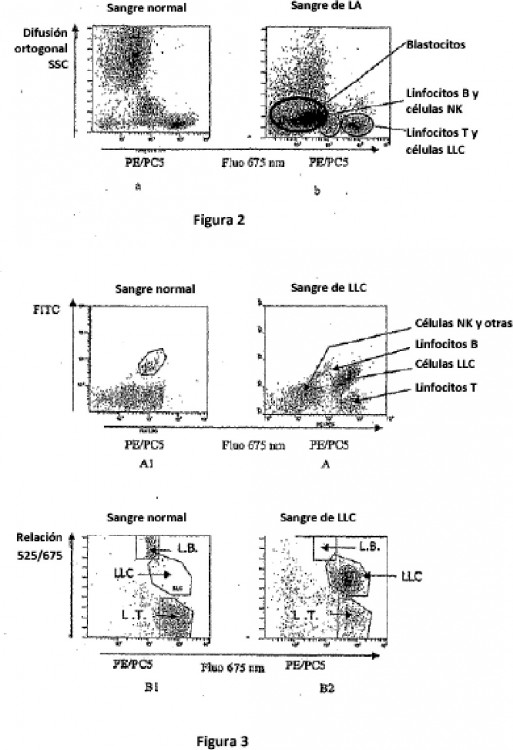
Fragmento de la descripción:
La presente invención se refiere a un método de detección, de discriminación y de recuento de elementos biológicos presentes en un líquido, que utiliza los principios de la citometría de flujo, adaptable a los aparatos utilizados rutinariamente en hematología.
Los analizadores automáticos en hematología (autómatas de hematología), presentes en el mercado aportan cada vez más posibilidades de análisis y de clasificación de los elementos analizados.
La medida de la fluorescencia, ya ampliamente extendida en la citometría de flujo, se utiliza principalmente para la clasificación de los elementos por inmunofenotipado. En los autómatas de hematología utilizados rutinariamente, está dedicada sobre todo a poner en evidencia los colorantes supravitales utilizados como sondas moleculares para la cuantificación de los ácidos nucleicos u otros componentes celulares.
La utilización de sondas inmunológicas en hematología de rutina no está generalizada todavía aunque algunos ensayos embrionarios ya han visto la luz para diferentes constructores.
Por ejemplo, la sociedad BAYER (Bayer Diagnostics, Tarrytown, New York, USA), a través de BAYER-TECHNICON H*1 ha sido la primera en proponer, en la tipificación linfocitaria, la utilización de cócteles de anticuerpos para la determinación de los diferentes tipos de linfocitos. En este caso, la medida de las expresiones antigénicas no se haría por fluorescencia sino por la medida de la absorbancia luminosa generada por un compuesto de avidina-peroxidasa que presenta una gran afinidad para la biotina, acoplada ella misma sobre un anticuerpo. Dicho anticuerpo es específico de los antígenos objetivos de las moléculas de superficie específicas de los tipos celulares caracterizados (CD4, CD8, CD2, CD19).
El ABBOTT CD4000, de la sociedad ABBOTT (Abbott Laboratories, Abbott Park, Illinois, USA), propone un análisis que utiliza dos longitudes de onda de fluorescencia para la realización, entre otros, de inmunofenotipados. La patente WO 98/02727 de la sociedad Abbott Laboratories describe un aparato de este tipo, que permite realizar el marcaje con un anticuerpo sobre una muestra de sangre total. ABBOTT describe de forma detallada en la patente un aparato destinado a la realización de reacciones anticuerpoantígeno sobre una muestra de sangre total.
Se debe poder utilizar un método de fenotipado simple, rápido, eficaz y específico en autómatas muy sencillos, de tipo autómatas de hematología, que permita trabajar con un número limitado de detectores. Aunque las tecnologías son sensiblemente las mismas, los autómatas de rutina utilizados en hematología presentan características diferentes de los citómetros de flujo, especialmente en términos de número de parámetros de medida que se reducen a los estrictamente necesarios, particularmente en las medidas de rutina. Además, siendo el coste un factor limitante muy importante, la simplificación de los aparatos y de los análisis que permiten efectuar no pueden más que seguir el sentido de la economía global.
La citometría de flujo es una tecnología que permite medir simultáneamente múltiples parámetros correspondientes a diferentes características físicas de un elemento biológico como por ejemplo una célula o un orgánulo celular. Los elementos biológicos se arrastran en un flujo líquido y el aparato registra el comportamiento de cada uno de ellos cuando pasan en la cubeta de medida por delante de una fuente luminosa.
Esta tecnología es de hecho la combinación de tres sistemas:
1) Sistema fluídico: Flujo laminar que permite a los elementos biológicos en suspensión pasar uno a uno delante de la luz en la cubeta de medida.
2) Sistema óptico: Rayos láser u otra fuente luminosa y diferentes filtros que permiten seleccionar las longitudes de onda apropiadas tanto en excitación como en emisión.
3) Sistema electrónico: PMT (fotomultiplicador) o fotodiodo, que capta la luz emitida, permitiendo su transformación en señal eléctrica y después en señal numérica.
En resumen, la fuente luminosa permite generar una luz que va a pasar a través de las lentes e iluminar los elementos biológicos que desfilan en una cubeta de medida. En contacto con el elemento biológico, una parte de la luz se difunde. Esta luz pasa a través de varias lentes y otros diafragmas y se focaliza sobre un sensor de tipo fotodiodo para generar la medida de FSC (dispersión frontal). Esta medida, en la gama de ángulos elegida, da una indicación del tamaño del elemento biológico.
Otra parte de la luz se desvía de forma ortogonal y pasa a través de otro conjunto de lentes, y de un juego de espejos semi-reflectantes, para ser medida a nivel de un sensor para generar la señal SSC (dispersión lateral). Esta medida de luz ortogonal, da una indicación de la densidad del elemento biológico así como de su granularidad (estructura).
Finalmente, las medidas de la intensidad luminosa se pueden realizar gracias tanto a tubos fotomultiplicadores o fotodiodos como a las longitudes de onda y a las señales ópticas a analizar.
El paso de los elementos biológicos en un citómetro necesita previamente una etapa a lo largo de la cual el elemento biológico se hace detectable, y por tanto marcado, por una sonda, específica de una estructura o de una función de dicho elemento biológico, habiéndose hecho la propia sonda previamente detectable.
Cuando el marcador de la sonda es una molécula fluorescente ésta puede absorber un fotón en una gama de longitud de onda que es específica del mismo (espectro de excitación). Así excitada, la molécula fluorescente, va a volver a su estado fundamental, y restituir un fotón con una energía más débil. Una molécula fluorescente posee por tanto un espectro de longitudes de onda de excitación que le es propio y en el cual ella va a absorber la energía para emitirla de nuevo bajo forma de fluorescencia (fluorescencia emitida), según un espectro de emisión igualmente característico. La longitud de onda de la fluorescencia emitida es siempre mayor (frecuencia más débil) que la longitud de onda de excitación.
Las señales de difusión (FSC, SSC) y de fluorescencia van a ser transformadas en señales eléctricas por los detectores adaptados, y después analizadas por un sistema informático.
Así en la citometría de flujo, comúnmente una banda de longitudes de onda de fluorescencia está asociada con cada sonda o cóctel de sondas utilizados. Cada sonda está pues acoplada con un fluorocromo (marcador fluorescente), en el que las señales se miden sobre un solo canal de fluorescencia, aunque dicho fluorocromo esté injertado sobre uno o varios tipos de sondas. Por ejemplo, el documento EP0633462 describe un método de discriminación de diferentes células linfocitarias mediante el marcaje simultáneo de dichas poblaciones por tres anticuerpos monoclonales hechos detectables por tres fluorocromos diferentes. Los documentos Hawley et al. (BioTechniques 30, (2001) Nº 5, 1028-1034) y Maurer et al. (Journal of Immunological Methods, (1990) Nº 135, 43-47) describen igualmente cada uno la utilización de la citometría de flujo para detectar varios marcadores.
La disminución de los costes podría pasar por la utilización de parámetros de inmunofenotipado con un número restringido de canales de medida de fluorescencia además de los parámetros físicos clásicos elegidos entre la difusión en el eje (dispersión frontal o FSC), la difusión ortogonal (dispersión lateral o SSC), el volumen por impedanciometría, etc.
La posibilidad de sumar las respuestas de fluorescencia permitiría expresar varios marcajes diferentes sobre un mismo canal de medida y multiplicar así las capacidades de análisis de un sistema y por tanto su relación precio/prestación, sin aumentar por tanto la complejidad del aparato por adición de canales de medida.
La dificultad cuando varias sondas están conjugadas con el mismo fluorocromo, es que la expresión de las características biológicas reconocidas respectivamente por las diferentes sondas, va a influir directamente en la cantidad de fluorescencia total emitida.
Así, por ejemplo, si una característica biológica está fuertemente presente (por ejemplo un antígeno en la superficie de una célula) la cantidad de sondas marcadas y fijadas, será proporcional a la cantidad de dicha característica biológica. En consecuencia la cantidad de fluorescencia emitida por dicha sonda, ella misma... [Seguir leyendo]
Reivindicaciones:
1.) Un método de discriminación y de recuento de al menos dos poblaciones de elementos biológicos portadores de características biológicas específicas, eventualmente presentes en una muestra, que comprende
- el marcaje simultáneo de dichas poblaciones de elementos biológicos por tres sondas diferentes, detectables o convertidas en detectables por tres marcadores diferentes, de los cuales dos de dichos marcadores (marcadores solapantes o MC) presentan cada uno un espectro de emisión, dichos espectros de emisión se solapan y el tercero (marcador no solapante o MnC) presenta un espectro de emisión que no solapa los espectros de los otros dos marcadores (espectro de emisión no solapante);
- la medida por todos los medios apropiados, de la cantidad total de marcador no solapante (qMnC), en una banda de detección elegida en el espectro de emisión de dicho marcador no solapante;
- la medida por todos los medios apropiados, de la cantidad total de marcadores solapantes (qMC) en una banda de detección común a los espectros de emisión de dichos marcadores solapantes,
- el establecimiento de la relación (R) de la cantidad total de marcadores no solapantes con respecto a la cantidad total de marcadores solapantes [R = (qMnC) / (qMC)]
- el establecimiento por todos los medios de un diagrama que presenta la relación (R) en función de la cantidad de elementos biológicos marcados por el marcador solapante [R = f(qMC)].
2.) El método según la reivindicación 1, caracterizado porque comprende además, una última etapa de cuantificación por todos los medios de las poblaciones de los elementos biológicos presentes sobre dicho diagrama.
3.) El método según una de las reivindicaciones 1 o 2, caracterizado porque el líquido biológico natural es la sangre, la orina, un tejido disociado, la médula ósea, el líquido céfalo-raquídeo, el líquido pleural, el líquido sinovial, el producto resultante de un procedimiento de aféresis.
4.) El método según una cualquiera de las reivindicaciones 1 a 3, caracterizado porque los elementos biológicos eventualmente presentes en el líquido son células eucariotas o células procariotas,
o una mezcla de las dos, o fragmentos de dichas células.
5.) El método según una cualquiera de las reivindicaciones 1 a 4, caracterizado porque las sondas, idénticas o diferentes, son anticuerpos o ácidos nucleicos (ADN o ARN), o colorantes específicos de los ácidos nucleicos o sustratos enzimáticos o incluso marcadores específicos de proteínas, ligandos de receptores o marcadores sensibles al entorno iónico o cualquier otra molécula característica del elemento biológico deseado.
6.) El método según la reivindicación 5, caracterizado porque los anticuerpos son anticuerpos monoclonales o policlonales, naturales o recombinantes, humanos o animales.
7.) El método según una cualquiera de las reivindicaciones 1 a 6, caracterizado porque los marcadores que sirven para hacer detectable la sonda, son marcadores, intercalantes o no, de los ácidos nucleicos, o también marcadores específicos de las proteínas o cualquier otra molécula característica del elemento biológico deseado.
8.) El método según una cualquiera de las reivindicaciones 1 a 7, caracterizado porque los marcadores son marcadores fluorescentes o no.
9.) El método según una cualquiera de las reivindicaciones 7 u 8, caracterizado porque el marcador se elige entre Alexa Fluor® 350, Alexa Fluor® 488, Alexa Fluor® 532, Alexa Fluor® 633, Alexa Fluor® 647, Alexa Fluor® 660, Alexa Fluor® 680, aloficocianina, aminometilcumarina ácido acético, Cy2®, Cy 5.1®, Cy 5®, Cy 5.5®, diclorofluoresceína (DCFH), dihidrorrodamina (DHR), "GFP mejorada" (EGFP), Fluo-3, FluorX®, fluoresceína, 5-maleimida-fluoresceína, isotiocianato de fluoresceína (FITC), PerCP, r-Ficoeritrina (PE), el tándem r-Ficoeritrina-Cianina 5 o SpectralRed® o CyChrome®, r-Ficoeritrina-Cianina
5.5 (PE-CY 5.5®), r-Ficoeritrina-Cianina 7 (PE-CY 7®), r-Ficoeritrina-Texas Red-x®, Red 613®, Rodamina 110, Rodamina 123, S65L, S65T, isotiocianato de tetrametilrrodamina, Texas-Red-x®, TruRed®, indo 1, los nanocristales (Quantum Dots), Fura 2, Fura 3, quin, DS Red, los compuestos intercalantes tal como el bromuro de etidio o también el naranja de tiazol, el azul de tiazol, la tioflavina S, la tioflavina T, la tioflavina TCN®, el yoduro de dietil-quinoliltiocianina (DEQTC), TOTO-1®, TO-PRO-1®, o también YOYO-1®, Hoechst® 33258, Hoechst® 33342, Hoechst® 34580, el diamidino-fenilindol (DAPI), el yoduro de propidio, la pironina Y, la 7-Aminoactinomicina D (7AAD), el naranja de acridina, la auramina O, la calceína, el nuevo azul de metileno, olamina-O, Oxazina 750, el azul astra, verde SYTOX®, SYTO 11®, SYTO 12®, SYTO 13®, SYTO 16®, SYTO 18®, SYTO 80®, SYTO 81®.
10.) La utilización del método según una cualquiera de las reivindicaciones precedentes para discriminar al menos dos poblaciones de elementos biológicos portadores de características específicas y eventualmente presentes en una muestra.
Patentes similares o relacionadas:
ENSAYO PARA IDENTIFICAR CÉLULAS PRODUCTORAS DE ANTICUERPOS, del 13 de Febrero de 2012, de UCB PHARMA, S.A.: Un ensayo homogéneo in vitro para identificar una célula productora de anticuerpos que produce un anticuerpo que se une a un antígeno seleccionado que comprende: a) […]
ANÁLISIS SECUENCIAL DE MUESTRAS BIOLÓGICAS CON BLANQUEO DE SEÑALES FLUORESCENTES INTERMEDIAS, del 4 de Enero de 2012, de GENERAL ELECTRIC COMPANY: Un procedimiento de detectar múltiples dianas en una muestra biológica, que comprende: (a) poner en contacto la muestra con una primera sonda; (b) unir […]
ANÁLISIS SECUENCIAL DE MUESTRAS BIOLÓGICAS CON BLANQUEO INTERMEDIO DE DETECTOR DE FLUORESCENCIA, del 4 de Enero de 2012, de GENERAL ELECTRIC COMPANY: Un procedimiento de sondar múltiples dianas en una muestra biológica, que comprende: (a) proporcionar una muestra biológica que contiene […]
ANÁLISIS SECUENCIAL DE MUESTRAS BIOLÓGICAS, del 29 de Diciembre de 2011, de GENERAL ELECTRIC COMPANY: Un procedimiento de sondar múltiples dianas en una muestra biológica, que comprende: (a) proporcionar una muestra biológica que contiene múltiples dianas (b) unir al menos una […]
PROCEDIMIENTO PARA LA DETECCIÓN DE MÚLTIPLES ANALITOS, del 13 de Diciembre de 2011, de SIEMENS HEALTHCARE DIAGNOSTICS PRODUCTS GMBH: Método para determinar la presencia o las cantidades relativas de más de dos analitos diferentes que se sospecha que están en un medio, comprendiendo […]
PROCEDIMIENTO PARA AUMENTAR LA EMISIÓN DE LUZ A PARTIR DE UNA REACCIÓN QUIMIOLUMINISCENTE, del 14 de Noviembre de 2011, de CYANAGEN SRL: Un procedimiento para aumentar la emisión de luz producida por la reacción quimioluminiscente del luminol, una enzima peroxidasa, un oxidante […]
COMPUESTOS LUMINISCENTES, del 4 de Mayo de 2011, de Luminex Corporation: Una composición de materia que comprende un compuesto fotoluminiscente, compuesto fotoluminiscente que tiene la estructura: en la que: (a) […]
IMPLANTES RECUBIERTOS DE APTÁMEROS QUE PROPORCIONAN ADHESIÓN A LAS CÉLULAS PRECURSORAS ENDOTELIALES, del 3 de Junio de 2011, de EBERHARD-KARLS-UNIVERSITAT TUBINGEN UNIVERSITATSKLINIKUM: Implante que tiene por lo menos una superficie que está en contacto con tejidos y/o líquidos del cuerpo humano o animal, que está recubierta por lo menos parcialmente […]