Método para determinar la metilación de ADN en muestras de sangre u orina.
Método para determinar el estado de metilación de por lo menos una citosina,
un patrón de metilación, o ambos en el ADN de una muestra de sangre, una muestra de plasma, una muestra de suero o una muestra de orina de un individuo, que comprende:
(a) proporcionar dicha muestra que comprende ADN;
(b) aislar el ADN de dicha muestra;
(c) tratar el ADN aislado con un reactivo bisulfito en presencia de un captador de radicales; y (d) determinar el estado de metilación de por lo menos una citosina en el ADN de dicha muestra, estando cada citosina localizada en una posición definida y/o de un patrón de metilación en el ADN de dicha muestra, con una reacción de amplificación a base de polimerasa y/o un ensayo basado en una amplificación. en el que dicho ADN tratado con bisulfito de la etapa (c) es sometido directamente a la etapa (d) sin desulfonación previa y en el que la desulfonación se produce durante el aumento inicial de temperatura de la reacción de amplificación.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/014667.
Solicitante: EPIGENOMICS AG.
Nacionalidad solicitante: Alemania.
Dirección: KLEINE PRÄSIDENTENSTRASSE 1 10178 BERLIN ALEMANIA.
Inventor/es: BERLIN, KURT, SCHUSTER, MATTHIAS, TETZNER,REIMO, DIETRICH,DIMO, SLEDZIEWSKI,ANDREW, MODEL,FABIAN, BALLHAUSE,MATTHIAS, LIEBENBERG,Volker, DEVOS,Theo, LOFTON-DAY,Cathy, LOGRASSO,Joe, MAAS,Jennifer.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2382746_T3.pdf
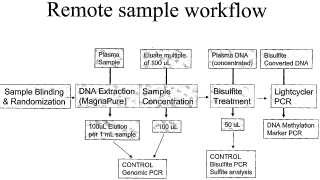
Fragmento de la descripción:
Método para determinar la metilación de ADN en muestras de sangre u orina.
La presente invención se refiere de forma general a composiciones y métodos nuevos o sustancialmente mejorados para proporcionar fragmentos de ADN derivados de una muestra remota y para los análisis de los mismos.
Referencias cruzadas a las solicitudes relacionadas
La presente solicitud reivindica el beneficio de prioridad a las solicitudes de patente provisional US: 60/672.242, presentada el 15 abril 2005; 60/676.997, presentada el 02 mayo 2005; 60/697.521, presentada el 08 julio 2005; 60/723.602, presentada el 04 octubre 2005; y 60/780.248, presentada el 08 marzo 2006.
Listado de secuencias
Un listado de secuencias, que comprende las SEC ID N.º 1-15, se incluye y adjunta en formato de papel formando parte de la presente solicitud.
Antecedentes de aspectos de la invención
Desarrollo de una prueba médica. La probabilidad de curar una enfermedad (por ejemplo un cáncer) depende muchas veces principalmente de la temprana detección de la misma. Con frecuencia también resulta ventajoso detectar una predisposición para la enfermedad o, por ejemplo, si ésta se halla en un estado avanzado, realizar una estimación del tratamiento más adecuado. La detección, prevención o estimación precoz reduce los costes del tratamiento médico directo y asociado. Asimismo, garantiza una mejor calidad de vida para el paciente afectado.
Esto hace necesario analizar un gran número de muestras procedentes de individuos en los que se sospecha la enfermedad, la mayoría de los cuales posiblemente no estará afectado por la misma. O, en el caso de los pacientes con una enfermedad diagnosticada, es preciso analizar muchas muestras y sólo un pequeño porcentaje responderá a un cierto tratamiento.
En general, es deseable que una prueba posea la mayor sensibilidad, especificidad y exactitud posibles. La sensibilidad es una medida de la capacidad de una prueba para detectar correctamente la enfermedad de interés en un individuo analizado. Una prueba dotada de una mala sensibilidad produce una alta tasa de falsos negativos, es decir, de individuos realmente afectados por la enfermedad que la prueba no detecta como tales. El riesgo que entraña el falso negativo es que el individuo enfermo permanezca sin diagnosticar y sin tratamiento durante un tiempo, periodo durante el cual la enfermedad puede avanzar hasta un estadio posterior en el que los tratamientos, si los hay, pueden ser menos eficaces. Matemáticamente se puede describir como: Sensibilidad = TP/ (TP+FN) , donde TP representa un resultado positivo verdadero y FN un resultado falso negativo. Un resultado positivo verdadero significa que la prueba es positiva y que la enfermedad está presente, mientras que un resultado falso negativo supone que la prueba es negativa pero la enfermedad no está presente.
Un ejemplo de una prueba dotada de una baja sensibilidad es un análisis de sangre de proteínas para detectar el VIH. Este tipo de pruebas adolece de una mala sensibilidad porque es incapaz de detectar la presencia del virus hasta que la enfermedad está arraigada y el virus ha invadido el torrente sanguíneo en número sustancial. En cambio, un ejemplo de prueba dotada de una alta sensibilidad es la detección de la carga viral mediante la reacción en cadena de la polimerasa (PCR) . Esa alta sensibilidad es posible porque este tipo de prueba puede detectar cantidades muy pequeñas del virus. La elevada sensibilidad es particularmente importante cuando las consecuencias de pasar por alto el diagnóstico son importantes.
La especificidad, por su parte, es una medida de la capacidad de una prueba para identificar con precisión a los pacientes que no están afectados por la enfermedad. Una prueba que posea una mala especificidad producirá una alta tasa de falsos positivos, es decir, individuos que son identificados como enfermos sin estarlo. Uno de los inconvenientes de los falsos positivos es que obligan a los pacientes a someterse a procedimientos o tratamientos médicos innecesarios y a afrontar los riesgos y el estrés emocional y económico que comportan, aparte de los efectos adversos que pueden tener en su salud. Una característica de las enfermedades que dificulta el desarrollo de pruebas diagnósticas dotadas de una alta especificidad es que los mecanismos de la enfermedad, particularmente del cáncer, implican a menudo una pluralidad de genes y proteínas. Además, ciertas proteínas pueden estar elevadas por motivos ajenos a la enfermedad. Matemáticamente, la especificidad se puede definir como: Especificidad = TN/ (FP+TN) , donde TN representa un resultado negativo verdadero y FP un resultado falso positivo. Un resultado negativo verdadero es aquel en que la prueba es negativa y la enfermedad no está presente. Un resultado falso positivo se da cuando la prueba es positiva pero la enfermedad no está presente.
Un ejemplo de una prueba dotada de una alta especificidad es la prueba génica que puede detectar una mutación en p53. La especificidad es importante cuando el coste o el riesgo asociados con los procedimientos diagnósticos o las intervenciones médicas ulteriores son muy altos.
La exactitud es una medida de la capacidad de la prueba de detectar correctamente la enfermedad de interés en un individuo analizado y, al mismo tiempo, de identificar con precisión a los pacientes que no la padecen. Así pues, la exactitud describe simultáneamente la sensibilidad y la especificidad de una prueba. Matemáticamente se define como: exactitud = (TP+TN) /N, donde TP representa los resultados positivos verdaderos, TN los resultados negativos verdaderos y N el número de pacientes analizados.
En general, por razones evidentes, una prueba de elección debería poseer además por lo menos uno de los siguientes criterios, si no todos: (i) alto grado de estandarización, (ii) gran capacidad de automatización, (iii) evitar la contaminación cruzada de muestras, (iv) bajo esfuerzo de manejo, (v) bajo coste, (vi) facilidad de manejo, (vii) alta reproducibilidad, (viii) alta fiabilidad.
Por supuesto, todas las especificaciones descritas anteriormente no sólo son aplicables a la prueba en sí misma. También son aplicables al flujo de trabajo que comprende desde la recogida de una muestra hasta el inicio real de la prueba. En otras palabras, un flujo de trabajo adecuado debe permitir una prueba con dichas especificaciones.
Material de partida para una prueba. Que una prueba se pueda realizar de manera no invasiva resulta ventajoso en términos de reducción de costes y de calidad de vida para el paciente. Si ello no es posible, es deseable que se realice por medios invasivos que afecten lo mínimo posible al paciente, que sean de fácil ejecución, tengan un bajo coste, o combinaciones de esto mismo. Por esa razón, las muestras remotas como son por ejemplo sangre, esputo, heces o líquidos corporales constituyen el material de partida de elección para una prueba.
Sin embargo, la utilización de muestras remotas resulta bastante limitada por la escasa cantidad de ADN, en particular por la escasa cantidad de ADN originado por la célula o el tejido enfermos. Por consiguiente, el flujo de trabajo desde la recogida de la muestra hasta el inicio de la prueba debe estar caracterizado por un alto rendimiento en la obtención del ADN.
En la mayoría de casos el ADN de interés se encuentra en la muestra muy diluido. Normalmente menos del 1% es relevante para la prueba en cuestión. Esto pone de manifiesto todavía más que el flujo de trabajo para la recogida, preparación y procesamiento del ADN antes de la prueba debe estar caracterizado por el alto rendimiento en la obtención del ADN.
Otra dificultad de la utilización de muestras remotas deriva del riesgo de contaminación por una gran cantidad de células y, por ende, de ADN. Así pues, la contaminación no guarda ninguna relación con la cuestión de en qué se basa la prueba. Por ejemplo, tales contaminaciones son bacterias como E .coli en las muestras fecales o eritrocitos en las muestras de plasma o suero. Estas contaminaciones son especialmente críticas si interfieren con la detección del ADN de interés o si están presentes en grandes cantidades. En este último caso, el porcentaje de ADN de interés resulta tan pequeño que no puede ser detectado. Por esa razón el flujo de trabajo para recoger, suministrar y procesar el ADN antes de someterlo a una prueba debe ser suficientemente seguro para eliminar con eficacia tales contaminaciones.
Asimismo, el ADN de interés contenido... [Seguir leyendo]
Reivindicaciones:
1. Método para determinar el estado de metilación de por lo menos una citosina, un patrón de metilación, o ambos en el ADN de una muestra de sangre, una muestra de plasma, una muestra de suero o una muestra de orina de un individuo, que comprende:
(a) proporcionar dicha muestra que comprende ADN;
(b) aislar el ADN de dicha muestra;
(c) tratar el ADN aislado con un reactivo bisulfito en presencia de un captador de radicales; y
(d) determinar el estado de metilación de por lo menos una citosina en el ADN de dicha muestra, estando cada citosina localizada en una posición definida y/o de un patrón de metilación en el ADN de dicha muestra, con una reacción de amplificación a base de polimerasa y/o un ensayo basado en una amplificación.
en el que dicho ADN tratado con bisulfito de la etapa (c) es sometido directamente a la etapa (d) sin desulfonación previa y en el que la desulfonación se produce durante el aumento inicial de temperatura de la reacción de amplificación.
2. Método según la reivindicación 1, en el que el ADN de dicha muestra está caracterizado porque menos del 5%, menos del 3%, menos del 1%, o menos del 0, 1% del ADN procede de un cáncer de próstata o de un cáncer de un órgano del tubo digestivo.
3. Método según la reivindicación 1, en el que dicha muestra está caracterizada porque comprende menos de 60 ng de ADN en 1 ml de muestra o menos de 10 ng de ADN en 1 ml de muestra.
4. Método según la reivindicación 1, en el que la pérdida de ADN es minimizada mediante por lo menos un método seleccionado de entre el grupo constituido por: un método de aislamiento del ADN caracterizado porque presenta unos rendimientos elevados del ADN; una precisión elevada del pipeteo; una reutilización del dispositivo de pipeteo; y una reutilización del dispositivo que ha estado en contacto con el ADN.
5. Método según la reivindicación 1, en el que dicha muestra es plasma, y proporcionar la muestra de plasma comprende una o más de las etapas siguientes:
(a) obtener sangre de un individuo;
(b) añadir EDTA (ácido etilendiaminotetraacético) a la sangre que comprende una mezcla suave;
(d) transferir el plasma a un nuevo recipiente;
(e) centrifugar el plasma;
(f) transferir el plasma recentrifugado a un nuevo recipiente;
(g) enfriar una muestra que comprende plasma;
(h) congelar, almacenar o transportar una muestra que comprende plasma; y
(i) proporcionar dicha muestra a partir de la obtención de sangre de un individuo hasta la congelación del plasma recentrifugado correspondiente dentro de un periodo de aproximadamente 8 horas.
6. Método según la reivindicación 1, en el que dicha muestra es orina y proporcionar la muestra de orina comprende una o más de las etapas siguientes:
(a) realizar una palpación de la próstata, un masaje prostático o ambos desde la mitad de la próstata hasta el lado izquierdo de la próstata, hasta el lado derecho de la próstata o ambos;
(b) recoger la orina miccionada;
(c) añadir EDTA a la orina; en el que el EDTA presenta un pH de aproximadamente 5, 0, aproximadamente 6, 0, aproximadamente 7, 0, aproximadamente 7, 5, aproximadamente 8, 0, aproximadamente 8, 5, aproximadamente 9, 0, o aproximadamente 10;
(d) enfriar la muestra que comprende orina;
(e) congelar, almacenar o transportar la muestra que comprende orina; y
(f) proporcionar la muestra de orina desde la recogida de la orina miccionada hasta la congelación de la mezcla de orina-EDTA correspondiente dentro de un periodo de aproximadamente 120 min.
7. Método según la reivindicación 1, en el que dicha muestra es dividida en diferentes submuestras después de proporcionar dicha muestra, y/o en el que dicha muestra o por lo menos un componente de dicha muestra se concentra después de proporcionar dicha muestra.
8. Método según la reivindicación 7, en el que la concentración comprende ultrafiltración, reducción del volumen, o ambos.
9. Método según la reivindicación 1, en el que el aislamiento del ADN comprende una más de las etapas siguientes: tratar dicha muestra con una proteasa; tratar dicha muestra con por lo menos una solución o reactivo degradante de proteínas; poner en contacto el ADN de dicha muestra con un dispositivo purificador de ADN; lavar el ADN con el dispositivo purificador de ADN; y recuperar el ADN del dispositivo purificador de ADN.
10. Método según la reivindicación 1, en el que tratar el ADN con un reactivo bisulfito comprende las etapas de: mezclar aproximadamente 10 hasta aproximadamente 250 μl de una solución que comprende ADN con aproximadamente 45 a aproximadamente 750 μl de solución de bisulfito, presentando la solución de bisulfito un pH en el intervalo de aproximadamente 5, 45 a aproximadamente 5, 50 que comprende aproximadamente 4, 83 a aproximadamente 4, 93 mol/1 de hidrogenosulfito; añadir aproximadamente 5 a aproximadamente 500 μl de una solución de captador de radicales orgánico, comprendiendo la solución un solvente orgánico y aproximadamente 10 a aproximadamente 750 mmol/l de ácido º-hidroxi-2, 5, 7, 8-tetrametil-cromano-2-carboxílico; y aplicar un protocolo de temperatura durante aproximadamente 2 a aproximadamente 18 h, en el que la reacción se lleva a cabo en un intervalo de temperatura de aproximadamente 0 a aproximadamente 80°C con aproximadamente 2 a aproximadamente 5 aumentos adicionales de la temperatura, en cada caso durante aproximadamente 0, 5 a aproximadamente 10 min, hasta una temperatura de aproximadamente 85 a aproximadamente 100°C que incluye un aumento inicial de la temperatura hasta una temperatura de aproximadamente 85 a aproximadamente 100°C.
11. Método según la reivindicación 1, en el que la determinación del estado de metilación de por lo menos una citosina, un patrón de metilación, o de ambos permite el diagnóstico de, proporcionar un pronóstico de, predecir una respuesta al tratamiento de, determinar una predisposición a, predecir una predisposición a, determinar una progresión de, predecir una progresión de, graduar, estadificar un estado, clasificar un estado, o caracterizar una enfermedad proliferativa o un cáncer de un órgano del tubo digestivo, preferentemente de un cáncer colorrectal, o de un cáncer de próstata.
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]