METODO PARA LA DETERMINACION DE ARGININA, ARGININAS METILADAS Y SUS DERIVADOS.
Método para la detección de uno o más analitos del grupo formado por arginina,
su derivado monometilado monometilarginina (MMA), sus derivados demetilados dimetilarginina asimétrica (ADMA) y dimetilarginina simétrica (SDMA) en muestras biológicas que comprende los pasos de derivación y detección de analitos, estando caracterizado porque
- los analitos son derivados en su función ácido carboxílico, preferentemente mediante esterificación de ácido, particularmente por medio de metanol, etanol y/o butanol, o por amidación, particularmente por medio de dietilamina;
- los derivados obtenidos de analitos se detectan simultáneamente por detección espectroscópica de masas, preferentemente detección espectroscópica de masas tándem
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E04026164.
Solicitante: UNIVERSITATSKLINIKUM HAMBURG-EPPENDORF
UNIVERSITAT HAMBURG.
Nacionalidad solicitante: Alemania.
Dirección: MARTINISTRASSE 52,20246 HAMBURG.
Inventor/es: BOGER,RAINER, SCHWEDHELM,EDZARD, MAAS,RENKE, RIEDERER,ULRICH.
Fecha de Publicación: .
Fecha Solicitud PCT: 4 de Noviembre de 2004.
Fecha Concesión Europea: 1 de Abril de 2009.
Clasificación Internacional de Patentes:
- G01N33/68A2D
- G01N33/68A8
Clasificación PCT:
- G01N33/68 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › en los que intervienen proteínas, péptidos o aminoácidos.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Método para la determinación de arginina, argininas metiladas y sus derivados.
La presente invención está en el campo de los métodos de ensayo y, en particular, métodos de ensayo para arginina y derivados de la misma.
La arginina (ARG) y derivados metilados de ella juegan un papel importante para la concentración biológica disponible del óxido nítrico (NO).
NO es esencial en varios procesos fisiológicos, es decir, en la homeostasis del sistema cardiovascular, defensa del huésped, señalización neuronal, migración celular y apoptosis. NO se forma en el endotelio por la isoforma constitutiva, endotelial de la sintasa de óxido nítrico utilizando ARG como sustrato. Las tres isoformas de la sintasa de óxido nítrico en humanos se ven inhibidas por el inhibidor endógeno monometil arginina (MMA) y dimetil arginina asimétrica (ADMA) con ADMA siendo más importante que MMA debido a que tiene hasta diez veces mayor concentración en el plasma humano. ADMA y MMA se originan de la metilación de arginina de proteínas por metiltransferasas de arginina de proteínas (PRMTs) después de la degradación de proteínas. De esta manera, también se produce la dimetilarginina simétrica (SDMA), la que no ejerce actividad biológica, sin embargo. Aproximadamente una quinta parte de la ADMA se excreta renalmente en el hombre mientras que la degradación enzimática por dimetilaminohidrolasa de dimetilarginina (DDAH) es la principal vía de eliminación de ADMA.
Un breve esquema, se indica a continuación

El desequilibrio del suministro y la exigencia de NO puede ser el paso inicial para cambios patológicos. Las pruebas acumuladas vinculan dicho desequilibrio de homeostasis a ADMA. Hasta la fecha, se ha mostrado que el ADMA circulante está alterado en pacientes que sufren de enfermedades cardiovasculares y neurológicas, así como de disfunción eréctil. Concentraciones plasmáticas elevadas de ADMA se encuentran en distintos entornos clínicos que van desde la insuficiencia renal a la aterosclerosis, hipertensión, diabetes, preclampsia, enfermedad de Alzheimer e incluso depresión o esquizofrenia.
Además, en pacientes con enfermedades cardiovasculares o renales elevadas concentraciones de plasma ADMA predicen independientemente progresión de aterosclerosis y mortalidad. Hasta ahora, la causalidad de las enfermedades cardiovasculares es considerada posible pero no probada definitivamente: La infusión de ADMA mejora la vasodilatación endotelio-dependiente en humanos.
El hecho de que la vida ha desarrollado un mecanismo enzimático altamente específico para la degradación de ADMA proporciona mayor evidencia de un papel directa (patóo-) fisiológico de ADMA. Por lo tanto, es importante seguir examinando el papel de ADMA, que requiere un método analítico capaz de un flujo alto de muestras.
En el estado de la técnica, han sido descritos métodos para la determinación de ADMA, SDMA y ARG como espectrofotometría, electroforesis capilar (CE) y ensayos basados en ELISA, HPLC, MS y tándem-MS.
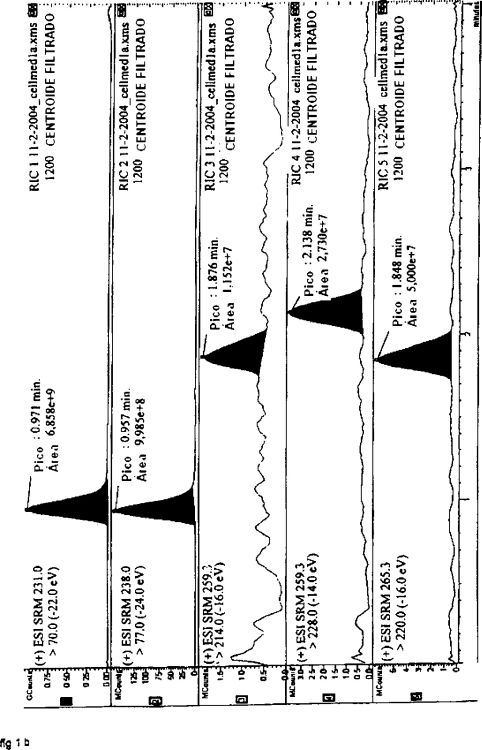
Los actuales métodos analíticos para la medición de ADMA se centran en el uso de HPLC-MS o HPLC-MS/MS. Por ejemplo, Martens Lobenhoffer et al. (Martens Lobenhoffer J, Bode-Böger SM., J Chromatogr B analítica Technol Biomed Life Sci, 2003 Dec. 251; 798(2), 231-39) usaron derivados de o-ftaldialdehído (OFA) - 2-mercaptoetanol de ADMA, SDMA y ARG para mejorar la separación cromatográfica de los analitos. Esto era fundamental ya que los analitos sufren similares disociaciones que conducen a espectros tándem-MS muy similares. de forma que este método más específico no podía utilizarse. En su lugar, Martens-Lobenhoferet et al usaron MS en el modo de escáner completo de espectrometría de masa simple. El tiempo total del análisis fue de más de 32 minutos, que es demasiado largo para análisis de alto flujo o de cribado. Otra desventaja del método aplicado por Martens-Lobenhofer et al. es la escasa estabilidad de los derivados OPA de los analitos, que por lo tanto tienen que ser analizados on-line.
Vishwanathan et al. (Vishwanathan K, Tacket RL, Stewart JT, Bartlett MG; J Chromatogr B Biomed Sci. Appl., 2000 Oct 1; 748 (1), 157-66) omite el paso de derivación y analizaron los aminoácidos libres no derivados. Separaron los aminoácidos mediante HPLC utilizando una columna de sílice. Aunque eran capaces de utilizar el tándem-MS, Vishwanathan et al. encontraron que ADMA y SDMA muestran unos espectros MS-MS muy similares debido a sus reacciones de disociación muy similares. Por ejemplo, el m/z de 158 usado para la cuantificación de ADMA (203
Huang et al. (Huang LF, Guo FQ, YZ Liang, Li BY, Cheng BM; Bioanal Anal Chem, 2004 Sep. 24; epub adelantada a impresión) también omitió el paso de derivación para acelerar el proceso analítico. Utilizaron LC-MS para analizar los analitos como aminoácidos libres. Se hizo una separación cromatográfica mediante una columna RP18, y de nuevo fue crucial, ya que ADMA y SDMA mostraron similares espectros de masas. El total de tiempo de análisis fue de más de 7 minutos, que sin embargo todavía no es adecuado para los análisis de rutina. Por otra parte, en una muestra de plasma analizada por el Huang et al., no pudo lograrse una separación de línea de base como puede verse en la fig. 3 del presente documento. Esto da lugar a una incorrecta cuantificación. Además, la separación isocrática aplicada dará lugar a la acumulación de matriz de muestra en la columna en caso de métodos de análisis de alto flujo.
De acuerdo con el estado de la técnica, una detección simultánea no parece ser posible y la separación cromatográfica parece ser crucial para determinar claramente la concentración de estos analitos. Aunque el paso de derivación se omite, tiempo de análisis es aún largo para llevar a cabo experimentos de detección. En resumen, en el estado del arte no se describe ningún método adecuado de análisis de alto rendimiento. Esto limita la mejora de investigación de ADMA,y por lo tanto limita el progreso médico y farmacéutico.
Es objeto de la invención superar las limitaciones del estado de la técnica y desarrollar una metodología para detectar ARG y sus derivados (por ejemplo: MMA, ADMA y SDMA), con una mayor sensibilidad, especificidad y con un mayor rendimiento.
Antes de que la presente invención se describa con mayor detenimiento, se entiende que esta invención no está limitada a las realizaciones particulares descritas ya que las mismas, por supuesto, varían. También debe entenderse que la terminología utilizada aquí es solamente a efectos de describir realizaciones particulares y no pretende ser limitante, ya que el alcance de la presente invención será limitado sólo por las reivindicaciones adjuntas.
Los métodos de la invención pueden ser cualitativos o cuantitativos. Así pues, tal como se utiliza en este documento, el término "detección" se refiere tanto a las determinaciones cualitativas como cuantitativas, y por lo tanto, incluye "medir" y "determinar un nivel". Una "muestra" abarca una variedad de tipos de muestras obtenidas de un individuo y pueden ser utilizadas en un sentido diagnóstico o de control. La definición abarca sangre, muestras de derivados de sangre y otras muestras líquidas de origen biológico, muestras de tejidos, como una muestra de biopsia o cultivos de tejidos o células derivadas de ellos y la progenie de ellos. Eso también incluye muestras que han sido manipulados de cualquier forma después de su obtención, como por tratamiento con reactivos, solubilización, o enriquecimiento de determinados componentes. Abarca muestras clínicas y también células en cultivo, sobrenadantes de células, lisados de células,...
Reivindicaciones:
1. Método para la detección de uno o más analitos del grupo formado por arginina, su derivado monometilado monometilarginina (MMA), sus derivados demetilados dimetilarginina asimétrica (ADMA) y dimetilarginina simétrica (SDMA) en muestras biológicas que comprende los pasos de derivación y detección de analitos, estando caracterizado porque
- - los analitos son derivados en su función ácido carboxílico, preferentemente mediante esterificación de ácido, particularmente por medio de metanol, etanol y/o butanol, o por amidación, particularmente por medio de dietilamina;
- - los derivados obtenidos de analitos se detectan simultáneamente por detección espectroscópica de masas, preferentemente detección espectroscópica de masas tándem.
2. Método según la reivindicación 1, estando caracterizado porque la derivación se lleva a cabo en cualquier forma automatizada.
3. Método según cualquier reivindicación anterior, estando caracterizado porque la detección espectrométrica de masas se logra por un sistema MS cuadripolar simple, triple cuadropolar, trampa de iones, resonancia ión ciclotrón, de tiempo de vuelo, o cualquier otro sistema MS adecuado o combinación de los citados sistemas MS.
4. Método según cualquier reivindicación anterior, estando caracterizado porque se proporciona un paso de la separación, que preferentemente separa los analitos derivados de una matriz biológica, preferiblemente mediante el uso de HPLC o electroforesis capilar.
5. Método según cualquier reivindicación anterior, estando caracterizado porque se proporciona un paso de preparación de la muestra, preferentemente consistente en una precipitación de proteínas, particularmente una precipitación de disolvente, que se lleva a cabo preferentemente de forma automatizada.
6. Método según cualquier reivindicación anterior, estando caracterizado porque la detección comprende una técnica de ionización del grupo formado por ESi, APCI, MALDI.
7. Método según cualquier reivindicación anterior, estando caracterizado porque se proporciona una calibración haciendo uso de un estándar interno y/o estándar etiquetado y que se utiliza para calcular la relación de cualquier analito a cualquier otro analito, preferentemente la relación de ADMA respecto a SDMA, la relación de L-arginina respecto a ADMA, y relaciones recíprocas.
Patentes similares o relacionadas:
MATRICES DE PROTEÍNA DE DOMINIOS VARIABLES DE INMUNOGLOBULINA DE CADENA PESADA DE CAMELIDAE, del 18 de Noviembre de 2011, de BAC IP B.V: Una matriz de proteína que comprende una pluralidad de dominios variables de cadena pesada derivados de una inmunoglobulina que está naturalmente desprovista de cadenas […]
MÉTODO PARA LA PRODUCCIÓN EN MASA DE LECTINA MULTIMÉRICA DE UNIÓN A MANOSA, del 6 de Junio de 2011, de DOBEEL CO., LTD: Línea de células huésped CHO transfectadas con un vector de expresión pMSG-MBL ilustrado en un mapa plasmídico de la fig. 1 que contiene un polinucleótido codificante de la […]
 ESTRATEGIA AUTOMATIZADA DE IDENTIFICACION DEL PERFIL DE GLUCOSILACION, del 28 de Abril de 2010, de NATIONAL INSTITUTE FOR BIOPROCESSING RESEARCH AND TRAINING LIMITED: Un método in vitro para determinar uno o más marcadores de glucosilación de una enfermedad que comprende las etapas de:
- proporcionar una muestra […]
ESTRATEGIA AUTOMATIZADA DE IDENTIFICACION DEL PERFIL DE GLUCOSILACION, del 28 de Abril de 2010, de NATIONAL INSTITUTE FOR BIOPROCESSING RESEARCH AND TRAINING LIMITED: Un método in vitro para determinar uno o más marcadores de glucosilación de una enfermedad que comprende las etapas de:
- proporcionar una muestra […]
ENSAYO POR POLARIZACION DE FLUORESCENCIA, del 28 de Abril de 2010, de TRANSTECH PHARMA INC.: Un procedimiento para detectar moduladores del RAGE (receptor de productos finales avanzados de la glicosilación) que comprende: (a) proporcionar (i) un polipéptido RAGE […]
 UN METODO PARA DETECTAR COLONIAS CELULARES QUE EXPRESAN UNA VARIANTE SOLUBLE DE UNA PROTEINA OBJETIVO, del 29 de Diciembre de 2009, de NORDLUND, PAR
CORNVIK, TOBIAS: Un método de identificar una colonia celular que expresa una variante soluble de una proteína objetivo, método que comprende:
(a) someter dicha colonia celular a condiciones […]
UN METODO PARA DETECTAR COLONIAS CELULARES QUE EXPRESAN UNA VARIANTE SOLUBLE DE UNA PROTEINA OBJETIVO, del 29 de Diciembre de 2009, de NORDLUND, PAR
CORNVIK, TOBIAS: Un método de identificar una colonia celular que expresa una variante soluble de una proteína objetivo, método que comprende:
(a) someter dicha colonia celular a condiciones […]
METODO DE PRODUCCION DE PEPTIDOS ACILADOS, del 17 de Noviembre de 2009, de NOVO NORDISK A/S: Método para la producción de un péptido N-acilado, dicho método incluyendo las etapas: **(Ver fórmula)** a) reaccionar el péptido que tiene al menos un […]
PROCEDIMIENTO PARA CARACTERIZAR LA GLICOSILACION DE SIALOGLICOPROTEINAS MEDIANTE UN NUMERO DE ISOFORMAS I, del 10 de Noviembre de 2009, de HERMENTIN, PETER: Procedimiento para caracterizar la calidad de sialoglicoproteínas mediante un número de isoformas I, en el que a) la sialoglicoproteína se separa […]
PROCEDIMIENTO DE ENSAYO DE PROTEÍNA GLICOSILADA, del 27 de Julio de 2011, de Sekisui Medical Co., Ltd: Un procedimiento para reducir el efecto de un compuesto de fructosil-lisina en el ensayo de fructosil-péptido o fructosil-aminoácido, caracterizado porque comprende […]