MÉTODO DE PURIFICACIÓN DE FACTOR VII.
Un procedimiento para purificar el Factor VII recombinante (rFVII) o Factor VII recombinante activado (rFVIIa),
que comprende someter el rFVII o rFVIIa a cromatografía líquida sobre una columna de hidroxiapatita (HAP), en el que el rFVII o rFVIIa se eluye a partir de la columna de HAP usando un gradiente lineal o por etapas de tampón fosfato o desplazador no fosfato con una concentración de fosfato / desplazador en aumento, y en el que: el procedimiento además comprende una etapa de elución en la que el pH se aumenta por etapas según un valor de 1 - 3 subsiguiente a la elución en gradiente de concentración, o el gradiente de fosfato o desplazador se combina con un gradiente de pH con pH en aumento
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/DK2006/000024.
Solicitante: BAYER HEALTHCARE LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 800 DWIGHT WAY BERKELEY CA 94710 ESTADOS UNIDOS DE AMERICA.
Inventor/es: JENSEN,RIKKLE BOLDING, NYGAARD,FRANK BECH.
Fecha de Publicación: .
Fecha Solicitud PCT: 13 de Enero de 2006.
Fecha Concesión Europea: 4 de Agosto de 2010.
Clasificación PCT:
- C12N9/64 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › que provienen de tejido animal, p. ej. renina.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se dirige a un procedimiento para purificación de la proteína de Factor VII usando hidroxiapatita.
ANTECEDENTES DE LA INVENCIÓN
El factor VII (FVII), una proteína importante en la cascada de coagulación de la sangre, es una proteína del plasma dependiente de la vitamina K sintetizada en el hígado y secretada en la sangre en forma de una glucoproteína de una sola cadena con un peso molecular de 53 kDa. El zimógeno FVII se convierte en una forma activada (FVIIa) por escisión proteolítica en un solo sitio, R152–I153, dando como resultado dos cadenas unidas por un solo puente disulfuro. El FVIIa recombinante humano está disponible en el mercado de Novo Nordisk bajo la denominación NovoSeven® y se usa para el tratamiento de episodios de extracción, por ejemplo, en hemofilia o traumatismo. También se han reseñado variantes de FVII humano producidas de forma recombinante.
La purificación del Factor VII recombinante (rFVII) o Factor VII recombinante activado (rFVIIa) se lleva a cabo por lo general usando una combinación de intercambio de iones y cromatografía de inmunoafinidad basada en un reconocimiento dependiente de Ca2+ de la región Gla de FVII (residuos aminoácidos 1 a 45 de FVII humano). Aunque la etapa de purificación basada en cromatografía de inmunoafinidad es muy selectiva y proporciona alta pureza a la proteína FVII, existen desventajas en esta etapa. Por ejemplo, la lixiviación potencial del anticuerpo en el producto farmacéutico puede afectar la seguridad del fármaco final, y el coste de producir la matriz de inmunoafinidad del anticuerpo monoclonal (mAb) es considerable en comparación con matrices de purificación no basadas en anticuerpos, más convencionales.
Aunque el reemplazo de la etapa de inmunoafinidad por una técnica de purificación diferente sería ventajoso, esto precisaría la eliminación de contaminantes no relacionados con FVII así como la capacidad de separar cualquier isoforma no deseada de FVII que puede estar presente en los sobrenadantes del cultivo.
BREVE DESCRIPCIÓN DE LOS DIBUJOS
La figura 1 muestra un indicio UV de una muestra de FVII eluida a partir de una columna de hidroxiapatita de acuerdo con la invención, como se describe en el Ejemplo 1.
La figura 2 muestra un análisis SDS–PAGE de la muestra de la figura 1.
La figura 3 muestra un indicio UV de una muestra de FVII eluida a partir de una columna
de hidroxiapatita de acuerdo con la invención, como se describe en el Ejemplo 2.
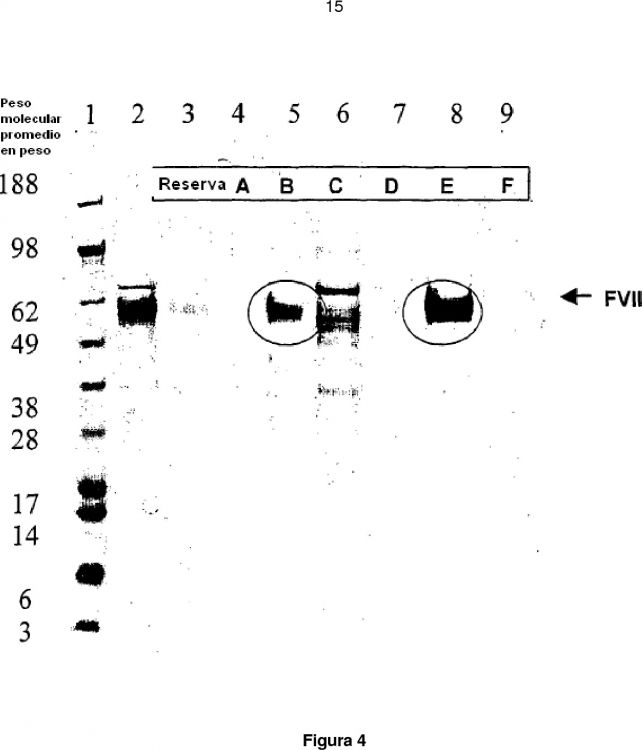
La figura 4 muestra un análisis SDS–PAGE de la muestra de la figura 3.
DESCRIPCIÓN DE LA INVENCIÓN
Los inventores han explorado las posibilidades de usar procedimientos no basados en anticuerpos para la purificación de la proteína FVII y la posible separación de isoformas de FVII capturadas a partir de los sobrenadantes del cultivo, y sorprendentemente se ha descubierto que se obtienen resultados excelentes usando hidroxiapatita. De este modo, la presente invención se refiere a un procedimiento adecuado para purificar rFVII o rFVIIa, que comprende someter el rFVII o rFVIIa a cromatografía líquida en una columna de hidroxiapatita (HAP), en la que el rFVII
o rFVIIa se eluye como se define en la reivindicación 1.
Definiciones
En la descripción y reivindicaciones dadas a continuación, se aplican las definiciones siguientes:
El término “FVII” o “polipéptido de FVII” se refiere a una molécula de FVII proporcionada en forma de una sola cadena.
El término “FVIIa” o “polipéptido de FVIIa” se refiere a una molécula de FVIIa proporcionada en su forma de doble cadena activada, en la que el enlace peptídico entre R152 y I153 de la forma de doble cadena se ha escindido.
Los términos “rFVII” o “rFVIIa” se refieren a moléculas de FVII y FVIIa producidas por medio de técnicas recombinantes, respectivamente. Éstas pueden tener la secuencia humana de tipo salvaje o pueden ser variantes de la secuencia humana.
Los términos “FVIIh” y FVIIha” se refieren a FVII y FVIIa humano de tipo salvaje, respectivamente.
A menos que se indique otra cosa o sea evidente a partir del contexto, se pretende que los términos “FVII”, “proteína FVII” y Factor VII”, como se usa en la presente memoria descriptiva, incluyan tanto las formas activadas como inactivadas de FVII, la secuencia recombinante de tipo salvaje de FVII humano así como variantes de los mismos.
Descripción detallada
Las proteínas FVII que se pueden purificar por medio del procedimiento de la invención incluyen cualquier proteína FVII o FVIIa, en particular FVII o FVIIa recombinante humano y variantes de las mismas. La secuencia de aminoácidos de FVII humano de tipo salvaje es bien conocida y se describe, por ejemplo, en el documento WO 01/58935. Las variantes de interés que se pueden purificar por medio del procedimiento de la invención incluyen, por ejemplo, las descritas en los documentos WO 01/58935, WO 03/093465, WO 2004/029091, WO 2004/111242, WO 99/20767, WO 00/66753, WO 88/10295, WO 92/15656, WO 02/29025, WO 01/70763, WO 01/83725, WO 02/02764, WO 02/22776, WO 02/38162, WO 02/077218, WO 03/027147, WO 03/037932, WO 2004/000366, WO 2004/029090, y WO 2004/108763.
Las variantes de FVII o FVIIa pueden incluir una o más sustituciones, inserciones o deleciones en comparación con FVII humano de tipo salvaje, por ejemplo dando como resultado un variante que difiere en 1 – 15 residuos aminoácidos de la secuencia de aminoácidos de FVII humano de tipo salvaje, típicamente en 1 – 10 o en 2 – 10 residuos aminoácidos, por ejemplo, en 1 – 8 o en 2 – 8 residuos aminoácidos, tal como en 3 – 7 o en 4
– 6 residuos aminoácidos de la secuencia de aminoácidos, en la que las diferencias en la secuencia de aminoácidos del tipo salvaje son típicamente sustituciones. Tales sustituciones se pueden llevar a cabo por ejemplo con el objetivo de introducir uno o más sitios de glucosilación in vivo o sitios de polietilenglicolización en la proteína y/o para mejorar o modificar de otra forma la actividad de coagulación de la proteína de tipo salvaje; tales variantes se describen en los documentos WO 01/58935, WO 03/093465, WO 2004/029091 y WO 2004/111242. Las variantes de FVII o FVIIa pueden tener de forma alternativa una actividad de coagulación reducida con el fin de funcionar como anti–coagulantes.
La proteína de FVII / FVIIa o variante de las mismas se puede producir por medio de cualquier organismo adecuado, por ejemplo en mamíferos, células de levaduras o bacterianas, aunque se prefieren las células eucarióticas, más preferiblemente las células mamíferas tales como células CHO, células HEK o células BHK.
La hidroxiapatita (HAP) es un material inorgánico poroso de cromatografía basado en fosfato cálcico que es útil para la purificación de proteínas, incluyendo enzimas y anticuerpos monoclonales, así como ácidos nucleicos. Como la HAP está constituida por fosfato cálcico, contiene tanto cargas positivas como negativas. La cromatografía líquida usando HAP se realiza típicamente dentro de un intervalo de pH de aproximadamente 5,5 a 9, por ejemplo aproximadamente 6 – 9.
La columna de HAP se puede equilibrar con un tampón de fuerza iónica baja, por ejemplo aproximadamente de 5 mM a 10 mM, siendo un tampón adecuado por ejemplo un tampón fosfato tal como fosfato sódico o de forma alternativa un tampón no fosfato tal como imidazol, TRIS, histidina, MES (ácido 2–(N–morfolino) etano sulfónico) o borato. El tampón puede incluir opcionalmente una sal tal como NaCl.
La propia columna puede tener cualquier tamaño y volumen adecuados, dependiendo por ejemplo de la cantidad de proteína y sobrenadante que se va a purificar. Las personas expertas en la técnica serán capaces de seleccionar fácilmente una columna adecuada basada en las necesidades de purificación reales.
Se ha descubierto que HAP es particularmente adecuada para la purificación de rFVII así como la separación de isoformas de FVII no deseadas. La proteína de FVII se une estrechamente a HAP a concentraciones bajas de tampón, por ejemplo una concentración de fosfato de aproximadamente 1 mM, tal como desde aproximadamente 5 mm, por ejemplo...
Reivindicaciones:
1. Un procedimiento para purificar el Factor VII recombinante (rFVII) o Factor VII recombinante activado (rFVIIa), que comprende someter el rFVII o rFVIIa a cromatografía líquida sobre una columna de hidroxiapatita (HAP), en el que el rFVII o rFVIIa se eluye a partir de la columna de HAP usando un gradiente lineal o por etapas de tampón fosfato o desplazador no fosfato con una concentración de fosfato / desplazador en aumento, y en el que:
el procedimiento además comprende una etapa de elución en la que el pH se aumenta por etapas según un valor de 1 – 3 subsiguiente a la elución en gradiente de concentración, o el gradiente de fosfato o desplazador se combina con un gradiente de pH con pH en aumento.
2. El procedimiento de la reivindicación 1, en el que el rFVII o rFVIIa es rFVII o rFVIIa humano.
3. El procedimiento de la reivindicación 1, en el que el rFVII o rFVIIa es una variante de rFVII o rFVIIa humano, en el que la variante tiene una secuencia de aminoácidos que difiere de la secuencia de FVII humano de tipo salvaje en 1 -15 residuos aminoácidos.
4. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que el rFVII o rFVIIa se aplica a la columna de HAP en un tampón fosfato que tiene un pH de 5,5 a 7,5.
5. El procedimiento de cualquiera de las reivindicaciones 1 – 3, en el que el rFVII o rFVIIa se aplica a la columna de HAP en un tampón no fosfato que tiene un pH de 5,5 a 9,0.
6. El procedimiento de cualquiera de las reivindicaciones 1 – 5, que comprende una etapa de elución final usando un pH en el intervalo de 5,5 – 7,5.
7. El procedimiento de la reivindicación 6, en el que la etapa de elución inicial se realiza con fosfato en una concentración de hasta aproximadamente 150 mM.
8. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la elución se realiza usando un tampón fosfato con un pH en el intervalo de 5,5 – 9,0.
9. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que el pH se aumenta de 6 – 7 a 8 – 9.
10. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que la elución se realiza usando un gradiente de tampón fosfato y un gradiente de pH.
11. El procedimiento de cualquiera de las reivindicaciones precedentes, en el que el pH se aumenta desde un pH inicial de 5,5 -7,0 hasta un pH final de 7,5 -9,0.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Formulaciones liofilizadas para antídoto del factor Xa, del 1 de Julio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una formulación acuosa, que comprende de 10 mM a 55 mM de arginina, de 1% a 3% de sacarosa (p/v), de 2% a 8% de manitol (p/v), y al menos 5 mg/ml de un polipéptido […]
Antídotos para inhibidores del factor Xa y procedimientos de uso de los mismos, del 24 de Junio de 2020, de PORTOLA PHARMACEUTICALS, INC.: Una composición farmacéutica que comprende un transportador y un polipéptido para uso en terapia donde el polipéptido comprende una secuencia de aminoácidos que tiene […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Proteínas prohemostáticas para el tratamiento del sangrado, del 3 de Junio de 2020, de ACADEMISCH ZIEKENHUIS LEIDEN: Una proteína recombinante que comprende un polipéptido del factor Xa de coagulación de mamífero, teniendo dicho polipéptido una alteración en la región de los […]
Ratones ADAM6, del 22 de Abril de 2020, de REGENERON PHARMACEUTICALS, INC.: Un ratón que ha experimentado reordenación de secuencia génica de inmunoglobulina de modo que exprese un linfocito B que comprende una secuencia de inmunoglobulina reordenada […]
Procedimiento de purificación de polipéptidos, del 22 de Abril de 2020, de CSL LIMITED: Procedimiento de purificación de un polipéptido de interés por cromatografía de intercambio catiónico en el que un compuesto químico se añade en una concentración de al menos […]
Proteínas de fusión recombinantes para la prevención o el tratamiento de adherencias en tejidos u órganos, del 8 de Abril de 2020, de Akesion GmbH: Proteína de fusión recombinante que incluye una enzima fibrinogenolítica con una secuencia de aminoácidos, que está unida en el extremo C y/o en el extremo […]