Mesilato de profármaco de Levodopa, sus composiciones y sus usos.
Mesilato de (2S)-2-amino-3-(3,4-dihidroxifenil)propanoato de (2R)-2-fenilcarboniloxipropilo
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/046273.
Solicitante: XENOPORT, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 3410 CENTRAL EXPRESSWAY SANTA CLARA, CA 95051 ESTADOS UNIDOS DE AMERICA.
Inventor/es: XIANG, JIA-NING, ZHOU,CINDY,X, DAI,XUEDONG, LI,JIANHUA, NGUYEN,MARK Q.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- A61K31/24 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 31/00 Preparaciones medicinales que contienen ingredientes orgánicos activos. › que tienen un grupo amino o nitro.
- C07C229/36 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07C COMPUESTOS ACICLICOS O CARBOCICLICOS (compuestos macromoleculares C08; producción de compuestos orgánicos por electrolisiso electroforesis C25B 3/00, C25B 7/00). › C07C 229/00 Compuestos que contienen grupos amino y carboxilo unidos a la misma estructura carbonada. › con al menos un grupo amino y un grupo carboxilo unidos al mismo átomo de carbono de la estructura carbonada.
- C07C309/04 C07C […] › C07C 309/00 Acidos sulfónicos; Sus halogenuros, ésteres o anhídridos. › que contienen un solo grupo sulfo.
PDF original: ES-2391575_T3.pdf
Fragmento de la descripción:
Mesilato de profármaco de Levodopa, sus composiciones y sus usos
En el presente documento se desvela una sal mesilato de un profármaco de levodopa y una forma cristalina de los mismos, y composiciones farmacéuticas que contienen los mismos, útiles para el tratamiento de enfermedades o trastornos tal como enfermedad de Parkinson.
La enfermedad de Parkinson es una enfermedad discapacitante, progresiva que afecta al 1 por 1.000 de la población y en general se produce en personas mayores de 50 años. Los pacientes con enfermedad de Parkinson tienen una deficiencia del neurotransmisor dopamina en el cerebro como resultado de la interrupción de la ruta nigroestriatal provocada por la degeneración de la sustancia negra. La levodopa (Ldopa o L-3, 4dihidroxifenilalanina) , un precursor inmediato de dopamina, es el fármaco más comúnmente prescrito para el tratamiento de esta enfermedad.
Después de la administración oral, la levodopa se absorbe rápidamente mediante un transportador de aminoácido presente en la parte superior del intestino delgado. Debido a la estrecha distribución de este sistema transportador, la ventana disponible para la absorción de levodopa está limitada y el grado de de absorción puede depender de la velocidad a la que el fármaco pasa a través del tracto gastrointestinal superior.
El metabolismo intestinal de levodopa es la principal fuente del primer paso de pérdida del fármaco. Aproximadamente 35% de una dosis administrada de levodopa alcanza la circulación sistémica como levodopa intacta después de la administración oral en los pacientes (Sasahara, J. Pharm. Sci 1990, 69, 261) . Una vez absorbida, levodopa se metaboliza rápidamente a dopamina por las enzimas descarboxilasa de aminoácidos Laromáticos (AADC) en los tejidos periféricos (por ejemplo, intestinos e hígado) . Por esta razón, levodopa normalmente se coadministra con un inhibidor de la enzima descarboxilasa tales como carbidopa o benserazida. Cuando se administra con carbidopa, la concentración en plasma de levodopa intacta se incrementa y de este modo llega a estar más disponible la levodopa para ser transportada al sistema nervioso central donde se convierte en dopamina. Carbidopa y benserazida no cruzan la barreta sangre - cerebro hasta un grado significativo por lo tanto no inhiben la conversión requerida de levodopa en dopamina en el cerebro.
Se ha propuesto el uso de profármacos de levodopa para mejorar la farmacocinética de levodopa. Muchos de estos profármacos son ésteres simples de levodopa (véanse las Patentes de Estados Unidos Números 5.017.607; 4.826.875; 4.873.263; 4.771.073; 4.663.349; 4.311.706; patente Japonesa Nº JP58024547; Juncos et al., Neurology 1987, 37, 1242; y Cooper et al., J. Pharm. Pharmacol. 1987, 39, 627 - 635) . Se ha descrito una formulación oral de éster metílico de levodopa (Levomet®, CHF 1301) (Chiesi Pharmaceuticals) . El éster etílico de levodopa (TV-1203) está bajo investigación clínica como una terapia potencial para la enfermedad de Parkinson cuando se coadministra con carbidopa (Patente de Estados Unidos Nº 5.607.969, que se incorpora en el presente documento por referencia en su totalidad) . También se ha descrito una formulación de celulosa de liberación sostenida de éster etílico de levodopa en una mezcla de hidroxipropilmetil celulosa, hidroxipropil celulosa, y un polímero de carboxivinilo (Patente de Estados Unidos Nº 5.840.756) . Sin embargo, la administración oral de esta formulación a adultos sanos tratados previamente con carbidopa producía una semivida terminal de levodopa en plasma de solamente 2 horas, comparable con la de Sinemet® CR.
Se ha descrito un éster pivaloílico de levodopa (NB-355) (Patente Europea nº 0 309 827) . Después de la administración oral de NB-355, no se observó un rápido incremento en la concentración en plasma o en la eliminación de levodopa y se prolongó la duración de levodopa circulante, aunque las concentraciones en plasma de levodopa eran bajas. El potencial para uso de profármacos de éster levodopa para potenciar la absorción rectal del fármaco también se ha descrito (Patentes de Estados Unidos números 4.663.349; 4.771.073; y 4.873.263) . De manera notable, la absorción de ésteres alquílicos de levodopa se ha mostrado que es mayor después de la absorción rectal que sigue a la dosificación oral (Fix, et al., Pharm. Res. 1989, 6, 501 - 5; y Fix, et al., Pharm. Res. 1990, 4, 384 - 7) . Este efecto se atribuye a la abundancia disminuida de esterasas en el intestino grueso con relación al intestino delgado. Por lo tanto, la administración selectiva de un profármaco de levodopa al intestino grueso en una formulación de liberación sostenida se podría esperar que proporcionara una mayor biodisponibilidad oral y una exposición sistémica prolongada al fármaco.
Se ha descrito una serie de éster de ácido glicólico que contiene profármacos de levodopa (Wermuth, Patente de Estados Unidos Nº 4.134.991) . También se han descrito los conjugados de lípidos de levodopa que facilitan la entrada de levodopa en las células y tejidos (Yatvin, Patente de Estados Unidos Nº 5.827.819) .
De este modo, el desarrollo de profármacos de levodopa que se pueden absorber de manera eficaz a través del tracto gastrointestinal, incluyendo el colon, y reducen el metabolismo de primer paso de levodopa es altamente deseable.
El tracto gastrointestinal humano incluye el intestino delgado y el intestino grueso. El intestino delgado humano es un tubo con repliegues de aproximadamente veinte pies (6, 091 m) de longitud entre el estómago y el intestino grueso. El intestino delgado se subdivide en duodeno, el yeyuno, y el íleo. El intestino grueso es de aproximadamente 5 pies (1, 52 m) de longitud y va desde el íleo al ano, El intestino grueso se divide en el intestino ciego, colon, y el recto. El colon se divide en cuatro partes que incluyen el flexo ascendente, transversal, descendente, y sigmoidea. En general, un compuesto ingerido por vía oral reside aproximadamente 1 a 6 horas en el estómago, aproximadamente 2 a 7 horas en el intestino delgado, y aproximadamente 8 a 18 horas en el colon. De este modo, el mayor tiempo para la liberación sostenida de un compuesto se produce cuando el compuesto pasa a través del colon.
Se sabe que ciertas proteínas transportadoras activas se expresan a lo largo del tracto gastrointestinal. Un transportador activo se refiere a una proteína unida a membranas que reconoce un sustrato y afecta a la entrada del sustrato o la salida de una célula por transporte mediado por vehículo o transporte mediado por receptor. El transporte activo incluye el movimiento de moléculas a través de las membranas celulares que directa o indirectamente depende de un procedimiento mediado por energía, tal como por ejemplo mediante un procedimiento dirigido por hidrólisis de ATP, o mediante un gradiente de iones, que se produce mediante la difusión facilitada mediada por interacción con proteínas transportadoras específicas mediante un canal de soluto modulado. Los ejemplos de transportadores mediados por soluto incluyen transportadores de cationes orgánicos tales como OCTN1 y OCTN2, que se expresan en las células epiteliales que revisten el colon humano así como en el intestino delgado.
Más recientemente, se han descrito profármacos de levodopa diseñados para ser absorbidos en los intestinos tanto delgado como grueso en Xiang et al., Publicaciones de Solicitud de Estados Unidos Números 2005/0282891 y 2006/0020028, cada una de las cuales se incorpora en el presente documento por referencia en su totalidad. Estos profármacos de levodopa pueden lograr una biodisponibilidad oral de levodopa que es al menos dos veces mayor que la biodisponibilidad oral de levodopa cuando se administra por vía oral en base a un equivalente molar. Más específicamente, Xiang et al., Publicación de Solicitud de Estados Unidos No. 2005/0282891 desvela el compuesto clorhidrato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo en una forma amoría o cristalina (véase el Ejemplo 8 de Xiang et al.) . Los profármacos descritos por Xiang et al. se pueden incorporar de manera eficaz en formulaciones de liberación sostenida incluyendo dispositivos de administración osmótica para proporcionar exposición sistémica sostenida a levodopa tras la administración oral a un paciente.
En general, se prefieren formas cristalinas de fármacos sobre las formas amorías de los fármacos, en parte, debido a su superior estabilidad. Por ejemplo, en muchas situaciones, un fármaco amorfo se convierte en una... [Seguir leyendo]
Reivindicaciones:
1. Mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo.
2. Mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo cristalino.
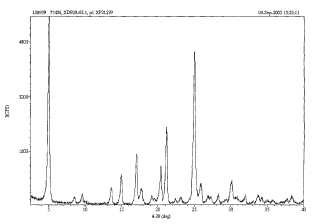
3. El compuesto de la reivindicación 2, que tiene máximos característicos (°28 ) a 5, 0 ± 0, 2°, 8, 5 ± 0, 2°, 13, 6 ± 0, 2°, 15, 0 ± 0, 2°, 17, 0 ± 0, 2°, 17, 7 ± 0, 2°, 20, 4 ± 0, 2°, 21, 1 ± 0, 2°, 25, 0 ± 0, 2°, 25, 8 ± 0, 2°, 28, 2 ± 0, 2°, 30, 1 ± 0, 2°, y 37, 6 ± 0, 2° en un patrón de difracción de rayos X en polvo medidos usando radiación de Cu Ka .
4. El compuesto de la reivindicación 2, en el que el compuesto se caracteriza por un termograma de calorimetría de barrido diferencial que tiene un máximo endotérmico a aproximadamente 164, 5 ± 2, 5 °C.
5. El compuesto de la reivindicación 2, que tiene máximos de difracción característicos (°28 ) a 4, 7 ± 0, 2°, 5, 0 ± 0, 2°, 8, 5 ± 0, 2°, 9, 6 ± 0, 2°, 13, 6 ± 0, 2°, 15, 0 ± 0, 2°, 17, 0 ± 0, 2°, 17, 4 ± 0, 2°, 17, 7 ± 0, 2°, 19, 1 ± 0, 2°, 19, 5 ± 0, 2°, 20, 0 ± 0, 2°, 20, 4 ± 0, 2°, 21, 1 ± 0, 2°, 22, 3 ± 0, 2°, 22, 9 ± 0, 2°, 23, 1 ± 0, 2°, 23, 3 ± 0, 2°, 24, 3 ± 0, 2°, 25, 0 ± 0, 2°, 25, 3 ± 0, 2°, 25, 7 ± 0, 2°, 25, 8 ± 0, 2°, 26, 9 ± 0, 2°, 27, 3 ± 0, 2°, 28, 2 ± 0, 2°, 30, 1 ± 0, 2°, 30, 5 ± 0, 2°, 32, 0 ± 0, 2°, 33, 8 ± 0, 2°, 34, 3 ± 0, 2°, 37, 6 ± 0, 2°, y 38, 4 ± 0, 2° en un patrón de difracción de rayos X en polvo medidos usando radiación de Cu Ka.
6. El compuesto de la reivindicación 2, en el que el compuesto se caracteriza por un termograma de calorimetría de barrido diferencial que tiene un máximo endotérmico a 165, 8 ± 1, 1 °C a una velocidad de barrido de 10 °C/min o 15 °C/min.
7. El compuesto de la reivindicación 2, en el que el compuesto muestra un punto de fusión de 157 °C a 162 °C.
8. El compuesto de la reivindicación 2, en el que el compuesto muestra un punto de fusión de aproximadamente 160, 5 °C a 161, 3 °C.
9. Un procedimiento de preparación de mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo que comprende:
proporcionar una solución de (2S) -2- (terc-butoxicarbonil) amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo en un disolvente;
añadir un ácido para convertir el (2R) -2-fenilcarboniloxipropilo (2S) -2- (terc-butoxicarbonil) amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo a la sal de ácido de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo;
añadir ácido metanosulfónico para convertir la sal de ácido de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipxopilo en mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo; y
aislar el mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo del disolvente.
10. El procedimiento de la reivindicación 9, en el que el disolvente se selecciona entre diclorometano y dioxano.
11. Un procedimiento de preparación de mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo que comprende:
proporcionar una solución de (2S) -2- (terc-butoxicarbonil) amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo en un disolvente;
añadir ácido metanosulfónico para convertir el (2S) -2- (terc-butoxicarbonil) amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo en mesilato de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo; y
aislar el mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo del disolvente.
12. El procedimiento de la reivindicación 11, en el que el disolvente se selecciona entre diclorometano, acetato de etilo, metil terc-butil éter, y dioxano.
13. Un procedimiento de preparación de mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo cristalino que comprende:
proporcionar una solución de mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo en un disolvente, en el que la solubilidad de mesilato de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo en el disolvente depende de la temperatura;
cambiar la temperatura de la solución para reducir la solubilidad de mesilato de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo en el disolvente; y
aislar mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo cristalino del disolvente.
14. El procedimiento de la reivindicación 13, en el que el disolvente se selecciona entre acetonitrilo, metanol, etanol, isopropanol, metil terc-butil éter, dioxano, acetona, acetato de etilo, formiato de etilo, hexano, diclorometano, y mezclas de cualquiera de los anteriores.
15. Un procedimiento de preparación de mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo cristalino que comprende:
proporcionar una solución de (2S) -2- (terc-butoxicarbonil) amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo en un primer disolvente;
desproteger el grupo terc-butoxicarbonilo con un ácido para proporcionar la sal de ácido de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo;
retirar el primer disolvente y añadir agua a la sal de ácido de (2S) -2-amino-3- (3, 4-dihidroxifenilpropanoato de (2R) -2fenilcarboniloxipropilo;
neutralizar la sal de ácido de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo con una base para proporcionar (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo ;
extraer el (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo con un segundo disolvente;
añadir ácido metanosulfónico al (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo extraído para convertir el (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo en mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo cristalino; y
aislar el mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo cristalino en el segundo disolvente.
16. El procedimiento de la reivindicación 15, en el que el primer disolvente se selecciona entre diclorometano y dioxano.
17. El procedimiento de la reivindicación 15, en el que el segundo disolvente se selecciona entre diclorometano, acetato de etilo, y una mezcla de acetato de etilo e isopropanol.
18. El procedimiento de la reivindicación 15, en el que la temperatura de la solución en cada etapa es aproximadamente 25 °C.
19. El procedimiento de la reivindicación 15, en el que la desprotección comprende añadir un ácido seleccionado entre ácido clorhídrico, ácido trifluoroacético, y ácido metanosulfónico a la solución.
20. El procedimiento de la reivindicación 15, en el que la neutralización comprende añadir una base seleccionada entre NaHCO3 y KHCO3 a la solución.
21. Una composición farmacéutica que comprende un vehículo farmacéuticamente aceptable y una cantidad terapéuticamente eficaz del compuesto una cualquiera de las reivindicaciones 1 a 8.
22. La composición farmacéutica de la reivindicación 21, y al menos otro diastereómero de mesilato de 2fenilcarboniloxipropil-2-amino-3- (3, 4-dihidroxifenil) propanoato , en la que la pureza diastereomérica de mesilato de (2S) -2-amino-3- (3, 4- dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo es al menos aproximadamente 90%.
23. La composición farmacéutica de la reivindicación 21, que comprende además un inhibidor de la descarboxilasa de aminoácidos L-aromáticos.
24. La composición farmacéutica de la reivindicación 21, que comprende además un inhibidor de la catecol-O- metiltransferasa.
25. La composición farmacéutica de la reivindicación 21, formulada para la administración de liberación sostenida oral.
26. La composición farmacéutica de la reivindicación 21, que comprende mesilato de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo y al menos otro diastereómero de mesilato de 2fenilcarboniloxipropil-2-amino-3- (3, 4-dihidroxifenil) propanoato , en la que la pureza diastereomérica de mesilato de (2S) -2-amino-3- (3, 4- dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo es al menos 95%.
27. La composición farmacéutica de la reivindicación 21, que comprende mesilato de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo y al menos otro diastereómero de mesilato de 2fenilcarboniloxipropil-2-amino- 3- (3, 4-dihidroxifenil) propanoato, en la que la pureza diastereomérica de mesilato de (2S) -2-amino-3- (3, 4- dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo es al menos 99%.
28. La composición farmacéutica de la reivindicación 21, que comprende un inhibidor de la descarboxilasa de aminoácidos L-aromáticos y un inhibidor de la catecol-O-metiltransferasa.
29. Un medicamento que comprende el compuesto de una cualquiera de las reivindicaciones 1 - 8 para su uso en el tratamiento de la enfermedad de Parkinson en un paciente.
30. Un medicamento que comprende el compuesto de una cualquiera de las reivindicaciones 1 - 8 para su uso en el tratamienrto de una enfermedad seleccionada entre esquizofrenia, trastornos de alteración cognitiva, síndrome de la pierna inquieta, trastornos de movimiento de miembro periódico, discinesia tardía, enfermedad de Huntington, hipertensión, y somnolencia excesiva durante el día en un paciente.
31. El medicamento de acuerdo con la reivindicación 29 o la reivindicación 30, en el que el medicamento se formula para administración de liberación sostenida oral.
32. El medicamento de acuerdo con la reivindicación 29 o la reivindicación 30, en el que el medicamento comprende al menos otro diastereómero de mesilato de 2-fenilcarboniloxipropil-2-amino-3- (3, 4-dihidroxifenil) propanoato, en el que la pureza diastereomérica del mesilato de (2S) -2-amino-3- (3, 4-dihidroxifenil) propanoato de (2R) -2fenilcarboniloxipropilo es al menos aproximadamente 90%.
33. El medicamento de acuerdo con la reivindicación 29 o la reivindicación 30, en el que el medicamento comprende un inhibidor de la descarboxilasa de aminoácidos L-aromáticos.
34. El medicamento de acuerdo con la reivindicación 29 o la reivindicación 30, en el que el medicamento comprende un inhibidor de la catecol-O-metiltransferasa.
35. El medicamento de acuerdo con la reivindicación 29 o la reivindicación 30, en el que el medicamento comprende un inhibidor de la descarboxilasa de aminoácidos L-aromáticos y un inhibidor de la catecol-O-metiltransferasa.
36. El medicamento de acuerdo con la reivindicación 29 o la reivindicación 30, en el que el medicamento comprende a vehículo farmacéuticamente aceptable y a cantidad terapéuticamente eficaz del mesilato de (2S) -2-amino-3- (3, 4dihidroxifenil) propanoato de (2R) -2-fenilcarboniloxipropilo.
Patentes similares o relacionadas:
Formulación parenteral de esmolol, del 15 de Abril de 2020, de AOP ORPHAN PHARMACEUTICALS AG: Formulación parenteral de clorhidrato de esmolol para su uso en el tratamiento de un paciente que padece taquicardia que comprende un polvo liofilizado que consiste en clorhidrato […]
Lípidos oxidados y sus métodos de uso, del 15 de Enero de 2020, de VASCULAR BIOGENICS LTD: Un compuesto que tiene una estructura según la Fórmula 1, **(Ver fórmula)** o un estereoisómero, una mezcla estereoisomérica o su sal, en el que el término sal incluye […]
Métodos para tratar neutropenia, del 11 de Septiembre de 2019, de Enzychem Lifesciences Corporation: Una composición para su uso en el tratamiento de neutropenia, que comprende una cantidad eficaz de un compuesto de Fórmula 1:**Fórmula** en la que R1 y R2 son independientemente […]
5-ALA para la detección de tumores cerebrales, del 8 de Mayo de 2019, de Pioma Inc: Método in vitro para detectar un tumor cerebral de grado III o grado IV de la OMS, en el que el método comprende detectar el nivel de conversión de 5-ALA […]
Uso de moléculas orgánicas de nitrooxi en pienso para reducir la emisión de metano en rumiantes, del 5 de Abril de 2019, de DSM IP ASSETS B.V.: Uso de al menos una molécula orgánica sustituida en cualquier posición con al menos un grupo nitrooxi, o una sal de esta como se define mediante la fórmula (I),**Fórmula** […]
Compuestos para uso en el tratamiento de enfermedades mediadas por acuaporina, del 12 de Febrero de 2019, de Aeromics, Inc: Un compuesto de fórmula 1a**Fórmula** en donde: R1, R2, R3 , R4 y R5 se seleccionan de H, halo, alquilo C1-4 halogenado y ciano; y R6 se selecciona […]
Complejo de platino (IV) con eficacia antitumoral aumentada, del 3 de Diciembre de 2018, de VUAB PHARMA A. S: Un complejo de platino (IV) con configuración "cis-trans-cis" de los ligandos de la fórmula (III): **Fórmula**
Compuesto del éster de ácido guanidinobenzoico, del 1 de Octubre de 2018, de TAKEDA PHARMACEUTICAL COMPANY LIMITED: Un compuesto de fórmula (I) o una sal del mismo:**Fórmula** en el que L1 es un enlace o-alquileno inferior-, L2 es alquileno inferior que […]