MEMBRANA DE SEPARACION DE PLASMA.
Proceso para la fabricación de una membrana asimétrica de fibra hueca,
que comprende las etapas de
extruir una solución polimérica a través de la rendija anular exterior de una tobera de hilatura de fibras huecas, extruyendo simultáneamente un fluido central a través del agujero interior de la tobera de hilatura de fibras huecas, en un baño de precipitación, con lo cual
la solución polimérica contiene entre un 10 y un 26% en peso de polisulfona (PSU), polietersulfona (PES) o poliariletersulfona (PAES), entre un 8 y un 15% en peso de polivinilpirrolidona (PVP) y entre un 60 y un 80% en peso de N-alquil-2-pirrolidona (NAP),
el fluido central contiene entre un 60 y un 70% en peso de N-alquil-2-pirrolidona (NAP) y entre un 30 y un 40% en peso de agua, y
el baño de precipitación contiene entre un 70 y un 82% en peso de N-alquil-2-pirrolidona (NAP) y entre un 18 y un 30% en peso de agua
Tipo: Patente Europea. Resumen de patente/invención. Número de Solicitud: E06116781.
Solicitante: GAMBRO LUNDIA AB.
Nacionalidad solicitante: Suecia.
Dirección: BOX 10101,220 10 LUND.
Inventor/es: KRAUSE, BERND, GOHL,HERMANN, HORNUNG,MARKUS.
Fecha de Publicación: .
Fecha Solicitud PCT: 7 de Julio de 2006.
Fecha Concesión Europea: 17 de Marzo de 2010.
Clasificación Internacional de Patentes:
- B01D69/02 TECNICAS INDUSTRIALES DIVERSAS; TRANSPORTES. › B01 PROCEDIMIENTOS O APARATOS FISICOS O QUIMICOS EN GENERAL. › B01D SEPARACION (separación de sólidos por vía húmeda B03B, B03D, mesas o cribas neumáticas B03B, por vía seca B07; separación magnética o electrostática de materiales sólidos a partir de materiales sólidos o de fluidos, separación mediante campos eléctricos de alta tensión B03C; aparatos centrifugadores B04B; aparato de vórtice B04C; prensas en sí para exprimir los líquidos de las sustancias que los contienen B30B 9/02). › B01D 69/00 Membranas semipermeables destinadas a los procedimientos o a los aparatos de separación, caracterizadas por su forma, por su estructura o por sus propiedades; Procedimientos especialmente adaptados para su fabricación. › caracterizadas por sus propiedades.
- B01D69/08 B01D 69/00 […] › Membranas con fibras huecas (fabricación de fibras huecas D01D 5/24, D01F 1/08).
- B01D71/68 B01D […] › B01D 71/00 Membranas semipermeables destinadas a los procedimientos o a los aparatos de separación, caracterizadas por sus materiales; Procedimientos especialmente adaptados para su fabricación. › Polisulfonas; Polietersulfonas.
Clasificación PCT:
- B01D67/00 B01D […] › Procedimientos especialmente adaptados para la fabricación de membranas semipermeables destinadas a los procedimientos o a los aparatos de separación.
- B01D69/02 B01D 69/00 […] › caracterizadas por sus propiedades.
- B01D69/08 B01D 69/00 […] › Membranas con fibras huecas (fabricación de fibras huecas D01D 5/24, D01F 1/08).
- B01D71/68 B01D 71/00 […] › Polisulfonas; Polietersulfonas.
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
Fragmento de la descripción:
Membrana de separación de plasma.
Antecedentes de la invención
La presente invención se refiere a un proceso para la fabricación de una membrana asimétrica de fibra hueca, que, entre otras aplicaciones, resulta particularmente adecuada para la separación de plasma, aunque también se puede usar de forma ventajosa en ciertas aplicaciones técnicas. Además, esta invención se refiere a aquellas membranas que se pueden producir mediante el proceso de la invención, y al uso de dichas membranas para aplicaciones de separación de plasma, filtración de plasma, microfiltración, terapia con plasma o filtración celular.
La separación de plasma o aféresis es una tecnología médica en la que la sangre de un donante o paciente se separa en el plasma, es decir, el componente de la sangre exento de células, y las células sanguíneas. La separación del plasma se puede efectuar por varias razones.
En la plasmaféresis terapéutica, el plasma separado de la sangre de un paciente se descarta y es sustituido por una solución sustitutoria o por plasma de un donante, y se reinfunde en el paciente. Este planteamiento resulta útil en el tratamiento de varias enfermedades y trastornos. Por ejemplo, en enfermedades inmunológicas la plasmaféresis es útil para intercambiar anticuerpos, antígenos, complejos inmunes o globulinas inmunes. En enfermedades no inmunológicas, la plasmaféresis permite la eliminación de metabolitos, productos de degradación, así como toxinas endógenas y exógenas.
En una variante de la plasmaféresis terapéutica, el fraccionamiento plasmático, el plasma separado de la sangre de un paciente se somete a una segunda fase de separación adicional en fracciones plasmáticas de alto peso molecular y bajo peso molecular. La fracción de alto peso molecular se descarta, y la fracción de bajo peso molecular del plasma y los componentes celulares de la sangre se reinfunden en el paciente.
En una aplicación, denominada donación de plasma, el plasma sanguíneo separado proveniente de donantes sanos se usa para un intercambio de plasma terapéutico, o para el aislamiento de componentes plasmáticos con fines farmacéuticos.
La separación de la sangre total en plasma y componentes celulares se puede lograr o bien por centrifugación o bien haciendo pasar la sangre a través de una membrana de separación de plasma. Durante el desarrollo de la plasmaféresis, en primer lugar se han usado centrífugas discontinuas, que a continuación, en el comienzo de los años 70, se han sustituido por sistemas de centrifugación continuos. Las técnicas de centrifugación tienen la ventaja de ser rápidas y rentables, aunque con frecuencia tienen el inconveniente de dejar impurezas de células o residuos celulares en el plasma separado. A finales de los años 70, se introdujeron los primeros sistemas de membrana para que la plasmaféresis superara las desventajas de los sistemas de centrifugación.
Aunque están relacionados con ellas, los requisitos de las membranas de separación de plasma están bastante diferenciados con respecto a los requisitos de las membranas de diálisis. La separación de plasma usa el efecto de la separación por filtración, mientras que la diálisis usa en cambio la osmosis y la difusión.
Algunos de los criterios esenciales de diseño de una membrana de separación de plasma son la velocidad de cizalladura en la pared, la caída de la presión transmembrana y la velocidad de filtración del plasma.
La velocidad de cizalladura en la pared en un sistema de membrana de fibra hueca se calcula mediante la siguiente ecuación:
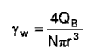
en la que N es el número de fibras huecas, que presentan el radio interno r, en las que se distribuye el flujo sanguíneo QB. Mediante la disminución de la porción de plasma, el flujo sanguíneo cambia a lo largo de la fibra hueca. En el cálculo de la velocidad de cizalladura en la pared se debe considerar este hecho.
La presión transmembrana (TMP) es otro parámetro importante, que se define como la diferencia de presión entre los dos lados de la membrana. La presión transmembrana es la fuerza impulsora para la separación en la membrana. En general, un aumento de la presión transmembrana hace que aumente el flujo a través de la membrana. La excepción a esta generalización se produce si en la superficie de la membrana hay presente una torta de filtración compresible. La presión transmembrana se calcula mediante la siguiente ecuación:
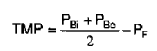
en la que PBi es la presión en la entrada de sangre, PBo es la presión en la salida de sangre, y PF es la presión en el lado del filtrado de la membrana (lado del plasma).
El coeficiente de cribado determinado cuánta cantidad de un compuesto será eliminada mediante un proceso de filtración. El coeficiente de cribado se define como la relación de la concentración de un compuesto en el filtrado con respecto a la concentración de este compuesto en la sangre. Un coeficiente de cribado de "0" significa que el compuesto no puede pasar por la membrana. Un coeficiente de cribado de "1" significa que el 100% del compuesto puede pasar por la membrana. Para el diseño de membranas de separación de plasma, se desea que el espectro completo de proteínas plasmáticas pueda pasar por la membrana de filtración mientras que los componentes celulares deben quedar completamente retenidos.
El documento DE 10 2004 008 220 da a conocer membranas semipermeables hidrófilas de fibra hueca para el tratamiento de la sangre, presentando las membranas una estructura asimétrica y produciéndose mediante hilatura de una solución polimérica a través de una tobera de hilatura hacia un baño de precipitación de agua y con el uso de un fluido central que contiene, en aquellos ejemplos pertenecientes a la invención de este documento, un polielectrolito además de NAP y agua. La membrana hueca resultante presentará un coeficiente de cribado muy bajo para la albúmina, no mayor que 0,005, y un coeficiente de cribado para el citocromo C de por lo menos 0,8.
Los requisitos de una membrana de separación de plasma para la plasmaféresis se pueden resumir mediante las siguientes características:
Breve descripción de los dibujos
Fig. 1: Micrografías Electrónicas de Barrido (SEM) que muestran la morfología de la membrana de separación de plasma del Ejemplo 7
Fig. 2: Micrografía electrónica de barrido de la sección transversal de la pared de la membrana de fibra hueca del Ejemplo 1 [Aumento 1.490; la barra blanca indica 20 µm] y la superficie interior (contacto con sangre) [Aumento 5.000; la barra blanca indica 7 µm]
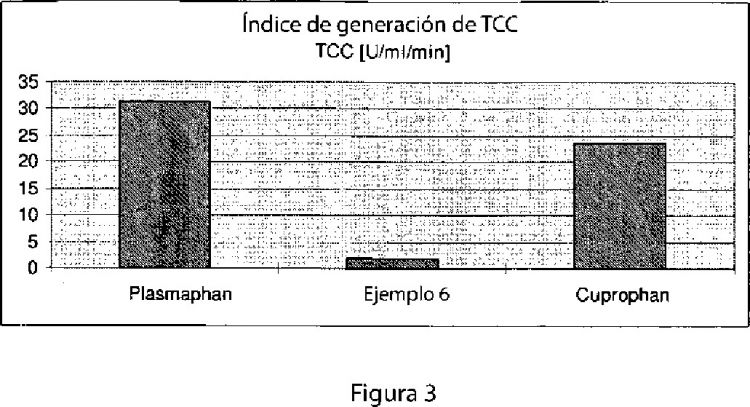
Fig. 3: Índice de generación de TCC para la membrana de Plasmaphan® y Cuprophan® (Membrana, Alemania) y la membrana producida en el Ejemplo 6. El TCC se mide en el plasma filtrado a través de la estructura porosa (o el pool para el Cuprophan) y presenta una buena correlación con un nivel de TCC aumentado en el pool. El experimento simula una terapia con plasma...
Reivindicaciones:
1. Proceso para la fabricación de una membrana asimétrica de fibra hueca, que comprende las etapas de
2. Proceso de cualquiera de las reivindicaciones anteriores, en el que la solución polimérica contiene entre un 15 y un 21% en peso de polisulfona (PSU), polietersulfona (PES) o poliariletersulfona (PAES), entre un 10 y un 12,5% en peso de polivinilpirrolidona (PVP) y entre un 66 y un 76% en peso de N-alquil-2-pirrolidona (NAP), preferentemente entre un 17 y un 19% en peso de polisulfona (PSU), polietersulfona (PES) o poliariletersulfona (PAES), entre un 10,75 y un 11,75% en peso de polivinilpirrolidona (PVP) y entre un 69 y un 72,5% en peso de N-alquil-2-pirrolidona (NAP).
3. Proceso de cualquiera de las reivindicaciones anteriores, en el que el fluido central contiene entre un 61 y un 67% en peso de N-alquil-2-pirrolidona (NAP) y entre un 33 y un 39% en peso de agua, preferentemente entre un 63 y un 65% en peso de N-alquil-2-pirrolidona (NAP) y entre un 35 y un 37% en peso de agua.
4. Proceso de cualquiera de las reivindicaciones anteriores, en el que el baño de precipitación contiene entre un 73 y un 79% en peso de N-alquil-2-pirrolidona (NAP) y entre un 21 y un 27% en peso de agua, preferentemente entre un 75 y un 77% en peso de N-alquil-2-pirrolidona (NAP) y entre un 23 y un 25% en peso de agua.
5. Proceso de cualquiera de las reivindicaciones anteriores, en el que la N-alquil-2-pirrolidona (NAP) en la solución polimérica, en el fluido central y en el baño de precipitación, si está presente, es la misma o diferente, de la forma más preferente es la misma, y se selecciona del grupo consistente en N-metil-2-pirrolidona (NMP), N-etil-2-pirrolidona (NEP), N-octil-2-pirrolidona (NOP) o mezclas de los mismas.
6. Proceso de cualquiera de las reivindicaciones anteriores, en el que la N-alquil-2-pirrolidona (NAP) en la solución polimérica, en el fluido central y en el baño de precipitación, si está presente, es la misma y es N-metil-2-pirrolidona (NMP).
7. Proceso de cualquiera de las reivindicaciones anteriores, en el que la polivinilpirrolidona (PVP) en la solución polimérica consiste en una mezcla de por lo menos dos homopolímeros de polivinilpirrolidona con lo cual uno de los homopolímeros de polivinilpirrolidona (=PVP de bajo peso molecular) tiene un peso molecular relativo medio de aproximadamente entre 10.000 g/mol y 100.000 g/mol, de forma preferente aproximadamente entre 30.000 g/mol y 60.000 g/mol, y otro de los homopolímeros de polivinilpirrolidona (=PVP de alto peso molecular) tiene un peso molecular relativo medio de aproximadamente entre 500.000 g/mol y 2.000.000 g/mol, de forma preferente aproximadamente entre 800.000 g/mol y 2.000.000 g/mol.
8. Proceso de la reivindicación 7, en el que, en la solución polimérica, basándose en el peso total de la solución polimérica, la PVP de bajo peso molecular está presente en una cantidad de entre un 5,7 y un 11,7% en peso y la PVP de alto peso molecular está presente en una cantidad de entre un 2,3 y un 4,3% en peso, preferentemente la PVP de bajo peso molecular está presente en una cantidad de entre un 7,1 y un 8,9% en peso y la PVP de alto peso molecular está presente en una cantidad de entre un 2,9 y un 3,6% en peso, de la forma más preferente la PVP de bajo peso molecular está presente en una cantidad de aproximadamente el 3,25% en peso y la PVP de alto peso molecular está presente en una cantidad de aproximadamente el 8,0% en peso.
9. Proceso de cualquiera de las reivindicaciones anteriores, en el que el baño de precipitación tiene una temperatura en el intervalo de entre 10 y 60ºC, preferentemente entre 20 y 50ºC, más preferentemente entre 30 y 40ºC.
10. Proceso de cualquiera de las reivindicaciones anteriores, en el que la tobera de hilatura (hilera) de fibras huecas se mantiene a una temperatura en el intervalo de entre 40 y 75ºC, preferentemente entre 45 y 70ºC, más preferentemente entre 50 y 65ºC, de la forma más preferente a aproximadamente 50ºC.
11. Proceso de cualquiera de las reivindicaciones anteriores, en el que la distancia entre la salida de descarga de la tobera de hilatura (hilera) de fibras huecas con respecto a la superficie del baño de precipitación está en el intervalo de entre 0,5 y 10 cm, preferentemente entre 1 y 8 cm, más preferentemente entre 2 y 5 cm.
12. Proceso de cualquiera de las reivindicaciones anteriores, en el que la velocidad de hilatura de la membrana de fibra hueca está en el intervalo de entre 1 y 20 m/min, preferentemente entre 3 y 15 m/min, más preferentemente entre 5 y 10 m/min.
13. Proceso de cualquiera de las reivindicaciones anteriores, en el que la solución polimérica tiene una viscosidad, medida a temperatura ambiente, de entre 30.000 y 100.000 mPa x s (Centipoise).
14. Membrana de fibra hueca obtenible mediante el proceso de cualquiera de las reivindicaciones 1 a 13.
15. Membrana de fibra hueca de la reivindicación 14, caracterizada por un coeficiente de cribado de proteína plasmática total de > 0,90, preferentemente > 0,95.
16. Membrana de fibra hueca de cualquiera de las reivindicaciones 14 y 15, caracterizada por un diámetro interior en el intervalo de entre 100 y 500 µm, preferentemente entre 150 y 450 µm, más preferentemente entre 200 y 400 µm.
17. Membrana de fibra hueca de cualquiera de las reivindicaciones 14 a 16, caracterizada por un espesor de la pared en el intervalo de entre 20 y 150 µm, preferentemente entre 30 y 125 µm, más preferentemente entre 40 y 100 µm.
18. Membrana de fibra hueca de cualquiera de las reivindicaciones 14 a 17, caracterizada por un diámetro medio de los poros de la capa de separación selectiva en la membrana, en el intervalo de entre 0,1 y 1 µm, preferentemente entre 0,1 y 0,7 µm, más preferentemente entre 0,1 y 0,4 µm.
19. Membrana de fibra hueca de cualquiera de las reivindicaciones 14 a 18, caracterizada por una distribución del tamaño de los poros en la que los tamaños de los poros en la superficie de la pared interior de la membrana (superficie del lumen) son los más pequeños y se incrementan hacia la superficie exterior de la pared de la membrana, en donde el tamaño de los poros es el mayor.
20. Uso de la membrana de fibra hueca de cualquiera de las reivindicaciones 14 a 19 ó preparada mediante el proceso de cualquiera de las reivindicaciones 1 a 13, para la separación de plasma, la filtración de plasma, una microfiltración, una terapia con plasma, o una filtración celular.
Patentes similares o relacionadas:
Membranas que comprenden material celulósico y copolímero de bloques hidrofílico, del 29 de Julio de 2020, de PALL CORPORATION: Una membrana porosa que comprende celulosa regenerada y un copolímero de bloques de fórmula: A-B-A (I) o A-B (II), en la que el bloque A es: un copolímero de […]
Membrana semipermeable de triacetato de celulosa de tipo de fibra hueca, proceso para fabricar la misma, módulo y proceso de tratamiento de agua, del 24 de Junio de 2020, de TOYOBO CO., LTD.: Una membrana semipermeable de tipo de fibra hueca de triacetato de celulosa (CTA) que se caracteriza por que, cuando una disolución […]
Membranas hidrófilas y método de preparación de las mismas, del 29 de Abril de 2020, de PALL CORPORATION: Una membrana porosa que comprende un polímero aromático hidrófobo y un copolímero de bloques de la fórmula: A-B-A (I) o A-B (II), en donde el […]
Composiciones adsorbentes de tamiz molecular de carbono basadas en copolímeros de cloruro de vinilideno, proceso para su preparación y su uso en la separación de una mezcla de propano y propileno, del 15 de Abril de 2020, de Dow Global Technologies LLC: Una composición de tamiz molecular que comprende un copolímero de cloruro de polivinilideno carbonizado y que tiene microporos que tienen un tamaño de […]
Membrana de filtración de fibras huecas, del 25 de Marzo de 2020, de ASAHI KASEI MEDICAL CO., LTD.: Membrana de filtración de fibras huecas para eliminar impurezas de disoluciones de proteína, comprendiendo dicha membrana de filtración de fibras huecas un polímero […]
Membrana de separación y módulo que usa la membrana de separación, del 19 de Febrero de 2020, de TORAY INDUSTRIES, INC.: Una membrana de separación, que comprende una membrana que comprende un polímero, en donde la membrana tiene una capa funcional en un lado de la […]
Elemento filtrante con capacidad de verificación mejorada después de la vaporización en seco, del 13 de Noviembre de 2019, de Sartorius Stedim Biotech GmbH: Elemento filtrante fusionado con capacidad de verificación mejorada después de la vaporización en seco o alternativamente después de la esterilización por irradiación, […]
MODELOS DE PIEL BASADOS EN MEMBRANAS ARTIFICIALES CON LANOLINA, del 10 de Octubre de 2019, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un modelo artificial de piel capaz de simular el comportamiento de la piel natural a nivel de permeación y penetración de compuestos. Este […]