Matrices a base de anticuerpos para detectar transductores de señales múltiples en células de rara circulación.
Método para realizar un inmunoensayo multiplex de alto rendimiento con rango dinámico superior,
queconsiste en:
(a) incubar un extracto celular con varias series de dilución de anticuerpos de captura específicos para uno omás analitos del extracto celular, a fin de formar varios analitos capturados, estando los anticuerpos de capturasujetos a un soporte sólido;
(b) incubar todos los analitos capturados con anticuerpos detectores específicos de los respectivos analitos, paraformar varios analitos capturados detectables, de modo que los anticuerpos detectores comprenden:
(1) varios anticuerpos independientes del estado de activación, marcados con glucosa oxidasa y
(2) varios anticuerpos dependientes del estado de activación, marcados con un primer miembro de un parde amplificación de señal que es una peroxidasa,y la glucosa oxidasa genera peróxido de hidrógeno (H2O2), que es canalizado hacia el primer miembro del par deamplificación de señal y reacciona con él;
(c) incubar todos los analitos capturados detectables con un segundo miembro del par de amplificación de señal,para generar una señal amplificada; y
(d) detectar la señal amplificada generada a partir de los miembros primero y segundo del par de amplificaciónde señal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2007/079002.
Solicitante: NESTEC S.A..
Nacionalidad solicitante: Suiza.
Dirección: AVENUE NESTLE 55 1800 VEVEY SUIZA.
Inventor/es: SINGH, SHARAT, HARVEY,JEANNE, KIM,PHILLIP, LIU,XINJUN, LIU,LIMIN, BARHAM,ROBERT.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- G01N33/574 FISICA. › G01 METROLOGIA; ENSAYOS. › G01N INVESTIGACION O ANALISIS DE MATERIALES POR DETERMINACION DE SUS PROPIEDADES QUIMICAS O FISICAS (procedimientos de medida, de investigación o de análisis diferentes de los ensayos inmunológicos, en los que intervienen enzimas o microorganismos C12M, C12Q). › G01N 33/00 Investigación o análisis de materiales por métodos específicos no cubiertos por los grupos G01N 1/00 - G01N 31/00. › para el cáncer.
PDF original: ES-2398596_T3.pdf
Fragmento de la descripción:
Matrices a base de anticuerpos para detectar transductores de señales múltiples en células de rara circulación ANTECEDENTES DE LA PRESENTE INVENCIÓN
En la sangre de pacientes en diferentes fases tempranas de cáncer se encuentran con frecuencia células tumorales, como “micrometástasis” (células tumorales diseminadas) , que también se encuentran en cánceres metastásicos. El número de células tumorales en sangre depende de la fase y del tipo de tumor. Los tumores son extremadamente heterogéneos. Por consiguiente una biopsia de un solo lugar puede no ser representativa de la heterogeneidad de una población tumoral. Las biopsias se obtienen habitualmente de tumores primarios; sin embargo no se hacen biopsias de la mayoría de tumores metastásicos, lo cual dificulta todavía más el análisis molecular de muestras de tumores.
Durante la metástasis tumoral las células tumorales más agresivas abandonan el tumor primario y viajan a través de la sangre y del sistema linfático para alcanzar una ubicación alejada. Por tanto las células tumorales circulantes de la sangre representan la población más agresiva y homogénea de células tumorales. El número de células tumorales metastásicas en la sangre puede variar desde una hasta varios miles de células por milímetro de sangre. Por tanto se necesitan métodos específicos y sensibles para detectar estas células con fines diagnósticos y pronósticos. La presente invención satisface esta necesidad y además ofrece ventajas relacionadas.
BREVE RESUMEN DE LA PRESENTE INVENCIÓN
La presente invención proporciona un método para realizar un inmunoensayo multiplex de alto rendimiento con rango dinámico superior, que consiste en:
(a) incubar un extracto celular con varias series de dilución de anticuerpos de captura específicos para uno o más analitos del extracto celular, a fin de formar varios analitos capturados, estando los anticuerpos de captura sujetos a un soporte sólido;
(b) incubar todos los analitos capturados con anticuerpos detectores específicos de los respectivos analitos, para formar varios analitos capturados detectables, de modo que los anticuerpos detectores comprenden:
(1) varios anticuerpos independientes del estado de activación, marcados con glucosa oxidasa y
(2) varios anticuerpos dependientes del estado de activación, marcados con un primer miembro de un par
de amplificación de señal que es una peroxidasa, y la glucosa oxidasa genera peróxido de hidrógeno, que es canalizado hacia el primer miembro del par de amplificación de señal y reacciona con él;
(c) incubar todos los analitos capturados detectables con un segundo miembro del par de amplificación de señal, para generar una señal amplificada; y
(d) detectar la señal amplificada generada a partir de los miembros primero y segundo del par de amplificación de señal.
DESCRIPCIÓN BREVE DE LAS FIGURAS
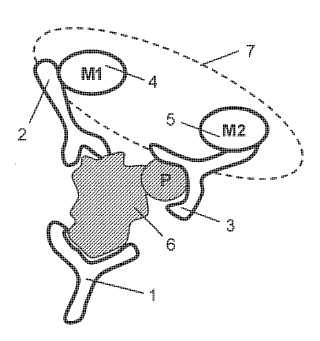
La figura 1 muestra tres anticuerpos unidos específicamente a un analito activado.
La figura 2 muestra un esquema de ensayo en el cual los anticuerpos marcados que se han unido específicamente a un analito activado están sujetos a un soporte sólido.
La figura 3 muestra la detección del RFCE total en células A431, empleando anticuerpos monoclonales contra el dominio extracelular de RFCE como anticuerpo de captura y anticuerpo detector en un ensayo ELISA. (a) Curva estándar del sándwich ELISA. La sensibilidad fue de aproximadamente 0, 25 pg/pocillo, empleando un dominio extracelular recombinante de RFCE humano. (b) Curva de valoración celular. La concentración de RFCE en células A431 se detectó mediante ELISA. (c) Tabla de concentración de RFCE calculada en pg/pocillo y en pg/célula. La concentración de RFCE calculada fue de aproximadamente 0, 6 pg en cada célula A431.
La figura 4 muestra la detección de RFCE fosforilado en células A431, empleando un anticuerpo monoclonal contra el dominio extracelular de RFCE como anticuerpo de captura y un anticuerpo monoclonal marcado con biotina contra el RFCE fosforilado como anticuerpo detector en un ensayo ELISA. (a) Curva de valoración celular con una serie de diluciones del anticuerpo de captura. (b) Tabla de relación señal/ruido (S/N) entre las células y el fondo. La relación señal/ruido fue de 1, 78 al nivel celular uno, cuando la concentración de anticuerpo de captura era de 0, 0625 μg/ml.
La figura 5 muestra la detección de ErbB2 total en células SKBr3, empleando anticuerpos monoclonales contra el dominio extracelular de ErbB2 como anticuerpo de captura y anticuerpo detector en un ensayo ELISA. (a) Valoración celular de ErbB2 total en células SKBr3. El rango de detección aproximado estaba comprendido entre 1.000 y 1, 37 células. (b) Tabla de relación señal/ruido (S/N) entre las células y el fondo. La relación señal/ruido fue de 2, 71 al nivel celular 1, 37, cuando la concentración de anticuerpo de captura era de 1 μg/ml.
La figura 6 muestra la detección de ErbB2 fosforilado en células SKBr3, usando un anticuerpo monoclonal contra el dominio extracelular de ErbB2 como anticuerpo de captura y un anticuerpo monoclonal contra ErbB2 fosforilado como anticuerpo detector en un ensayo ELISA. (a) Valoración celular de ErbB2 fosforilado en células SKBr3. El rango de detección aproximado estaba comprendido entre 500 y 5 células. (b) Tabla de relación señal/ruido (S/N) entre las células y el fondo. La relación señal/ruido fue de 3, 03 al nivel celular 5, cuando la concentración de anticuerpo de captura era de 1 μg/ml.
La figura 7 muestra la detección del total de proteína Erk2 fosforilada en células SKBr3, empleando anticuerpos monoclonales contra Erk2 como anticuerpo de captura y anticuerpo detector en un ensayo ELISA. (a) Detección del total de proteína Erk2, empleando anticuerpos monoclonales contra Erk2 como anticuerpo de captura y anticuerpo detector. (b) Detección de proteína Erk2 fosforilada, usando un anticuerpo monoclonal contra Erk2 como anticuerpo de captura y un anticuerpo monoclonal contra Erk2 fosforilada como anticuerpo detector. (c) Tabla de relación señal/ruido (S/N) entre las células y el fondo. La relación señal/ruido fue de aproximadamente 3 al nivel celular 1, 37 para la Erk2 total y fosforilada.
La figura 8 muestra la detección del total de RFCE en células A431, empleando anticuerpos monoclonales contra el dominio extracelular de RFCE como anticuerpo de captura y anticuerpo detector en una micromatriz ELISA. (a) Curva de dilución del anticuerpo de captura basada en el número de células. La micromatriz ELISA tenía un amplio rango dinámico para detectar RFCE en aproximadamente 1 - 10.000 células, con diferentes concentraciones de anticuerpo de captura en las series de dilución. (b) Curva de valoración celular basada en las series de dilución de concentraciones del anticuerpo de captura, la cual indicó que podía detectarse RFCE a partir de una célula (flecha) .
(c) Tabla de relación señal/ruido (S/N) entre las células y el fondo a varias concentraciones de anticuerpo de captura en las series de dilución. La relación señal/ruido fue de 2, 11 al nivel celular uno, cuando la concentración de anticuerpo de captura era de 0, 0625 mg/ml (flecha) .
La figura 9 muestra la detección de RFCE fosforilado en células A431, empleando un anticuerpo monoclonal contra el dominio extracelular de RFCE como anticuerpo de captura y un anticuerpo monoclonal contra RFCE fosforilado como anticuerpo detector en una micromatriz ELISA. (a) Curva de dilución del anticuerpo de captura basada en el número de células. La micromatriz ELISA tenía un amplio rango dinámico para detectar RFCE fosforilado en 1
10.000 células aproximadamente, con diferentes concentraciones de anticuerpo de captura en las series de dilución.
(b) Curva de valoración celular basada en las series de dilución de concentraciones del anticuerpo de captura, la cual indicó que podía detectarse RFCE fosforilado a partir de una célula. (c) Tabla de relación señal/ruido (S/N) entre las células y el fondo a varias concentraciones de anticuerpo de captura en las series de dilución. La relación señal/ruido fue de 1, 33 al nivel celular uno, cuando la concentración de anticuerpo de captura era de 0, 125 mg/ml (flecha) .
La figura 10 muestra la detección de ErBb2 total en células SKBr3, empleando anticuerpos monoclonales contra el dominio extracelular de ErBb2 como anticuerpo de captura y anticuerpo detector en una micromatriz ELISA. (a) Curva de dilución del anticuerpo de captura basada en el número de células. La micromatriz ELISA tenía un amplio rango dinámico para detectar ErBb2 en 1 - 10.000 células aproximadamente, con diferentes... [Seguir leyendo]
Reivindicaciones:
1. Método para realizar un inmunoensayo multiplex de alto rendimiento con rango dinámico superior, que consiste en:
(a) incubar un extracto celular con varias series de dilución de anticuerpos de captura específicos para uno o más analitos del extracto celular, a fin de formar varios analitos capturados, estando los anticuerpos de captura sujetos a un soporte sólido;
(b) incubar todos los analitos capturados con anticuerpos detectores específicos de los respectivos analitos, para formar varios analitos capturados detectables, de modo que los anticuerpos detectores comprenden:
(1) varios anticuerpos independientes del estado de activación, marcados con glucosa oxidasa y
(2) varios anticuerpos dependientes del estado de activación, marcados con un primer miembro de un par
de amplificación de señal que es una peroxidasa, y la glucosa oxidasa genera peróxido de hidrógeno (H2O2) , que es canalizado hacia el primer miembro del par de amplificación de señal y reacciona con él;
(c) incubar todos los analitos capturados detectables con un segundo miembro del par de amplificación de señal, para generar una señal amplificada; y
(d) detectar la señal amplificada generada a partir de los miembros primero y segundo del par de amplificación de señal.
2. El método de la reivindicación 1, en que el extracto celular comprende un extracto de células circulantes de un tumor sólido.
3. El método de la reivindicación 2, en que las células se aíslan de una muestra de un paciente por separación inmunomagnética.
4. El método de la reivindicación 3, en que la muestra del paciente se elige del grupo formado por sangre entera, suero, plasma, orina, esputos, líquido de lavado bronquioalveolar, lágrimas, líquido aspirado del pezón, linfa, saliva, aspirado con aguja fina y combinaciones de las mismas.
5. El método de la reivindicación 3, en que las células aisladas se eligen del grupo constituido por células tumorales circulantes, células endoteliales circulantes, células progenitoras endoteliales circulantes, células madre cancerosas y combinaciones de las mismas.
6. El método de la reivindicación 3, en el cual las células aisladas son i) estimuladas in vitro con factores de crecimiento o ii) incubadas con un fármaco anticáncer tal como un anticuerpo monoclonal, un inhibidor de tirosina cinasa, un agente inmunosupresor y combinaciones de ellos, antes de la estimulación con factor de crecimiento, y iii) lisadas tras la estimulación con factor de crecimiento para producir el extracto celular.
7. El método de la reivindicación 1, en que uno o más analitos comprenden varias moléculas transductoras de señales.
8. El método de la reivindicación 1, en que el soporte sólido se escoge del grupo formado por vidrio, plástico, chips, agujas, filtros, perlas, papel, membranas, haces de fibras y combinaciones de los mismos.
9. El método de la reivindicación 1, en que los anticuerpos independientes del estado de activación comprenden además un fragmento detectable tal como un fluoróforo.
10. El método de la reivindicación 9, en que la cantidad del fragmento detectable se correlaciona con la cantidad de uno o más analitos.
11. El método de la reivindicación 1, en que los anticuerpos dependientes del estado de activación van marcados directamente con glucosa oxidasa.
12. El método de la reivindicación 1, en que los anticuerpos independientes del estado de activación están marcados con glucosa oxidasa mediante la hibridación entre un oligonucleótido conjugado con los anticuerpos independientes del estado de activación y un oligonucleótido complementario conjugado con glucosa oxidasa.
13. El método de la reivindicación 1, en que los anticuerpos dependientes del estado de activación van marcados directamente con el primer miembro del par amplificador de la señal.
14. El método de la reivindicación 1, en que los anticuerpos dependientes del estado de activación van marcados con el primer miembro del par amplificador de la señal mediante la unión entre un primer miembro de un par de fijación, tal como biotina, conjugado con los anticuerpos dependientes del estado de activación, y un segundo miembro del par de fijación, tal como estreptavidina, conjugado con el primer miembro del par amplificador de la señal.
15. El método de la reivindicación 1, en que la peroxidasa es peroxidasa de rábano picante HRP) .
16. El método de la reivindicación 14, en que el segundo miembro del par amplificador de la señal es un reactivo
de tiramida tal como biotina-tiramida. 5
17. El método de la reivindicación 16, en que la señal amplificada es generada mediante la oxidación de la biotina-tiramida por peroxidasa, para producir una tiramida activada.
18. El método de la reivindicación 17, en que la tiramida activada se detecta directamente. 10
19. El método de la reivindicación 17, en que la tiramida activada es detectada tras la adición de un reactivo detector de señales, tal como un fluoróforo marcado con estreptavidina.
20. El método de la reivindicación 19, en el cual el reactivo detector de señales es una combinación de una 15 peroxidasa marcada con estreptavidina y un reactivo cromogénico tal como 3, 3’, 5, 5’-tetrametilbencidina (TMB) .
Número de células
fracción 7 a
Dilución 10X en serie fracción 10 a Dilución 10X en serie fracción 13 a Dilución 10X en serie Número de células RFCE directo RFCE directo RFCE proximidad
Patentes similares o relacionadas:
Composiciones para la supresión del cáncer por inhibición de TMCC3, del 29 de Julio de 2020, de Development Center For Biotechnology: Un anticuerpo contra la proteína con dominios de superhélice transmembrana 3 (TMCC3), o un fragmento de unión de la misma, en donde el anticuerpo […]
Métodos para detectar distintivos de enfermedades o afecciones en fluidos corporales, del 15 de Julio de 2020, de PRESIDENT AND FELLOWS OF HARVARD COLLEGE: Un método in vitro para diagnosticar la presencia de un agente infeccioso en un individuo que comprende los pasos de: obtener un primer perfil de expresión […]
Biomarcadores de pronóstico y predictivos y aplicaciones biológicas de los mismos, del 1 de Julio de 2020, de INSTITUT GUSTAVE ROUSSY: Un método para evaluar la sensibilidad o la resistencia de un tumor frente a un agente antitumoral, que comprende evaluar la cantidad de complejo eiF4E-eiF4G (complejo Cap-ON) […]
Métodos para clasificar pacientes con un cáncer sólido, del 24 de Junio de 2020, de INSERM (INSTITUT NATIONAL DE LA SANTE ET DE LA RECHERCHE MEDICALE): Un método in vitro para el pronóstico del tiempo de supervivencia de un paciente que padece un cáncer sólido, cuyo método comprende los siguientes […]
Procedimiento de detección del cáncer, del 24 de Junio de 2020, de Sienna Cancer Diagnostics Ltd: La presente invención proporciona un procedimiento para resolver una evaluación citológica no concluyente de células epiteliales de vejiga en […]
Método para el diagnóstico/pronóstico de cáncer colorrectal, del 17 de Junio de 2020, de CONSEJO SUPERIOR DE INVESTIGACIONES CIENTIFICAS (CSIC): La presente invención se refiere a un método de obtención de datos útiles para el diagnóstico, el pronóstico o la monitorización de la evolución de cáncer colorrectal (CCR), […]
Criterio de valoración terapéutico equivalente para inmunoterapia de enfermedades basada en antiCTLA-4, del 10 de Junio de 2020, de E. R. Squibb & Sons, L.L.C: Un anticuerpo antiCTLA-4 para su uso en el tratamiento de cáncer en un sujeto, tratamiento que comprende inducir un acontecimiento liminar […]
Método de deducción de un valor de positividad de biomarcador en porcentaje para células seleccionadas presentes en un campo de visión, del 10 de Junio de 2020, de NOVARTIS AG: Método de deducción de un valor para el % de positividad de biomarcador (PBP) para todas las células u, opcionalmente, uno o más subconjuntos de las […]