Líneas celulares para expresar enzima útil en la preparación de productos amidados.
Una línea celular que tiene la designación del depósito de ATCC Nº PTA-6784.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2006/024687.
Solicitante: Enteris BioPharma, Inc.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 83 Fulton Street Boonton, NJ 07005 ESTADOS UNIDOS DE AMERICA.
Inventor/es: MEHTA, NOZER M., Consalvo,Angelo,P, MILLER,DUNCAN A.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07H21/04 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12N5/06
- C12N9/06 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › actúan sobre compuestos que contienen nitrógeno como dadores (1.4, 1.5, 1.7).
- C12P21/06 C12 […] › C12P PROCESOS DE FERMENTACION O PROCESOS QUE UTILIZAN ENZIMAS PARA LA SINTESIS DE UN COMPUESTO QUIMICO DADO O DE UNA COMPOSICION DADA, O PARA LA SEPARACION DE ISOMEROS OPTICOS A PARTIR DE UNA MEZCLA RACEMICA. › C12P 21/00 Preparación de péptidos o de proteínas (proteína monocelular C12N 1/00). › preparados por hidrólisis de un enlace peptídico, p. ej. hidrolizados.
PDF original: ES-2437068_T3.pdf

Fragmento de la descripción:
Líneas celulares para expresar enzima útil en la preparación de productos amidados
Campo de la invención La presente invención se refiere a líneas celulares, para la expresión de monooxigenasa peptidilglicina alfa amidante (PAM o e-AE) .
PAM (o uno de sus dominios catalíticos) es útil para catalizar la conversión enzimática de X-Gly a X-alfa-hidroxi-Gly
o X-NH2 (siendo X un péptido o cualquier compuesto químico que tenga un grupo carbonilo al que pueda unirse covalentemente un grupo de glicina) .
Descripción de la técnica relacionada Numerosas hormonas humanas, factores de crecimiento, citocinas, neurotransmisores, ácidos grasos derivados y otros compuestos biológicos importantes tienen aminoácido o péptido como una parte sustancial de sus estructuras moleculares. Muchas enfermedades responden positivamente a la elevación del nivel de estos compuestos biológicos en los pacientes. Pueden administrarse cantidades terapéuticamente eficaces de dichos compuestos biológicamente relevantes a pacientes de diversas maneras. Por lo tanto son muy importantes los procedimientos de fabricación rentables eficaces para dichos compuestos. Esto es especialmente cierto cuando los compuestos biológicos se preparan en forma de dosificación para suministro oral, un modo habitualmente preferido de administración a pesar de la menor biodisponibilidad en relación con otros modos de administración.
Las células de mamífero y otras eucariotas pueden realizar ciertos procedimientos de procesamiento posttraduccional, mientras que las procariotas no. Ciertos procariotas, tales como E. coli, se emplean ampliamente como hospedadores para la producción de proteínas de mamífero mediante tecnología de ADN recombinante (ADNr) debido a que pueden cultivarse fácilmente en procedimientos de fermentación discontinua y debido a que están bien caracterizados genéticamente. Sin embargo, muchas proteínas de mamífero requieren algún tipo de procesamiento post-traduccional. Si estas proteínas se producen por ingeniería genética de E. coli, por ejemplo, el procesamiento post-traduccional debe conseguirse con frecuencia usando procedimientos químicos in vitro complejos que son caros para aplicaciones de producción a gran escala. Incluso cuando los péptidos se producen de forma recombinante usando huéspedes mamíferos, es con frecuencia deseable producir eficazmente un precursor que se someta solamente después a modificación adicional.
Un tipo de dicha actividad de procesamiento adicional implica la amidación específica del aminoácido carboxilo terminal de un péptido o proteína. Muchas hormonas y péptidos de origen natural contienen dicha modificación, que con frecuencia es esencial si la proteína va a ser biológicamente activa. Un ejemplo es calcitonina, en la que la sustitución con un resto de prolina no amidado de la prolina amidada de la forma nativa da como resultado una reducción muy significativa de la actividad biológica. Otros péptidos biológicos que requieren amidación posttraduccional para su actividad completa incluyen pero sin limitación factor de liberación de la hormona del crecimiento, otras calcitoninas, péptido relacionado con el gen de la calcitonina, secretina, péptido YY y similares.
Las secuencias polipeptídicas para muchas proteínas biológicas importantes que requieren amidación para máxima eficacia, pueden fabricarse, por ejemplo, mediante técnicas de ingeniería genética. Sin embargo, la importante, y en ocasiones esencial, amidación carboxilo terminal debe realizarse con frecuencia in vitro. Es deseable evitar técnicas de amidación química costosas e incómodas en este punto, y es por lo tanto deseable utilizar una enzima amidante para realizar la amidación específica. La amidación específica del aminoácido carboxilo terminal de una proteína se cataliza frecuentemente por enzimas alfa-amidantes.
La monooxigenasa peptidilglicina e amidante (PAM) cataliza la conversión de un sustrato peptídico a un producto peptídico amidado. La conversión es una reacción de dos etapas. PAM tiene dos dominios catalíticos: monooxigenasa peptidilglicina e amidante (PHM) cataliza la etapa 1 (conversión de sustrato a intermedio) y liasa peptidilglicina e-hidroxiglicina e-amidante (PAL) cataliza la etapa 2 (conversión de intermedio a producto) . La PAM de longitud completa es bifuncional y cataliza más etapas. La etapa 2 también puede conseguirse eficazmente de forma no enzimática si el intermedio se pone en contacto con una base de Lewis.
En la naturaleza, aproximadamente el 50 % de las hormonas peptídicas y neurotransmisores están amidados por PAM de la manera anterior. La actividad PAM se ha reconocido en numerosas especies diversas, PAM tiende a tener homología estructural significativa entre especies tan diversas como rata, vaca y rana. También se sabe que la función, sustrato y cofactores de PAM son similares (frecuentemente idénticos) entre especies. El sustrato es un compuesto, con frecuencia un péptido, que tiene un resto de glicina con un grupo carboxilo libre. Se conocen bien en la técnica reacciones de amidación catalizadas por PAM. Por ejemplo, se describe una en detalle en la Patente de Estados Unidos 6.103.495 en la que se usa una monooxigenasa peptidilglicina e amidante para catalizar la conversión de un precursor de calcitonina de salmón extendido con glicina a calcitonina de salmón auténtica, amidada en su extremo C terminal (es decir, que tiene un grupo amino en lugar de la glicina C terminal del precursor) .
Se conocen en la técnica fuentes de PAM y líneas celulares que expresan PAM. La producción catalizada por PAM a gran escala de péptidos amidados requiere una fuente de alto rendimiento estable de PAM para mejor rentabilidad. Adicionalmente, debido a que PAM se utiliza frecuentemente para la producción de productos farmacéuticos humanos potenciales, es importante que el sistema para la producción de PAM (tanto la línea celular que expresa PAM como el medio de cultivo en el que crece) introduzca tan pocas impurezas como sea posible durante la expresión de PAM. Es de interés particular minimizar el uso de las proteínas de mamífero para evitar el riesgo de encefalopatías espongiformes transmisibles (TSE) . Los factores de crecimiento proteicos de mamíferos en el medio de cultivo (no deseable desde un punto de vista de TSE) pueden no obstante ser útiles para ayudar a la supervivencia y expresión de producto de líneas celulares que expresan PAM. Por lo tanto, existe la necesidad en la técnica de células que expresen PAM (o que expresen PHM) que proporcionen fuerte expresión y muestren buena estabilidad y supervivencia incluso en ausencia de proteínas de mamífero que podrían de otro modo requerirse en el medio.
Sumario de la invención Es por lo tanto un objetivo de la presente invención proporcionar células que expresen PAM que sean suficientemente resistentes para tener buenas tasas de supervivencia y buenos rendimientos de expresión en medio sustancialmente desprovisto de los tipos de proteínas de mamífero y otras impurezas que podrían ser problemáticas cuando la enzima se use posteriormente en la fabricación de productos (por ejemplo fabricación de productos farmacéuticos amidados) .
Es un objetivo adicional de la invención proporcionar células que expresen PAM que no co-expresen en sí mismas impurezas indeseables significativas.
Es un objetivo adicional proporcionar células que expresen PAM que proporcionen buenos rendimientos de expresión.
Es un objetivo adicional proporcionar un método para purificar PAM o PHM para su uso en reacciones enzimáticas, y para proporcionar de este modo buenas reacciones enzimáticas y producto amidado resultante.
Estos y otros objetivos los proporcionan las invenciones desveladas en la presente memoria.
La invención proporciona una línea celular que tiene el Nº de designación de depósito de ATCC PTA-6784 (UGL 7326/M) .
La invención proporciona el uso de una línea celular que tiene el Nº de designación de depósito de ATCC PTA-6784 para expresar monooxigenasa peptidilglicina alfa-amidante.
La invención proporciona un método para la producción in vitro de un producto amidado, comprendiendo dicho método usar la línea celular con el Nº de designación de depósito de ATCC PTA-6784 para expresar monooxigenasa peptidilglicina alfa-amidante y hacer reaccionar un precursor que tenga un resto de glicina, en forma de ácido libre y unido a un grupo carbonilo, en presencia de la monooxigenasa peptidilglicina alfa-amidante.
La invención proporciona un método para purificar una seleccionada de monooxigenasa peptidilglicina alfa-amidante y monooxigenasa peptidilglicina alfa-hidroxilante después de... [Seguir leyendo]
Reivindicaciones:
1. Una línea celular que tiene la designación del depósito de ATCC Nº PTA-6784.
2. Uso de una línea celular que tiene la designación del depósito de ATCC Nº PTA-6784 para expresar monooxigenasa peptidilglicina alfa-amidante.
3. Un método para la producción in vitro de un producto amidado, comprendiendo dicho método usar la línea celular con la designación de depósito de ATCC Nº PTA-6784 para expresar monooxigenasa peptidilglicina alfa-amidante y
hacer reaccionar un precursor que tiene un resto de glicina, en forma de ácido libre y unido a un grupo carbonilo, en presencia de la monooxigenasa peptidilglicina alfa-amidante.
4. Un método para purificar una seleccionada de monooxigenasa peptidilglicina alfa-amidante y monooxigenasa peptidilglicina alfa-hidroxilante después de la expresión y secreción de las mismas al medio de cultivo, incluyendo 15 dicho método las etapas de:
(A) someter una muestra impura de monooxigenasa peptidilglicina alfa-amidante o monooxigenasa peptidilglicina alfa-hidroxilante, respectivamente, a cromatografía de intercambio aniónico en la que la elución es isocrática;
(B) someter el eluyente de la etapa (A) a cromatografía de interacción hidrófoba, en la que no se usa sulfato de 20 amonio y en la que la elución es isocrática.
5. El método de la reivindicación 4 en el que se utiliza citrato sódico para facilitar la unión a columna en la etapa (B) .
Figura 1 Mapa plasmídico de PHS1 Mapa Plasmídico de pUC8
Figura 3 Mapa Plasmídico de pSV402MT
Figura 4 Derivación de la Secuencia Génica de ADNc de e-AE
Figura 5 Mapa Plasmídico de pAE73
Figura 6 Esquema de Adaptación de Suspensió.
7. 26
Figura 7 Concentración de Oxígeno Disuelto y Productividad de e-AE en Matraces de Agitación
Figura 8 Efecto del Volumen de Agitación en OD y la Productividad de e-AE
Figura 9 pH del Cultivo de Agitación de UG.
7. 26/M
Figura 10 Perfil de pH de Biorreactores de Tanque Agitado y Matraces de Agitación sin Control de pH
Carril 1 -Patrón de referencia de e-AE, Carri.
2. Marcadores de Peso Molecular de Intervalo Amplio, Carri.
3. Recogido Clarificado, Carri.
4. Retenido de TFF 1, Carri.
5. Retenido de TFF 1, Carri.
6. Eluato de Q-Sepharose FF, Carri.
7. Eluato de Q-Sepharose FF, Carri.
8. Eluato de Fenil Sepharose FF, Carri.
9. Eluato de Fenil Sepharose, Carri.
10. Retenido de TFF 2.
Figura 13 Exploración Densitométrica de Gel de SDS PAGE y Cálculo de Porcentaje de Áreas de Pico
Figura 14 Diagrama de Flujo del Procedimiento para Producción de e-AE
Patentes similares o relacionadas:
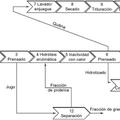 Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
Quitina, hidrolizado y procedimiento para la producción de uno o más productos de interés a partir de insectos mediante
hidrólisis enzimática, del 29 de Julio de 2020, de Ynsect: Hidrolizado preparado a partir de insectos, que comprende al menos 40 % en peso de proteínas sobre el peso total de materia seca, un contenido […]
 Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Procedimiento de fermentación de alimentación discontinua de alta densidad celular para producir proteínas recombinantes, del 25 de Marzo de 2020, de WYETH LLC: Un procedimiento de producción de una proteína recombinante que comprende:
cultivar una célula bacteriana recombinante para expresar una proteína recombinante […]
Uso de tripeptidil peptidasas tolerantes a la prolina en composiciones de aditivo para piensos, del 26 de Febrero de 2020, de Dupont Nutrition Biosciences ApS: Un método para preparar una composición de aditivo para piensos que comprende: mezclar al menos una tripeptidil peptidasa tolerante a la prolina que tiene […]
Enzimas específicas de sitio y métodos de uso, del 19 de Febrero de 2020, de Poseida Therapeutics, Inc: Un polipéptido que comprende al menos una secuencia de aminoácidos que tiene la secuencia de LSTEQVVAIASX1X2GGKQALEAVKAQLLVLRAAPYE (SEQ ID NO: 1), en donde […]
Composiciones para unir módulos de dedos de cinc, del 15 de Enero de 2020, de Sangamo Therapeutics, Inc: Una proteína de dedos de cinc de múltiples dedos que se une específicamente a un sitio diana, comprendiendo la proteína de dedos de cinc de […]
Concentrado de proteínas de granos que contienen almidón: composición, método de fabricación y usos del mismo, del 1 de Enero de 2020, de THE UNITED STATES OF AMERICA AS REPRESENTED BY THE SECRETARY OF AGRICULTURE: Un proceso para producir un concentrado de proteinas a partir de un grano o semilla oleaginosa que contiene almidon, el proceso comprende: (i) moler el […]
 Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
Terapia de ARNm para el tratamiento de enfermedades oculares, del 25 de Diciembre de 2019, de Translate Bio, Inc: Una composición que comprende un ARNm que codifica un péptido o polipéptido terapéutico para su uso en el tratamiento de una enfermedad, trastorno o afección ocular en un […]
 Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]
Purificación de proteínas con prefiltrado, del 27 de Noviembre de 2019, de EMD Millipore Corporation: Un método para eliminar constituyentes de unión no específica de una corriente que contiene proteínas que comprende:
hacer fluir la corriente que contiene proteínas […]