Línea celular MDCK no tumorigénica para propagar virus.
Formulación de medio que comprende SF de Taub, lípidos e hidrolizado de trigo,
en la que SF de Taub es una mezcla 50:50 de DMEM y F12 de Ham complementada con hormonas, insulina 5 μg/ml, transferrina 5 μg/ml, prostaglandina E1 25 ng/ml, hidrocortisona 50 nM, triyodotironina 5 pM, Na2SeO3 10 nM, glucosa 4,5 g/l, NaHCO3 2,2 g/l y L-glutamina 4 mM.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2005/045587.
Solicitante: MEDIMMUNE, LLC.
Nacionalidad solicitante: Estados Unidos de América.
Dirección: ONE MEDIMMUNE WAY GAITHERSBURG, MD 20878 ESTADOS UNIDOS DE AMERICA.
Inventor/es: SCHWARTZ,Richard, BERRY,John Michael, SUBRAMANIAN,Ajit, SHI,Xiao.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12N5/09 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 5/00 Células no diferenciadas humanas, animales o vegetales, p. ej. líneas celulares; Tejidos; Su cultivo o conservación; Medios de cultivo para este fin (reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00). › Células tumorales.
PDF original: ES-2382557_T3.pdf
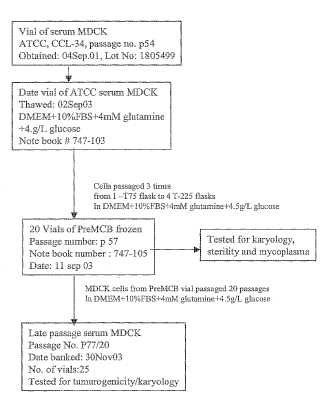
Fragmento de la descripción:
Línea celular MDCK no tumorigénica para propagar virus.
Campo de la invención La presente invención se refiere a formulaciones de medios y métodos de cultivo para la propagación de las células MDCK no tumorigénicas así como a métodos para mantener la naturaleza no tumorigénica de las líneas celulares de la invención. La presente invención se refiere además a procedimientos para la producción de virus influenza en cultivo celular usando células MDCK no tumorigénicas. La presente invención también se refiere a un procedimiento para la producción de composiciones inmunogénicas que contienen virus de este tipo y/o componentes de los mismos.
Antecedentes de la invención
La vacunación es la medida de salud pública más importante para prevenir la enfermedad provocada por las epidemias anuales de gripe. El uso eficaz de las vacunas depende de poder producir rápidamente grandes cantidades de material de vacuna (por ejemplo, virus) a partir de una fuente estable y fácil de cultivar. El desarrollo rápido de las vacunas y su disponibilidad abundante son críticos en la lucha contra muchas enfermedades humanas y animales. Los retrasos en la producción de vacunas y la escasez en su cantidad pueden provocar problemas al abordar los brotes de la enfermedad. Por ejemplo, recientes estudios sugieren que hay un motivo de preocupación referente a los largos plazos de entrega requeridos para producir vacunas contra la gripe pandémica. Véase, por ejemplo, Wood, J. M., 2001, Philos. Trans. R. Soc. Lond. B. Biol. Sci., 356:1953. La producción eficaz de vacunas requiere el crecimiento de grandes cantidades de material de vacuna producido en altos rendimientos a partir de un sistema huésped. Diferentes materiales de vacuna requieren diferentes condiciones de crecimiento con el fin de obtener rendimientos aceptables. Puede producirse material de vacuna en huevos embrionados, células de cultivo tisular primarias o en líneas celulares establecidas. Sin embargo, estos sistemas huésped padecen actualmente varias limitaciones detalladas a continuación.
Se usan normalmente huevos embrionados para la producción de virus de vacunas contra la gripe en un proceso intensivo de tiempo, trabajo y coste que necesita el manejo de la cría de pollos y la fertilización de huevos. Además, la vacuna contra la gripe producida en huevos está contraindicada para personas con alergias al huevo debido a la reacción de hipersensibilidad inmediata grave que puede producirse. Por tanto, la industria de las vacunas ha realizado un esfuerzo para desarrollar plataformas de producción alternativas que no utilizan huevos tales como producir la vacuna contra la gripe en un sistema de cultivo celular.
El uso de células de cultivo tisular primarias se ve obstaculizado por las dificultades encontradas en el desarrollo y el mantenimiento de una población de células primarias estables. A menudo, se usan líneas celulares establecidas para sortear las limitaciones técnicas de las células primarias. Sin embargo, se sabe que muchas de estas líneas celulares son tumorigénicas y como tales surgen problemas de seguridad y se ven sometidas a limitaciones regulatorias significativas con respecto a su uso para la producción de vacunas. De hecho, las directrices aplicables de la Organización Mundial de la Salud indican que sólo unas pocas líneas celulares están permitidas para la producción de vacunas. Surgen problemas adicionales del uso de aditivos de suero y/o proteína derivados de fuentes animales o humanas en medios de cultivo celular. Por ejemplo, se conocen bien la variabilidad en la calidad y composición entre lotes de aditivos y el riesgo de contaminación con micoplasmas, virus, agentes de BSE y otros agentes infecciosos. En general, el suero o las sustancias derivadas del suero como albúmina, transferrina o insulina pueden contener agentes no deseados que pueden contaminar el cultivo y los productos biológicos producidos a partir del mismo. Por tanto, muchos grupos están trabajando para desarrollar condiciones de cultivo y sistemas huésped eficaces que no requieren suero o productos derivados del suero.
En consecuencia, ha habido una demanda para el establecimiento de una línea celular no tumorigénica útil para la producción de materiales de vacuna de una manera estable, altamente segura y de bajo coste preferiblemente en condiciones de cultivo libre de suero o libre de proteínas animales. Un sistema celular de este tipo sería particularmente útil para la producción de material de vacuna contra la gripe.
Se han usado tradicionalmente células de riñón canino Madin Darby (MDCK) para la titulación de virus influenza (Zambon M., en Textbook of Influenza, ed Nicholson, Webster y Hay, cap. 22, págs. 291-313, Blackwell Science (1998) ) . Estas células se establecieron en 1958 a partir del riñón de un cocker spaniel macho normal. En la ATCC figura que la línea MDCK (CCL 34) ha sido depositada por S. Madin y N. B. Darby, sin embargo, están disponibles otros numerosos linajes de células MDCK. Leighton J y sus colaboradores publicaron una serie de artículos (Leighton et al., 1968, Science 163:472; Leighton et al., 1970, Cancer 26:1022 y Leighton et al., 1971 Europ J. Cancer 8:281) que documentan las características oncogénicas de las células MDCK. Sin embargo, el linaje y el número de pases de las células MDCK para estos estudios no se describió y ya se sabía que células MDCK de diferentes linajes y diferentes pases mostraban cambios en el número y la estructura de los cromosomas (Gaush et al., 1966, Proc. Soc. Exp. Biol. Med., 122: 93 1) que podrían dar como resultado células con propiedades tumorigénicas.
Puesto que una de las principales consideraciones para la aceptabilidad de una línea celular para la producción de vacunas se refiere al potencial maligno de esas células, el uso de células MDCK para la producción de material de vacuna usando líneas celulares descritas en la actualidad es limitado. Groner et al. (patente estadounidense 6.656.720) y Makizumi et al. (patente estadounidense 6.825.036) pretenden ambos dar a conocer líneas celulares derivadas de células MDCK que se han adaptado a crecer en medios libre de suero en suspensión y que pueden utilizarse para la producción de virus influenza. Sin embargo, se ha notificado que hay una correlación entre la pérdida del requisito de anclaje y la transformación de células animales normales a células que son tumorigénicas (Stiles et al., 1976, Cancer Res., 36:3300) . Varios grupos (Kessler et al., 1999, Cell Culture Dev Biol Stand, 98:13; Merten et al., 1999, Cell Culture Dev Biol Stand, 98:23 y Tree et al., 2001, Vaccine, 19:3444) pretenden describir el uso de células MDCK para la producción a gran escala de virus influenza; sin embargo, no abordan la posible transformación de las células MDCK usadas.
La mención o discusión de una referencia en el presente documento no debe interpretarse como una admisión de que tal es técnica anterior a la presente invención. Además, la mención de una patente no debe interpretarse como una admisión de su validez.
Sumario de la invención
La presente invención se define mediante las reivindicaciones. También se proporcionan en el presente documento células MDCK no tumorigénicas que se han adaptado a crecer en formulaciones de medios que o bien contienen suero o bien libres de suero incluyendo formulaciones libres de proteínas animales (APF) . En una realización, las células MDCK no tumorigénicas de la invención son adherentes. En otras realizaciones, las células MDCK no tumorigénicas de la invención tienen una morfología epitelial. Aún en otra realización, las células MDCK no tumorigénicas de la invención son adherentes y tienen una morfología epitelial. La tumorigenicidad, en una realización, se determina mediante el modelo de ratón desnudo adulto (por ejemplo, Stiles et al., 1976, Cancer Res, 36:1353, y ejemplo 2 más adelante) . La tumorigenicidad también puede someterse a prueba mediante otros ensayos, por ejemplo, mediante inyección en un embrión de pollo y/o aplicación tópica al corioalantoides (Leighton et al., 1970, Cancer, 26:1024) .
Los virus que pueden crecer en las células MDCK de la invención incluyen pero no se limitan a virus de ARN de cadena negativa, incluyendo pero sin limitarse a virus influenza, VRS, parainfluenza 1, 2 y 3, y metapneumovirus humano.
La presente invención proporciona métodos y formulaciones de medios útiles para la derivación y el mantenimiento de células MDCK no tumorigénicas. Las células MDCK de la invención son particularmente útiles para la producción de material de vacuna... [Seguir leyendo]
Reivindicaciones:
1. Formulación de medio que comprende SF de Taub, lípidos e hidrolizado de trigo, en la que SF de Taub es una mezcla 50:50 de DMEM y F12 de Ham complementada con hormonas, insulina 5 !g/ml, transferrina 5 !g/ml, prostaglandina E1 25 ng/ml, hidrocortisona 50 nM, triyodotironina 5 pM, Na2SeO3 10 nM, glucosa 4, 5 g/l, NaHCO3 2, 2 g/l y L-glutamina 4 mM.
2. Formulación de medio seleccionada del grupo que consiste en:
(a) MediV SF103; es decir, medio SF de Taub, concentrado de lípidos a una concentración final de 1X y peptona de trigo E1 2, 5 g/l,
en la que SF de Taub es una mezcla 50:50 de DMEM y F12 de Ham complementada con hormonas, insulina 5 !g/ml, transferrina 5 !g/ml, prostaglandina E1 25 ng/ml, hidrocortisona 50 nM, triyodotironina 5 pM, Na2SeO3 10 nM, glucosa 4, 5 g/l, NaHCO3 2, 2 g/l y L-glutamina 4 mM;
(b) MediV SF104; es decir, MediV SF103 con EGF 0, 01 !g/ml; y
(c) MediV SF105; es decir, MediV SF103 sin transferrina pero con EGF 0, 01 !g/ml, y citrato de amonio férrico:tropolona o sulfato de amonio férrico:tropolona a una razón de entre 10 a 1 y 70 a 1.
3. Método de mantenimiento de la naturaleza no tumorigénica de una célula animal que comprende cultivar dicha célula animal en una formulación de medio según la reivindicación 2.
4. Procedimiento para preparar una línea celular MDCK no tumorigénica, adherente que puede cultivarse en medio libre de suero y que puede infectarse por virus influenza, que comprende las etapas:
a. adaptar células MDCK a crecer en un medio libre de suero seleccionado del grupo que consiste en: SF de Taub que comprende lípidos e hidrolizado de trigo; SF de Taub que comprende lípidos, hidrolizado de trigo y EGF; y SF de Taub que comprende lípidos, hidrolizado de trigo, EGF, tropolona, pero que carece de transferrina, en el que SF de Taub es una mezcla 50:50 de DMEM y F12 de Ham complementada con hormonas, insulina 5 !g/ml, transferrina 5 !g/ml, prostaglandina E1 25 ng/ml, hidrocortisona 50 nM, triyodotironina 5 pM, Na2SeO3 10 nM, glucosa 4, 5 g/l, NaHCO3 2, 2 g/l y L-glutamina 4 mM;
b. mantener las condiciones de crecimiento; y
c. establecer un banco de células.
5. Composición de cultivo celular que comprende células MDCK no tumorigénicas obtenidas mediante un procedimiento según la reivindicación 4 y un medio libre de suero seleccionado de
(a) SF de Taub que comprende lípidos e hidrolizado de trigo;
(b) SF de Taub que comprende lípidos, hidrolizado de trigo y EGF; y
(c) SF de Taub que comprende lípidos, hidrolizado de trigo, EGF, tropolona, pero que carece de transferrina,
en la que SF de Taub es una mezcla 50:50 de DMEM y F12 de Ham complementada con hormonas, insulina 5 !g/ml, transferrina 5 !g/ml, prostaglandina E1 25 ng/ml, hidrocortisona 50 nM, triyodotironina 5 pM, Na2SeO3 10 nM, glucosa 4, 5 g/l, NaHCO3 2, 2 g/l y L-glutamina 4 mM.
6. Composición de cultivo celular según la reivindicación 5, en la que dichas células MDCK no tumorigénicas se derivan de la línea celular MDCK (ATCC CCL34) .
7. Composición de cultivo celular según la reivindicación 5, en la que dichas células MDCK no tumorigénicas se derivan de la línea celular MDCK-S (ATCC PTA-6500) .
8. Composición de cultivo celular según la reivindicación 5, en la que dichas células MDCK no tumorigénicas son MDCK-SF103 (PTA-6503) .
9. Procedimiento para la producción de virus influenza que comprende:
a. infectar las células MDCK de la composición de cultivo celular según la reivindicación 5, 6 u 8;
b. incubar dicha composición de cultivo celular; y
c. aislar los virus influenza de dicha composición de cultivo celular.
10. Procedimiento para la producción de una composición inmunogénica que comprende realizar un procedimiento según la reivindicación 9 y formular polipéptidos de un virus influenza obtenido de ese modo en un diluyente o portador farmacéuticamente aceptable.
Patentes similares o relacionadas:
Marcadores de células madre de leucemia mieloide aguda, del 8 de Abril de 2020, de THE BOARD OF TRUSTEES OF THE LELAND STANFORD JUNIOR UNIVERSITY: Un anticuerpo monoclonal dirigido contra CD47 humano que bloquea la interacción del CD47 humano con SIRPα, para su uso en el tratamiento de la leucemia mieloide aguda […]
 Procedimientos y composiciones relacionados con los fragmentos de anticuerpos monocatenarios que se unen a la glucoproteína 72 asociada a tumor (TAG-72), del 25 de Marzo de 2020, de Ohio State Innovation Foundation: Un fragmento de anticuerpo scFv que se une específicamente a la glucoproteína 72 asociada a tumor (TAG-72), donde el fragmento de anticuerpo comprende SEQ ID NO: […]
Procedimientos y composiciones relacionados con los fragmentos de anticuerpos monocatenarios que se unen a la glucoproteína 72 asociada a tumor (TAG-72), del 25 de Marzo de 2020, de Ohio State Innovation Foundation: Un fragmento de anticuerpo scFv que se une específicamente a la glucoproteína 72 asociada a tumor (TAG-72), donde el fragmento de anticuerpo comprende SEQ ID NO: […]
Usos de anticuerpos IL-1 alfa, del 18 de Marzo de 2020, de XBIOTECH, INC: Un método para cuantificar la cantidad de IL-1α en una muestra biológica, el método comprendiendo las etapas de: (a) separar una muestra biológica […]
Andamios de biomatriz para la dispersión a escala industrial, del 11 de Marzo de 2020, de THE UNIVERSITY OF NORTH CAROLINA AT CHAPEL HILL: Un metodo para producir un andamio de biomatriz a partir de tejido biologico seleccionado del grupo que comprende: pancreas, arbol biliar y duodeno para la […]
VACUNACIÓN CON MICROVESÍCULAS DERIVADAS DE CÉLULAS TUMORALES PARA TRATAMIENTO DE CÁNCER, del 6 de Febrero de 2020, de PINEDA OLVERA, Benjamín: La presente invención se refiere a microvesículas provenientes de células tumorales naturales y producidas in vitro bajo un estímulo estresor, tal como la radiación, las […]
Inmunoterapia mediante la utilización de células capaces de co-expresar un antígeno diana y CD1d y pulsadas con un ligando de CD1d, del 8 de Enero de 2020, de RIKEN: Un método para preparar un inmunoinductor para un antígeno diana, que comprende pulsar una célula que coexpresa el antígeno diana y CD1d con un ligando de CD1d presentando […]
Inmunoterapia mediante la utilización de células capaces de co-expresar un antígeno diana y CD1d y pulsadas con un ligando de CD1d, del 8 de Enero de 2020, de RIKEN: Un inmunoinductor para un antígeno diana, que comprende una célula que co-expresa antígeno diana y CD1d, en donde el antígeno diana y la célula […]
Métodos y composiciones para la inmunoterapia contra el cáncer usando células tumorales que expresan la proteína de fusión de flagelina y antígeno asociado al tumor, del 30 de Octubre de 2019, de CORNELL UNIVERSITY (100.0%): Una composición que comprende una célula dendrítica (CD), donde dicha CD ha interiorizado una célula tumoral que expresa una proteína de fusión, […]