LECTINAS VEGETALES COMO ADYUVANTES E MUCOSAS.
Uso de una mezcla que comprende un inmunógeno y una lectina vegetal en la fabricación de un medicamento para producir una respuesta inmune hacia el inmunógeno en un mamífero,
en el que el medicamento se administra por vía mucosa y la respuesta inmune es mayor que la respuesta inmune contra el inmunógeno producido en ausencia de la lectina vegetal
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US2000/041539.
Solicitante: NOVARTIS VACCINES AND DIAGNOSTICS, INC..
Nacionalidad solicitante: Estados Unidos de América.
Dirección: 4560 HORTON STREET EMERYVILLE, CA 94608 ESTADOS UNIDOS DE AMERICA.
Inventor/es: O\'HAGAN, DEREK, LAVELLE,Edward,C.
Fecha de Publicación: .
Fecha Solicitud PCT: 26 de Octubre de 2000.
Clasificación Internacional de Patentes:
- A61K39/39 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
Clasificación PCT:
- A61K39/39 A61K 39/00 […] › caracterizados por los aditivos inmunoestimulantes, p. ej. por los adyuvantes químicos.
- A61P31/00 A61 […] › A61P ACTIVIDAD TERAPEUTICA ESPECIFICA DE COMPUESTOS QUIMICOS O DE PREPARACIONES MEDICINALES. › Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos.
- A61P31/22 A61P […] › A61P 31/00 Antiinfecciosos, es decir antibióticos, antisépticos, quimioterápicos. › para herpesvirus.
Clasificación antigua:
Países PCT: Austria, Bélgica, Suiza, Alemania, Dinamarca, España, Francia, Reino Unido, Grecia, Italia, Liechtensein, Luxemburgo, Países Bajos, Suecia, Mónaco, Portugal, Irlanda, Eslovenia, Finlandia, Rumania, Chipre, Lituania, Letonia, Ex República Yugoslava de Macedonia, Albania.
PDF original: ES-2356890_T3.pdf



Fragmento de la descripción:
CAMPO TÉCNICO DE LA INVENCIÓN
La invención se refiere al aumento de una respuesta inmune en un mamífero. Más concretamente, la invención se refiere al uso de lectinas vegetales como adyuvantes.
ANTECEDENTES DE LA INVENCIÓN 5
Debido a que la mayoría de los patógenos colonizan e invaden el huésped por la superficie de las mucosas, es lógico e interesante inducir la inmunidad en estas zonas con el fin de prevenir la infección (1). La administración de vacunas por vía mucosa es un procedimiento no invasivo y, por tanto, resulta relativamente sencillo y barato. Además, la posibilidad de provocar una serie de respuestas inmunes sistémicas y en las mucosas tras la administración de vacunas por vía mucosa posibilita la inmunización eficaz frente a muchas enfermedades. Por ejemplo, la IgA específica por sí sola 10 puede proteger a los ratones contra la infección intranasal de la gripe (2) y la infección intestinal provocada por Vibrio cholerae (3). Sin embargo, lo común es que la administración por vía mucosa de inmunógenos no replicantes no provoque respuestas inmunes potentes. Para inducir respuestas, suele ser necesaria la administración de múltiples dosis elevadas (4). Además, con frecuencia, la administración de inmunógenos por vía mucosa no provoca una reacción a nivel sistémico (1). 15
Se puede emplear una serie de estrategias para aumentar las respuestas hacia las vacunas administradas por vía mucosa. Para administrar inmunógenos, se pueden usar vectores bacterianos y virales vivos que colonicen las mucosas (5). La adopción de una forma particulada por parte de los inmunógenos mediante la asociación con micropartículas biodegradables (6) o liposomas (7) también puede aumentar la inmunogenicidad de las mucosas.
Otro enfoque consiste en usar moléculas de tipo lectina con propiedades adyuvantes. Los adyuvantes de mucosas más 20 potentes identificados hasta la fecha son la toxina del cólera producida por Vibrio cholerae (CT) y la enterotoxina lábil al calor (LT) de las cepas enterotoxigénicas de Escherichia coli (8, 9). Tanto CT como LT son inmunógenos y adyuvantes de mucosas bien caracterizados para las proteínas circundantes. Estas toxinas contienen subunidades A y B separadas (denominadas CTA y CTB, respectivamente). Las subunidades B median en la unión a los receptores de la superficie celular (20). El gangliósido GM1 es considerado el receptor principal de CT (21), pero CTB se puede unir a 25 receptores de la superficie celular distintos de GM1 (22). Tras la unión de la subunidad B, la subunidad A alcanza el citosol y activa la adenil–ciclasa conduciendo a un gran aumento de [AMPc] (10, 11). LT es estructural y funcionalmente similar a CT, y es comparable a CT como adyuvante sistémico y de mucosas (23, 24). En ratones, CT estimula considerablemente las respuestas inmunes humorales y las mediadas por células, incluyendo la producción de IgA y las funciones efectoras de las células T citotóxicas en las mucosas (10). La estimulación de respuestas locales 30 y sistémicas específicas de la toxina, así como de respuestas a inmunógenos coadministrados, distingue estas moléculas de la mayoría de las proteínas solubles, que son poco inmunogénicas cuando se administran por vía mucosa (10, 11). En cualquiera caso, la toxicidad de estas moléculas imposibilita su aplicación clínica.
Se ha investigado sobre ciertas lectinas vegetales como agentes para la dirección específica de moléculas a un epitelio mucoso. Las lectinas vegetales son proteínas que contienen al menos un dominio no catalítico que se une específica y 35 reversiblemente a un monosacárido u oligosacárido (13). Por ejemplo, Giannasca et al. (14) revela que la inmunización intranasal con un conjugado de lectina–inmunógeno estimuló la inducción de anticuerpos IgG específicos, mientras que el inmunógeno solo o mezclado con lectina no lo hizo. La patente estadounidense n.º 4.470.967 revela que un complejo de un inmunógeno de glucoproteína con una lectina puede actuar como adyuvante para aumentar la respuesta inmune contra el inmunógeno. De manera similar, el documento WO 86/06635 revela un complejo de inmunógeno–lectina 40 modificado químicamente que se puede usar para provocar una respuesta inmune en vertebrados, incluyendo mamíferos. En cada uno de estos casos, sin embargo, la lectina fue acoplada físicamente al inmunógeno. Esto requiere al menos una etapa de preparación extra y, en realidad, puede modificar un epítopo del inmunógeno contra el que se desee obtener la respuesta inmune, tal como un epítopo contra el que se pudiera dirigir una respuesta inmune neutralizante. 45
El documento US 4414201 revela el uso de abrina, una lectina aislada de las semillas de Jequirití, para la fabricación de un medicamento destinado a producir una respuesta inmune hacia un inmunógeno en un mamífero.
El documento US EP0156633 revela el uso de abrina y de ricina, una lectina aislada de la semilla de la planta del aceite de ricino, para la fabricación de un medicamento destinado a producir una respuesta inmune contra un inmunógeno en un mamífero. 50
Stein el al. (Anticancer drugs, 1997, 8:557–559) describe el estudio relativo a la inducción de anticuerpos contra la lectina de muérdago en relación con diferentes extractos de muérdago.
O'Hagan et al. (Vaccine, 1999, 17:2229–2236) describe un estudio que muestra que la inmunización intranasal con gD2 recombinante reduce la gravedad y la mortalidad de enfermedades tras un desafío genital con el virus Herpes simplex
de tipo 2 en cerdos de guinea.
Así pues, existe la necesidad en la técnica de procedimientos sencillos, eficaces y no tóxicos para aumentar las respuestas inmunes en un mamífero, particularmente, tras una administración por vía mucosa, que no impliquen la necesidad de formar un complejo con el inmunógeno y otra molécula ni de enmascarar o alterar potencialmente epítopos deseables. 5
RESUMEN DE LA INVENCIÓN
La invención proporciona un procedimiento para aumentar una respuesta inmune en un mamífero mediante la administración a un mamífero de una mezcla que comprende un inmunógeno y una lectina vegetal. De ese modo, el mamífero produce una respuesta inmune mayor que la respuesta inmune producida en ausencia de la lectina vegetal.
La invención proporciona, por tanto, un procedimiento sencillo y eficaz para aumentar una respuesta inmune en un 10 mamífero.
BREVE DESCRIPCIÓN DE LAS FIGURAS
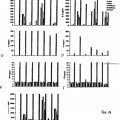
FIG. 1. Gráfico de barras que muestra los niveles totales de IgA (ng/ml) medidos en lavados nasotraqueales de ratones tras cuatro dosis intranasales de inmunógeno.
FIG. 2A–D. Gráficas que muestran el efecto adyuvante de las lectinas vegetales. Títulos de anticuerpos IgG en 15 suero específicos de OVA de ratones inmunizados intranasalmente. FIG. 2A: títulos de IgG en suero tras una dosis (día 13). FIG. 2B: títulos de IgG en suero tras dos dosis (día 27). FIG. 2C: títulos de IgG en suero tras tres dosis (día 41). FIG. 2D: títulos de IgG en suero tras la dosis final (día 56).
FIG. 3. Gráfica que muestra los títulos de anticuerpos IgG1 en suero específicos de OVA medidos en ratones inmunizados intranasalmente. 20
FIG. 4A–D. Gráficas que muestran los títulos de anticuerpos IgA específicos de OVA medidos en secreciones de ratones inmunizados intranasalmente. FIG. 4A: saliva; FIG. 4B: lavado vaginal; FIG. 4C: lavado nasotraqueal; FIG. 4D: lavado intestinal.
FIG. 5A–F. Títulos de anticuerpos IgG en suero específicos de lectinas vegetales y CT medidos en ratones inmunizados intranasalmente. FIG. 5A: CT; FIG. 5B: LEA; FIG. 5D: PHA; FIG. 5E: WGA; FIG. 5F: UEA–I. 25
FIG. 6A–D. Gráficas que muestran los títulos de anticuerpos IgG en suero específicos de gD2 de ratones inmunizados intranasalmente. FIG. 6A: día 14; FIG: 6B, día 28; FIG. 6C: día 41; FIG. 6D: día 55.
FIG. 7A–D. Gráficas que muestran los títulos de anticuerpos de las subclases de IgG en suero específicas de gD2. FIG. 7A: IgGI; FIG. 7B: IgG2a; FIG. 7C: IgG2b; FIG. 7D: IgG3.
FIG. 8A–D. Gráficas que muestran los títulos de anticuerpos IgA específicos de gD2 medidos en secreciones. FIG. 30 8A: saliva; FIG. 8B: lavado vaginal; FIG. 8C: lavado nasotraqueal; FIG. 8D: lavado intestinal.
FIG. 9. Títulos de las subclases de IgG y totales de IgG en suero específicos de gD2 de ratones... [Seguir leyendo]
Reivindicaciones:
1. Uso de una mezcla que comprende un inmunógeno y una lectina vegetal en la fabricación de un medicamento para producir una respuesta inmune hacia el inmunógeno en un mamífero, en el que el medicamento se administra por vía mucosa y la respuesta inmune es mayor que la respuesta inmune contra el inmunógeno producido en ausencia de la lectina vegetal. 5
2. El uso de la reivindicación 1, en el que el medicamento se administra mediante un procedimiento seleccionado del grupo que consiste en la administración oral, administración intranasal, administración intrarrectal y administración vaginal.
3. El uso de cualquiera de las reivindicaciones 1–2, en el que el medicamento se administra usando un vehículo de micropartículas. 10
4. El uso de cualquiera de las reivindicaciones 1–3, en el que el medicamento se administra en combinación con un polímero bioadhesivo.
5. El uso de cualquiera de las reivindicaciones anteriores, en el que la lectina vegetal se selecciona del grupo que consiste en ML–1, ML–11, ML–111, WGA y UEA–1.
6. El uso de cualquiera de las reivindicaciones 1–4, en el que la lectina vegetal es una proteína desactivadora de los 15 ribosomas de tipo 2.
7. El uso de la reivindicación 6, en el que la proteína desactivadora de los ribosomas de tipo 2 se selecciona del grupo que consiste en nigrina b, nibrina b básica, ebulina 1, ebulina r1, ebulina r, ebulina f, nigrina f, SNA1, SNA1, SNAV, SNAVI, SNLRPI de Sambucus nigra, SNLRP2, ricino, lectina de ricino, RIP Polygonatum, Sieboldina–6, abrina, abrina 11, modeccina, volkensina, SSA, Cinamonina, porrectina, gelorina, Evanthis hyemalis, RIP, aglutinina de lirio, ML–I, 20 ML–11 y ML–III.
8. El uso de cualquiera de las reivindicaciones anteriores, en el que el mamífero se selecciona del grupo que consiste en un perro, un gato, un ratón, una rata, un conejo, un cerdo de guinea, un chimpancé, un babuino y un ser humano.
9. El uso de cualquiera de las reivindicaciones anteriores, en el que la respuesta inmune es una respuesta de las células T. 25
10. El uso de la reivindicación 9, en el que la respuesta de las células T es una respuesta Th2.
11. El uso de la reivindicación 9, en el que la respuesta de las células T es una proliferación de células T.
12. El uso de cualquiera de las reivindicaciones 1–8, en el que la respuesta inmune es una respuesta de anticuerpos.
13. El uso de la reivindicación 12, en el que el mamífero produce un anticuerpo que se selecciona del grupo que consiste en anticuerpos IgG e IgA. 30
14. El uso de la reivindicación 13, en el que los anticuerpos IgG se seleccionan del grupo que consiste en IgG1, IgG2a e IgG2b.
15. El uso de cualquiera de las reivindicaciones 12–14, en el que los anticuerpos son detectables en suero.
16. El uso de cualquiera de las reivindicaciones 12–15, en el que los anticuerpos son detectables en una secreción de mucosa. 35
17. El uso de la reivindicación 16, en el que la secreción de mucosa se obtiene de una mucosa seleccionada del grupo que consiste en mucosa de aparato digestivo, mucosa vaginal, mucosa oral y mucosa nasal.
18. El uso de cualquiera de las reivindicaciones 12–17, en el que se mide el título de un anticuerpo usando un ELISA.
19. El uso de cualquiera de las reivindicaciones anteriores, en el que la mezcla comprende dos o más lectinas.
20. El uso de cualquiera de las reivindicaciones anteriores, en el que la mezcla comprende dos o más inmunógenos. 40
21. El uso de cualquiera de las reivindicaciones anteriores, en el que el inmunógeno es una proteína de un agente infeccioso.
22. El uso de la reivindicación 21, en el que el agente infeccioso es un virus.
23. El uso de la reivindicación 22, en el que el inmunógeno es una proteína glucoproteína D2 del virus Herpes simplex
de tipo 2.
24. El uso de cualquiera de las reivindicaciones 2–23, en el que el medicamento se administra usando un pulverizado nasal.
25. El uso de cualquiera de las reivindicaciones 2–23, en el que se administra una gota de un líquido que contiene el medicamento. 5
26. El uso de cualquiera de las reivindicaciones anteriores, en el que se administran al menos dos dosis del medicamento.
27. El uso de cualquiera de las reivindicaciones anteriores, en el que la mezcla comprende un inmunógeno y una lectina vegetal en una proporción de al menos 1:1.
28. El uso de la reivindicación 27, en el que la proporción es al menos 10:1. 10
Patentes similares o relacionadas:
Composición de vacuna que contiene un adyuvante sintético, del 22 de Julio de 2020, de INFECTIOUS DISEASE RESEARCH INSTITUTE: Una composición farmacéutica que comprende: un adyuvante lípido de glucopiranosilo (GLA), que tiene la fórmula: **(Ver fórmula)** en la que: […]
Métodos mejorados para la preparación de escualeno, del 15 de Julio de 2020, de NOVARTIS AG: Un procedimiento para la preparación de escualeno a partir de una composición que comprende escualeno a partir de una fuente animal, dicho procedimiento comprendiendo […]
Respuesta inmune mejorada en especies aviares, del 1 de Julio de 2020, de Bayer Intellectual Property GmbH: Una composición de inmunomodulador, en que la composición del inmunomodulador comprende: a. un vehículo catiónico de administración de liposomas; y […]
Composición farmacéutica que comprende un complejo de carga portador polimérico y al menos un antígeno proteínico o peptídico, del 1 de Julio de 2020, de CureVac AG: Composición farmacéutica que incluye: (A) un complejo de carga portador polimérico, que comprende: a) un portador polimérico que comprende componentes catiónicos reticulados […]
Formulaciones de inulina y de acetato de inulina, del 5 de Junio de 2020, de SOUTH DAKOTA STATE UNIVERSITY (100.0%): Una composición que comprende micropartículas o nanopartículas de acetato de inulina (InAc) y una molécula de carga, en la que la molécula de carga está encapsulada […]
Métodos para proporcionar virosomas con adyuvante y virosomas con adyuvante obtenibles de esta manera, del 3 de Junio de 2020, de BESTEWIL HOLDING B.V: Un método para preparar los virosomas con adyuvante, que comprende las etapas de: (i) proporcionar una composición acuosa de los virosomas sin adyuvante que comprende […]
Composición de medio para preparar toxina botulínica, del 6 de Mayo de 2020, de Daewoong Co., Ltd: Una composición de medio libre de EET para su uso en el cultivo de Clostridium botulinum, la composición de medio comprende: peptonas de origen […]
Inmunomodulación mediante inhibidores de IAP, del 6 de Mayo de 2020, de NOVARTIS AG: Una vacuna que comprende una cantidad inmunogénica de un antígeno procedente de tumor o antígeno tumoral y un adyuvante que comprende un inhibidor de IAP […]