MÉTODO Y KIT PARA EL DIAGNÓSTICO DE CELIAQUÍA.
Método y kit para el diagnóstico de celiaquía.
La presente invención se refiere a métodos y kits para el diagnóstico de la enfermedad celíaca mediante la combinación mediante un único kit de la detección de marcadores serológicos y genéticos.
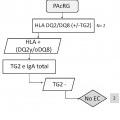
La presente invención pone de manifiesto que la presencia de anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y la ausencia de los marcadores genéticos HLA-DQ2 o -DQ8, puede indicar la presencia de la enfermedad.
Tipo: Patente de Invención. Resumen de patente/invención. Número de Solicitud: P201430567.
Solicitante: FUNDACIÓN PARA LA INVESTIGACIÓN BIOMÉDICA DEL HOSPITAL CLÍNICO SAN CARLOS.
Nacionalidad solicitante: España.
Inventor/es: NÚÑEZ PARDO DE VERA,Mª Concepción, BODAS PINEDO,Andrés, LÓPEZ PALACIOS,Natalia, DIELI CRIMI,Romina.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C12Q1/68 QUIMICA; METALURGIA. › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12Q PROCESOS DE MEDIDA, INVESTIGACION O ANALISIS EN LOS QUE INTERVIENEN ENZIMAS, ÁCIDOS NUCLEICOS O MICROORGANISMOS (ensayos inmunológicos G01N 33/53 ); COMPOSICIONES O PAPELES REACTIVOS PARA ESTE FIN; PROCESOS PARA PREPARAR ESTAS COMPOSICIONES; PROCESOS DE CONTROL SENSIBLES A LAS CONDICIONES DEL MEDIO EN LOS PROCESOS MICROBIOLOGICOS O ENZIMOLOGICOS. › C12Q 1/00 Procesos de medida, investigación o análisis en los que intervienen enzimas, ácidos nucleicos o microorganismos (aparatos de medida, investigación o análisis con medios de medida o detección de las condiciones del medio, p. ej. contadores de colonias, C12M 1/34 ); Composiciones para este fin; Procesos para preparar estas composiciones. › en los que intervienen ácidos nucleicos.
PDF original: ES-2548653_A2.pdf
Fragmento de la descripción:
La presente invención se refiere a métodos y kits para el diagnóstico y/o seguimiento de la enfermedad celíaca. Por lo tanto la presente invención se engloba dentro del campo técnico de la medicina, específicamente en el campo técnico del diagnóstico clínico y más específicamente en el diagnóstico de pacientes que padecen celiaquía.
ESTADO DE LA TÉCNICA
La enfermedad celíaca (EC) afecta aproximadamente al 1% de la población mundial, aunque existen diferencias dependiendo de las poblaciones. En España se estima que su frecuencia oscila entre 1/71 en la población infantil y 1/357 en la población adulta.
Además, la frecuencia de la enfermedad es mayor en familiares de pacientes celíacos e individuos con determinadas patologías, como diabetes mellitus tipo I, tiroiditis autoinmune, deficiencia de IgA, síndrome de Down, síndrome de Turner o síndrome de Williams, los cuales constituyen los grupos de riesgo.
La enfermedad celíaca es una enfermedad crónica, por tanto la falta de diagnóstico implica la visita reiterada de estos pacientes a las consultas hospitalarias, principalmente a las consultas de Pediatría y Digestivo, pero también pueden acudir simultáneamente a diversos especialistas puesto que la sintomatología clínica es a menudo inespecífica, sobre todo en individuos adultos. Si consideramos que esta enfermedad afecta a un elevado número de niños, el coste sanitario que pueden ocasionar a lo largo de su vida es muy elevado. Hay que tener en cuenta que la enfermedad celíaca tiene un tratamiento que resulta eficaz en la gran mayoría de los casos y consiste en eliminar el gluten de la dieta, por lo cual una vez diagnosticados ya no suponen un coste sanitario, salvo por los controles de seguimiento que puedan necesitar.
En 2012, la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátrica (ESPGHAN) propuso unas nuevas guías para el diagnóstico de la enfermedad celíaca en niños y adolescentes (Husby S, et al. J Pediatr Gastroenterol 35 Nutr 2012;54:136-60) . La definición de la enfermedad también se revisó y la EC pasó a ser considerada un trastorno sistémico, debido a su gran variabilidad de
manifestaciones clínicas, muchas de ellas extra-intestinales. Esta variabilidad clínica implica la necesidad de unas herramientas de diagnóstico altamente específicas y sensibles.
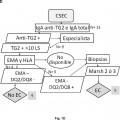
En la actualidad el diagnóstico de la enfermedad celíaca implica en la gran mayoría de los casos la realización de tres tipos de pruebas. Dos de ellas (pruebas serológicas y genéticas) están encaminadas a seleccionar al grupo de individuos que pueden padecer la enfermedad y que por tanto requieren la realización de la tercera prueba (biopsia duodenal) , que es la que ofrece el diagnóstico definitivo. Sin embargo, dada la agresividad de dicha prueba, los tests serológicos y genéticos se emplean como pruebas de cribado previas, de manera que con resultados negativos en estas pruebas se puede llegar a descartar el diagnóstico de enfermedad celíaca sin la realización de la biopsia intestinal. Las pruebas diagnósticas se llevan a cabo por diferentes técnicas y requieren diferentes aparatos y/o ensayos comerciales. A pesar de que actualmente existen algoritmos diagnósticos basados en los resultados de estas pruebas, se considera que sólo una pequeña parte de los pacientes son diagnosticados correctamente. El diagnóstico de la enfermedad tiene una repercusión inmediata en el paciente puesto que tras el inicio del tratamiento (dieta sin gluten) cesan los síntomas y el paciente recupera una vida normal en la gran mayoría de los casos.
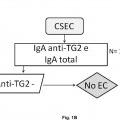
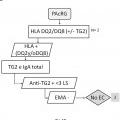
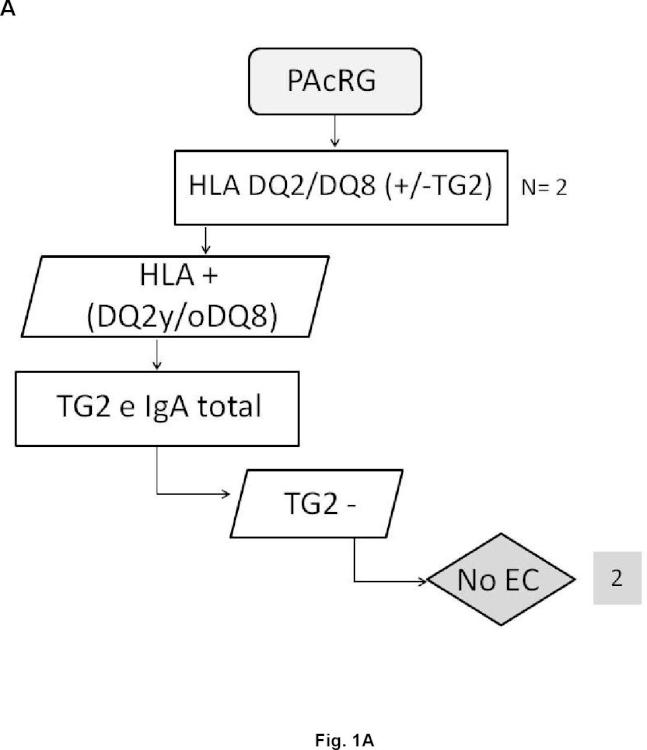
En este sentido, la presencia de anticuerpos específicos frente a transglutaminasa tisular tipo 2 (TG2) , frente a endomisio (EMA) y frente a péptidos deamidados de gliadina (PDG) , detectados mediante kits específicos para ello, junto con la presencia de los haplotipos HLA (antígenos de leucocitos humanos) -DQ2 o -DQ8, detectados mediante sondas y primers específicos detectados de manera independiente de los marcadores serológicos, definen al grupo de pacientes que padece EC, cuando coexiste con una combinación variable de manifestaciones clínicas y enteropatía dependientes de gluten. En la práctica clínica habitual, existe una elevada disponibilidad de tests serológicos para el diagnóstico de EC. Sin embargo, la sensibilidad y especificidad de los mismos se basa principalmente en los anticuerpos concretos que comprenden dichos kits, así como en el propio kit comercial empleado para dicho diagnóstico. Así, es conocido que los anticuerpos anti-TG2 y anti-EMA, ambos dirigidos frente al enzima TG2, son los más específicos para el diagnóstico de EC. La especificidad de los anti-EMA es superior, pero puesto que su determinación se lleva a cabo por inmunofluorescencia indirecta, la cual es una técnica laboriosa y subjetiva de interpretar por personal no experto, en la práctica clínica habitual, se
recomienda testar en primer lugar la presencia de anticuerpos anti-TG2 y, a continuación, confirmar los resultados positivos para la presencia de anticuerpos anti-EMA. Además, también se utiliza la determinación de anticuerpos anti-PDG. La correlación de anticuerpos anti-TG2 y EMA es muy alta, pero puede disminuir cuando se emplean kits comerciales que detectan neoepítopos que emergen tras la reacción de entrecruzamiento entre TG2 y PDG. Entre los kits comerciales capaces de detectar los neoepítopos destacan, el kit Aeskulisa® tTg-A (Aesku.Diagnostics, Wendelsheim, Alemania) , el kit Aeskulisa® CeliCheck (Aesku.Diagnostics, Wendelshiem, Germany) y el kit Quanta Lite® tTG-DGP screen (Inova Diagnostics, Inc, CA, USA) .
Por otro lado, en la actualidad se considera que la práctica totalidad de enfermos celíacos presentan los alelos que codifican las moléculas HLA-DQ2 o -DQ8. Además, dependiendo del número de alelos y de qué alelos precisos estén presentes en los sujetos, el riesgo de padecer la enfermedad varía. En este sentido, la ausencia de los alelos que codifican HLA-DQ2 o -DQ8 excluye o hace muy poco posible la presencia de EC. La molécula DQ2 está codificada por la presencia conjunta de los alelos DQA1*05 y DQB1*02 y la molécula DQ8 por la presencia conjunta de los alelos DQA1*03 y DQB1*03:02. Además, se cree que el alelo DQB1*02 presente de forma aislada también confiere riesgo, aunque bajo. La ausencia de esos alelos, en las combinaciones descritas, prácticamente descarta la enfermedad.
El uso de kits comerciales para la detección de los marcadores serológicos que incluyen la detección de neoepítopos que surgen tras la unión TG2-PDG, pone de manifiesto que existen casos de individuos que son positivos para estos marcadores y 25 negativos para anti-EMA (no presentan anticuerpos frente a EMA) , por lo que siguiendo los actuales criterios diagnósticos se consideraría que no presentan celiaquía y que su dolencia sería debida a otra patología diferente. Sin embargo, los inventores ponen de manifiesto que existen casos de sujetos que padecen EC dentro de este grupo de pacientes (TG2+ y EMA-) , pero que son diagnosticados, a priori, 30 como sujetos que no padecen la enfermedad, es decir, muchos de ellos se diagnostican erróneamente, ya que de hecho, sí que padecen la enfermedad. Además, los inventores también ponen de manifiesto que algunos enfermos que presentan anticuerpos detectados mediante el kit comercial Aeskulisa® tTg-A, que detecta la formación de neoepítopos, pero carecen de anticuerpos anti-EMA, muestran unas 35 características genéticas particulares que no se adecúan a las comúnmente presentes en los enfermos que padecen celiaquía, es decir, no presentan los marcadores
genéticos, HLA-DQ2 o HLA-DQ8, ya que un 33% de dichos pacientes carecen de moléculas HLA-DQ2/DQ8 completas, es decir, presentan sólo uno o ninguno de los alelos necesarios para la formación de dichas moléculas.
Por lo tanto, teniendo en cuenta todo lo anteriormente mencionado, existe un grupo de pacientes celíacos que, a día de hoy, utilizando las guías diagnósticas y la mayoría de los métodos o kits comerciales existentes en el mercado, tienen muy complicado recibir un correcto diagnóstico ya que no presentan los criterios comúnmente establecidos para el diagnóstico de la enfermedad mediante las pruebas serológicas (anti-TG2 y anti-EMA) y genéticas (HLA-DQ2 o -DQ8) . Especialmente, hay que tener en cuenta que la ausencia de anticuerpos frente a EMA se considera bastante indicativo de la ausencia de la enfermedad celíaca. Además, los principales alelos de riesgo genético que codifican para HLA-DQ2 o HLA-DQ8, no aparecen a la misma frecuencia de la científicamente reconocida como característica para los enfermos que padecen celiaquía, lo cual contribuye a dificultar más el... [Seguir leyendo]
Reivindicaciones:
1. Método de obtención de datos útiles para el diagnóstico de celiaquía en una muestra biológica aislada de un sujeto que comprende la detección y/o cuantificación simultánea de marcadores serológicos y genéticos, donde los marcadores serológicos son: anticuerpos frente a transglutaminasa tipo 2, anticuerpos frente a péptidos deamidados de gliadina y anticuerpos frente a neoepítopos que surgen de la unión y/o entrecruzamiento del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina, y donde el marcador genético es HLA-DQ.
2. Método de obtención de datos útiles según la reivindicación 1 caracterizado por que el marcador genético HLA-DQ se selecciona de entre: HLA-DQ2 o HLA-DQ8.
3. Método de obtención de datos útiles según la reivindicación 2 caracterizado por que el marcador genético HLA-DQ2 está codificado por la presencia conjunta de los alelos: DQA1*05 y DQB1*02.
4. Método de obtención de datos útiles según la reivindicación 3 caracterizado por que el alelo DQA1*05 se selecciona entre DQA1*05:01 y DQA1*05:05 y el alelo DQB1*02 se selecciona entre DQB1*02:01 y DQB1*02:02.
5. Método de obtención de datos útiles según las reivindicaciones 2 a 4 caracterizado por que el marcador genético HLA-DQ2 está codificado por al menos uno de los alelos DQA1*05:01 o DQA1*05:05 junto con al menos uno de los alelos DQB1*02:01 o DQB1*02:02.
6. Método de obtención de datos útiles según la reivindicación 2 caracterizado por que el marcador genético HLA-DQ8 está codificado por la presencia conjunta de los alelos DQA1*03 y DQB1*03:02.
7. Método de obtención de datos útiles según la reivindicación 6 caracterizado por que el alelo DQA1*03 se selecciona entre: DQA1*03:01 y DQA1*03:02.
8. Método de obtención de datos útiles según las reivindicaciones 6 a 7 caracterizado por que el marcador genético HLA-DQ8 está codificado por al menos uno de los alelos DQA1*03:01 o DQA1*03:02 junto con la presencia del alelo DQB1*03:02.
9. Método de obtención de datos útiles según cualquiera de las reivindicaciones 2 a 8 caracterizado por que la detección de anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y la ausencia de los alelos que codifican para los marcadores genéticos HLA-DQ2 o HLA-DQ8 clasifica al sujeto en un grupo de riesgo genético determinado de padecer celiaquía.
10. Método de obtención de datos útiles según la reivindicación 9 caracterizado por que el sujeto se clasifica como de alto riesgo genético cuando se detectan anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y uno o dos alelos DQA1*05 y dos alelos DQB1*02.
11. Método de obtención de datos útiles según la reivindicación 9 caracterizado por que el sujeto se clasifica como de riesgo genético moderado cuando se detectan anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y un alelo DQA1*05 y un alelo DQB1*02.
12. Método de obtención de datos útiles según la reivindicación 9 caracterizado por que el sujeto se clasifica como de bajo riesgo genético cuando se detectan anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y cualquier combinación de alelos en DQA1 y DQB1, diferente a las combinaciones descritas en las reivindicaciones 9 y 10.
13. Método de obtención de datos útiles según la reivindicación 12 caracterizado por que el sujeto clasificado en el grupo de riesgo genético bajo, tiene mayor riesgo genético de padecer celiaquía si presenta el alelo DQA1*05 en ausencia del alelo DQB1*02 que si presenta cualquier otra combinación posible de alelos dentro de la categoría de bajo riesgo genético.
14. Método de obtención de datos útiles según cualquiera de las reivindicaciones 2 a 8 donde la detección de anticuerpos frente a transglutaminasa tipo 2 y la presencia de al menos uno de los marcadores genéticos HLA-DQ2 o HLA-DQ8 clasifica al sujeto en un grupo de riesgo genético determinado de padecer celiaquía.
15. Método de obtención de datos útiles según la reivindicación 14 caracterizado por que el sujeto se clasifica como de riesgo genético muy alto de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y uno
o dos alelos DQA1*05 y dos alelos DQB1*02.
16. Método de obtención de datos útiles según la reivindicación 14 caracterizado por que el sujeto se clasifica como de riesgo genético alto de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y un alelo DQA1*05 y un alelo DQB1*02.
17. Método de obtención de datos útiles según la reivindicación 14 caracterizado por que el sujeto se clasifica como de riesgo genético moderado de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y uno
o dos alelos DQA1*03 y uno o dos alelos DQB1*03:02.
18. Método de obtención de datos útiles según la reivindicación 14 caracterizado por que el sujeto se clasifica como de riesgo genético bajo de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y uno o dos alelos DQB1*02 y ningún alelo DQA1*05.
19. Método de obtención de datos útiles según cualquiera de las reivindicaciones 2 a 8 donde la detección de anticuerpos frente a péptidos deamidados de gliadina y la presencia de al menos uno de los marcadores genéticos HLA-DQ2 o HLA-DQ8 clasifica al sujeto en un grupo de riesgo genético determinado de padecer celiaquía.
20. Método de obtención de datos útiles según la reivindicación 19 caracterizado por que el sujeto se clasifica como de muy alto riesgo genético de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y uno o dos alelos DQA1*05 y dos alelos DQB1*02.
21. Método de obtención de datos útiles según la reivindicación 19 caracterizado por que el sujeto se clasifica como de alto riesgo genético de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y un alelo DQA1*05 y un alelo DQB1*02.
22. Método de obtención de datos útiles según la reivindicación 19 caracterizado por que el sujeto se clasifica como de riesgo genético moderado de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y uno o dos alelos DQA1*03 y uno o dos alelos DQB1*03:02.
23. Método de obtención de datos útiles según la reivindicación 19 caracterizado por que el sujeto se clasifica como de riesgo genético bajo de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y uno o dos alelos DQB1*02 y ningún alelo DQA1*05.
24. Método de obtención de datos útiles según cualquiera de las reivindicaciones 1 a 23 caracterizado por que comprende además la detección y/o cuantificación de al menos un marcador de atrofia intestinal.
25. Método de obtención de datos útiles según la reivindicación 24 caracterizado por que el marcador de atrofia intestinal es la proteína REG1A.
26. Método de obtención de datos útiles según cualquiera de las reivindicaciones 1 a 25 caracterizado por que los anticuerpos detectados presentan isotipo A (IgA) o G (IgG) .
27. Método de obtención de datos útiles según cualquiera de las reivindicaciones 1 a 26 caracterizado por que la detección de los marcadores serológicos se realiza mediante un inmunoensayo y la detección de los marcadores genéticos mediante la técnica PCR.
28. Método de obtención de datos útiles según la reivindicación 27 donde la detección de los marcadores serológicos y genéticos se determina mediante la tecnología Luminex.
29. Método de obtención de datos útiles según cualquiera de las reivindicaciones 1 a 28 caracterizado por que la muestra biológica aislada se selecciona entre saliva, sangre o suero.
30. Método de obtención de datos útiles según la reivindicación 29 caracterizado por que la sangre es sangre periférica.
31. Método de obtención de datos útiles según cualquiera de las reivindicaciones 1 a 30 caracterizado por que el sujeto es humano.
32. Método in vitro para el diagnóstico de celiaquía en un sujeto que comprende:
a) la detección y/o cuantificación simultánea de marcadores serológicos y genéticos donde los marcadores serológicos son: anticuerpos frente a transglutaminasa tipo 2, anticuerpos frente a péptidos deamidados de gliadina y anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina, y el marcador genético es HLA-DQ, en una muestra biológica aislada de un sujeto; y
b) la asociación de la detección de los marcadores serológicos y genéticos obtenida en el paso a) con un riesgo genético determinado de padecer la enfermedad.
33. Método in vitro según la reivindicación 32 caracterizado por que el marcador genético HLA-DQ se seleccionan entre: HLA-DQ2 o HLA-DQ8.
34. Método in vitro según la reivindicación 33 caracterizado por que el marcador genético HLA-DQ2 está codificado por la presencia conjunta de los alelos: DQA1*05 y DQB1*02.
35. Método in vitro según la reivindicación 34 caracterizado por que el alelo DQA1*05 se selecciona entre DQA1*05:01 y DQA1*05:05 y el alelo DQB1*02 se selecciona entre DQB1*02:01 y DQB1*02:02.
36. Método in vitro según cualquiera de las reivindicaciones 33 a 35 caracterizado por que el marcador genético HLA-DQ2 está codificado por al menos uno de los alelos DQA1*05:01 o DQA1*05:05 junto con al menos uno de los alelos DQB1*02:01 o DQB1*02:02.
37. Método in vitro según la reivindicación 33 caracterizado por que el marcador genético HLA-DQ8 está codificado por la presencia conjunta de los alelos DQA1*03 y DQB1*03:02.
38. Método in vitro según la reivindicación 37 caracterizado por que el alelo DQA1*03 se selecciona entre: DQA1*03:01 y DQA1*03:02.
39. Método in vitro según cualquiera de las reivindicaciones 37 a 38 caracterizado por que el marcador genético HLA-DQ8 está codificado por al menos uno de los alelos DQA1*03:01 o DQA1*03:02 junto con la presencia del alelo DQB1*03:02.
40. Método in vitro según cualquiera de las reivindicaciones 33 a 39 caracterizado por que la detección de anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y la ausencia de los marcadores genéticos HLA-DQ2 o HLA-DQ8 clasifica al sujeto en un grupo de riesgo genético determinado de padecer celiaquía.
41. Método in vitro según la reivindicación 40 caracterizado por que el sujeto se clasifica como de alto riesgo genético cuando se detectan anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y uno o dos alelos DQA1*05 y dos alelos DQB1*02.
42. Método in vitro según la reivindicación 40 caracterizado por que el sujeto se clasifica como de riesgo genético moderado cuando se detectan anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2péptidos deamidados de gliadina y un alelo DQA1*05 y un alelo DQB1*02.
43. Método in vitro según la reivindicación 40 caracterizado por que el sujeto se clasifica como de bajo riesgo genético cuando se detectan anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina y cualquier combinación de alelos en DQA1 y DQB1 diferente a las combinaciones descritas en las reivindicaciones 29 y 30.
44. Método in vitro según la reivindicación 43 caracterizado por que el sujeto clasificado en el grupo de riesgo genético bajo, tiene mayor riesgo genético de padecer celiaquía si presenta el alelo DQA1*05 en ausencia del alelo DQB1*02 que si presenta cualquier otra combinación posible de alelos dentro de la categoría de riesgo genético bajo.
45. Método in vitro según cualquiera de las reivindicaciones 33 a 39 donde la detección de anticuerpos frente a transglutaminasa tipo 2 y la presencia de al menos uno de
los marcadores genéticos HLA-DQ2 o HLA-DQ8 clasifica al sujeto en un grupo de riesgo genético determinado de padecer celiaquía.
46. Método in vitro según la reivindicación 45 caracterizado por que el sujeto se clasifica como riesgo genético muy alto de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y uno o dos alelos DQA1*05 y dos alelos DQB1*02.
47. Método in vitro según la reivindicación 45 caracterizado por que el sujeto se clasifica como de riesgo genético alto de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y un alelo DQA1*05 y un alelo DQB1*02.
48. Método in vitro según la reivindicación 45 caracterizado por que el sujeto se clasifica como de riesgo genético moderado de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y uno o dos alelos DQA1*03 y uno o dos alelos DQB1*03:02.
49. Método in vitro según la reivindicación 45 caracterizado por que el sujeto se clasifica como de riesgo genético bajo de padecer la enfermedad cuando se detectan anticuerpos frente a transglutaminasa tipo 2 y uno o dos alelos DQB1*02 y ningún alelo DQA1*05.
50. Método in vitro según cualquiera de las reivindicaciones 33 a 39 donde la detección de anticuerpos frente a péptidos deamidados de gliadina y la presencia de al menos uno de los marcadores genéticos HLA-DQ2 o HLA-DQ8 clasifica al sujeto en un grupo de riesgo genético determinado de padecer celiaquía.
51. Método in vitro según la reivindicación 50 caracterizado por que el sujeto se clasifica como de muy alto riesgo genético de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y uno o dos alelos DQA1*05 y dos alelos DQB1*02.
52. Método in vitro según la reivindicación 50 caracterizado por que el sujeto se clasifica como de alto riesgo genético de padecer la enfermedad cuando se
detectan anticuerpos frente a péptidos deamidados de gliadina y un alelo DQA1*05 y un alelo DQB1*02.
53. Método in vitro según la reivindicación 50 caracterizado por que el sujeto se clasifica como de riesgo genético moderado de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y uno o dos alelos DQA1*03 y uno o dos alelos DQB1*03:02.
54. Método in vitro según la reivindicación 50 caracterizado por que el sujeto se clasifica como de riesgo genético bajo de padecer la enfermedad cuando se detectan anticuerpos frente a péptidos deamidados de gliadina y uno o dos alelos DQB1*02 y ningún alelo DQA1*05.
55. Método in vitro según cualquiera de las reivindicaciones 32 a 54 caracterizado por que comprende además la detección y/o cuantificación de al menos un marcador de atrofia intestinal.
56. Método de obtención de datos útiles según la reivindicación 55 caracterizado por que el marcador de atrofia intestinal es la proteína REG1A.
57. Método in vitro según cualquiera de las reivindicaciones 32 a 56 caracterizado por que los anticuerpos detectados presentan isotipo A (IgA) o G (IgG) .
58. Método in vitro según cualquiera de las reivindicaciones 32 a 56 caracterizado por que la detección de los marcadores serológicos se realiza mediante un inmunoensayo y la detección de los marcadores genéticos se realiza mediante PCR.
59. Método in vitro según la reivindicación 58 donde la detección de los marcadores serológicos y genéticos se determina mediante la tecnología Luminex.
60. Método in vitro según cualquiera de las reivindicaciones 32 a 59 caracterizado porque la muestra biológica aislada se selecciona entre saliva, sangre o suero.
61. Método in vitro según la reivindicación 60 caracterizado porque la sangre es sangre periférica.
62. Método in vitro según cualquiera de las reivindicaciones 32 a 61 caracterizado por que el sujeto es humano.
63. Kit que comprende anticuerpos y/o sondas específicos capaces de detectar y/o cuantificar marcadores serológicos y genéticos, donde los marcadores serológicos son: anticuerpos frente a transglutaminasa tipo 2, anticuerpos frente a péptidos deamidados de gliadina y anticuerpos frente a neoepítopos que surgen de la unión del complejo transglutaminasa tipo 2-péptidos deamidados de gliadina, y el marcador genético es HLA-DQ.
64. Kit según la reivindicación 63 caracterizado por que el marcador genético HLA-DQ se selecciona entre: HLA-DQ2 o HLA-DQ8.
65. Kit según la reivindicación 64 caracterizado por que el marcador genético HLA-DQ2 se detecta mediante sondas específicas que detectan los alelos: DQA1*05 y DQB1*02.
66. Kit según la reivindicación 65 caracterizado por que las sondas específicas detectan cualquiera de los alelos DQA1*05:01, DQA1*05:05, DQB1*02:01 y DQB1*02:02.
67. Kit según la reivindicación 64 caracterizado por que el marcador genético HLA-DQ8 se detecta mediante sondas específicas que detectan los alelos: DQA1*03 y DQB1*03:02.
68. Kit según la reivindicación 67 caracterizado por que las sondas específicas detectan cualquiera de los alelos: DQA1*03:01, DQA1*03:02 y DQB1*03:02.
69. Kit según cualquiera de las reivindicaciones 63 a 68 caracterizado por que comprende además anticuerpos capaces de detectar marcadores de atrofia intestinal.
70. Kit según la reivindicación 69 caracterizado por que el marcador de atrofia intestinal es la proteína REG1A.
71. Kit según cualquiera de las reivindicaciones 63 a 70 caracterizado por que los anticuerpos detectados presentan isotipo A (IgA) o G (IgG) .
72. Kit según cualquiera de las reivindicaciones 63 a 71 caracterizado por que los marcadores serológicos y genéticos son detectados en una muestra biológica aislada de un sujeto.
73. Kit según la reivindicación 72 caracterizado por que la muestra biológica se selecciona entre saliva, sangre o suero.
74. Kit según la reivindicación 73 caracterizado porque la sangre es sangre periférica.
75. Kit según cualquiera de las reivindicaciones 63 a 74 caracterizado por que el sujeto es humano.
76. Uso del kit según cualquiera de las reivindicaciones 63 a 75 para el diagnóstico in vitro de celiaquía en un sujeto. 15
77. Uso del kit según la reivindicación 76 donde el sujeto es humano.
A
Fig. 1A
B
Fig. 1B
Fig. 1C
D
Fig. 1D
E
Fig. 1E
Patentes similares o relacionadas:
Método para analizar ácido nucleico molde, método para analizar sustancia objetivo, kit de análisis para ácido nucleico molde o sustancia objetivo y analizador para ácido nucleico molde o sustancia objetivo, del 29 de Julio de 2020, de Kabushiki Kaisha DNAFORM: Un método para analizar un ácido nucleico molde, que comprende las etapas de: fraccionar una muestra que comprende un ácido nucleico molde […]
MÉTODOS PARA EL DIAGNÓSTICO DE ENFERMOS ATÓPICOS SENSIBLES A COMPONENTES ALERGÉNICOS DEL POLEN DE OLEA EUROPAEA (OLIVO), del 23 de Julio de 2020, de SERVICIO ANDALUZ DE SALUD: Biomarcadores y método para el diagnostico, estratificación, seguimiento y pronostico de la evolución de la enfermedad alérgica a polen del olivo, kit […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Secuenciación dirigida y filtrado de UID, del 15 de Julio de 2020, de F. HOFFMANN-LA ROCHE AG: Un procedimiento para generar una biblioteca de polinucleótidos que comprende: (a) generar una primera secuencia del complemento (CS) de un polinucleótido diana a partir […]
Métodos para la recopilación, estabilización y conservación de muestras, del 8 de Julio de 2020, de Drawbridge Health, Inc: Un método para estabilizar uno o más componentes biológicos de una muestra biológica de un sujeto, comprendiendo el método obtener un […]
Evento de maíz DP-004114-3 y métodos para la detección del mismo, del 1 de Julio de 2020, de PIONEER HI-BRED INTERNATIONAL, INC.: Un amplicón que consiste en la secuencia de ácido nucleico de la SEQ ID NO: 32 o el complemento de longitud completa del mismo.
Composiciones para modular la expresión de SOD-1, del 24 de Junio de 2020, de Biogen MA Inc: Un compuesto antisentido según la siguiente fórmula: mCes Aeo Ges Geo Aes Tds Ads mCds Ads Tds Tds Tds mCds Tds Ads mCeo Aes Geo mCes Te (secuencia […]
Aislamiento de ácidos nucleicos, del 24 de Junio de 2020, de REVOLUGEN LIMITED: Un método de aislamiento de ácidos nucleicos que comprenden ADN de material biológico, comprendiendo el método las etapas que consisten en: (i) efectuar un lisado […]