Inmunoquinasas.
Complejo endogeno soluble sintetico formado a partir de por lo menos un componente A y de por lo menos uncomponente B que se acoplan quimicamente o se fusionan geneticamente el uno al otro,
de manera que elcomponente A comprende anticuerpos como dominio de union para las estructuras de superficie extracelulares quese internalizan tras la union del componente A de dicho complejo, y quinasas que promueven la muerte, queconsisten en la proteina quinasa asociada a la muerte (DAP-quinasa, DAPk) o la quinasa del factor 2 de elongacioneucariota (eEF-2k) como componente B, que tiene una actividad quinasa catalitica constitutiva y realiza labiosintesis/senalizacion celular que incluye la muerte celular despues de la internalizacion.
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2005/050131.
Solicitante: FRAUNHOFER-GESELLSCHAFT ZUR FORDERUNG DER ANGEWANDTEN FORSCHUNG E.V..
Nacionalidad solicitante: Alemania.
Dirección: HANSASTRASSE 27C 80686 MUNCHEN ALEMANIA.
Inventor/es: FISCHER, RAINER, BARTH, STEFAN, TUR,Mehmet Kemal, STÖCKER,Michael.
Fecha de Publicación: .
Clasificación Internacional de Patentes:
- C07K19/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Péptidos híbridos (Inmoglobulinas híbridas compuestas solamente de inmoglobulinas C07K 16/46).
- C12N15/62 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › Secuencias de ADN que codifican proteínas de fusión.
- C12N9/12 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › transfieren grupos que contienen fósforo, p. ej. Quinasas (2.7).
PDF original: ES-2384940_T3.pdf
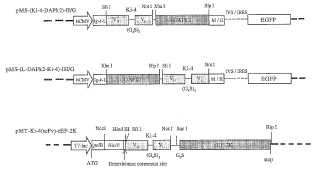
Fragmento de la descripción:
Inmunoquinasas La presente invención se refiere a un complejo endógeno soluble sintético formado a partir de por lo menos un componente A y de por lo menos un componente B, de manera que el componente A comprende un dominio de unión para las estructuras de superficie extracelulares que se internalizan tras la unión del componente A de dicho complejo, y el componente B tiene una actividad quinasa catalítica constitutiva y realiza la biosíntesis/señalización celular que incluye la muerte celular después de la internalización a través de la fosforilación. La presente invención se refiere también a ácidos nucleicos y/o a vectores que codifican para tal complejo. La presente invención proporciona además un método para influir en el crecimiento celular y/o en la fisiología de las células a las que han sido dirigidos dicho complejo, dichos ácidos nucleicos o dichos vectores. La invención se refiere adicionalmente a células o líneas celulares u organismos no humanos, tales como plantas, que incluyen algas y/o microorganismos, que incluyen levaduras y hongos, que producen el complejo de la presente invención. La presente invención tiene que ver también con un kit que comprende dicho complejo, dichos ácidos nucleicos, dichos vectores y/o dichas células. La presente invención se refiere al uso de dicho complejo, dichos ácidos nucleicos o vectores, dichas células o dicho kit para la fabricación de un medicamento para el tratamiento de las enfermedades proliferativas, las alergias, las enfermedades autoinmunes y/o la inflamación crónica. La presente invención se refiere adicionalmente al uso de dicho complejo, dichos ácidos nucleicos o vectores, dichas células y/o dicho kit para la modulación selectiva de las vías de señalización celular, a fin de realizar la expresión génica, y/o la viabilidad de la célula diana de una manera terapéutica. La invención se refiere adicionalmente a un medicamento que comprende dicho complejo, dichos ácidos nucleicos, dichos vectores, dichas células o dichos organismos. Además, los complejos, ácidos nucleicos, vectores, células y kits de la presente invención pueden utilizarse en ensayos diagnósticos, analíticos y de pronóstico de quinasas.
Antecedentes de la invención
Los medicamentos actualmente disponibles para las enfermedades proliferativas, tales como los agentes quimioterapéuticos, tienen la desventaja de inducir efectos secundarios considerables debido a su relativa falta de especificidad. Se ha intentado moderar éstos mediante diversos conceptos terapéuticos. Un enfoque potencial es el uso de agentes inmunoterapéuticos para aumentar la especificidad de la medicación. Este enfoque ha resultado especialmente útil para el tratamiento de tumores.
Un tipo de agente inmunoterapéutico son las inmunotoxinas. Una inmunotoxina comprende un anticuerpo monoclonal (AcMo) o un fragmento de anticuerpo recombinante con una afinidad específica para los marcadores de superficie de las células diana, que se acopla a un reactivo citotóxico. Los agentes citotóxicos se seleccionan de entre toxinas o elementos radiactivos. Un agente inmunoterapéutico en el que el agente citotóxico es un elemento radiactivo se denomina radioinmunoconjugado. Se han utilizado inmunotoxinas e radioinmunoconjugados para el tratamiento del cáncer.
Otro tipo de agente inmunoterapéutico son los anti-inmunoconjugados. Un anti-inmunoconjugado comprende una estructura relevante para la patogénesis o un fragmento del mismo, que se acopla a un componente de la toxina. Los anti-inmunoconjugados se utilizan para el tratamiento de las enfermedades autoinmunes, las reacciones tisulares o las alergias.
45 Cuando se utilizaban AcMo anti células B marcados radiactivamente con los linfomas celulares, pudieron observarse regresiones tumorales e incluso regresiones completas (1) . Por el contrario, los resultados con AcMo frente a los tumores sólidos fueron bastante decepcionantes. Parece ser que el tamaño relativamente grande de las ITs utilizadas en estos estudios interfería con su capacidad de penetración tumoral, y las convertían en agentes terapéuticos ineficaces. La baja tasa de penetración tumoral planteaba un reto especial para los tumores pobremente vascularizados. A fin de obtener una mejor penetración tumoral y tisular y en general mejores propiedades de difusión, se miniaturizaron las ITs. Se especulaba también que estas ITs más pequeñas serían menos inmunogénicas debido al tamaño reducido de los determinantes antigénicos (2) . Por lo tanto se conjugaron fragmentos de anticuerpos escindidos proteolíticamente (miniaturizados) con las funciones efectoras anteriormente 55 mencionadas (elementos radiactivos o toxinas) .
Las técnicas mejoradas de clonación permitieron preparar ITs completamente recombinantes: las regiones codificadoras de las regiones variables de la cadena ligera y pesada de las inmunoglobulinas, amplificados por la reacción en cadena de la polimerasa, se unen entre sí mediante un conector sintético (por ejemplo, (Gly4Ser) 3) (SEC ID Nº: 7) . A continuación, el fragmento monocatenario de genes de región variable (scFv) resultante se fusiona genéticamente a una región codificadora de una enzima catalíticamente activa que incluye polipéptidos o proteínas citotóxicamente activas (3) .
Las citotoxinas peptídicas, que han sido principalmente utilizadas hasta la fecha y por lo tanto las mejor 65 caracterizadas, son las toxinas bacterianas toxina de la difteria (DT) , exotoxina A de Pseudomonas, (PE) y el derivado de plantas ricina A (4) . El mecanismo de la actividad citotóxica es básicamente el mismo en todas estas toxinas a pesar de sus diferentes antecedentes evolutivos. El dominio catalítico inhibe la biosíntesis de proteínas mediante la modificación directa del factor de elongación 2 (EF-2) , que es importante para la traducción, o mediante la inactivación del sitio de unión a EF-2 en la subunidad 28S del ARNr de los ribosomas.
En la mayoría de las construcciones empleadas hasta la fecha, la aplicación sistémica de inmunotoxinas da como resultado efectos secundarios más o menos graves. Además del síndrome de "fuga vascular", también se produce trombocitopenia, hemólisis, insuficiencia renal y náuseas, dependiendo de la construcción empleada y de la dosis aplicada (4) . También se observó daño hepático dependiente de la dosis (5) . Además de los efectos secundarios documentados, la inmunogenicidad de las construcciones es uno de los problemas clave de la inmunoterapia. Esto se aplica, en concreto, a la defensa humoral frente a los dominios catalíticos empleados, tales como ricina (HARA) , PE, o DT (2) . Teóricamente, todas las estructuras no humanas pueden provocar una respuesta inmunológica. Por lo tanto, la administración repetida de inmunotoxinas e inmunoconjugados es limitada. Una consecuencia lógica de estos problemas es el desarrollo de inmunotoxinas humanas.
Hasta la fecha, las toxinas humanas utilizadas en las inmunotoxinas se han seleccionado en la mayoría de los casos de las ribonucleasas (6) . Ya que las RNasas humanas están presentes en los fluidos extracelulares, el plasma y los tejidos, se consideran menos inmunogénicas cuando se utilizan en inmunotoxinas. La angiogenina (ANG) , una proteína de 14 kDa que tiene una homología de secuencia del 64% con la RNasa A, se aisló por primera vez a partir de un medio acondicionado para células tumorales, donde se descubrió debido a su capacidad para inducir la angiogénesis (7) . Se demostró que la actividad RNasa específica del ARNt de la angiogenina tiene potencial citotóxico. De conformidad con ello, las inmunotoxinas químicamente conjugadas presentaban posteriormente una actividad tóxica específica de célula. Para evaluar la eficacia de las inmunotoxinas basadas en ANG, se construyeron diferentes conformaciones de ANG con, por ejemplo, el factor de crecimiento epidérmico (EGF) o el ligando CD30, y se sometieron con éxito a ensayo in vitro (8) . Otro miembro de la superfamilia de las RNasa es la neurotoxina derivada de eosinófilo (EDN) . Para la EDN, que tiene un tamaño de 18, 4 kDa, hasta la fecha sólo se ha descrito la neurotoxicidad directa. En base a la potencia documentada, se han construido diferentes inmunotoxinas basadas en EDN y se han sometido a ensayo con éxito in vitro (9) .
Muy recientemente se ha demostrado que las proteasas como la granzima B o derivados de la misma pueden cumplir de manera eficaz la función efectora de las inmunotoxinas (WO-A-01/80880) .
La fosforilación de proteínas es uno de los mecanismos más importantes mediante el cual las señales extracelulares se transforman en... [Seguir leyendo]
Reivindicaciones:
1. Complejo endógeno soluble sintético formado a partir de por lo menos un componente A y de por lo menos un componente B que se acoplan químicamente o se fusionan genéticamente el uno al otro, de manera que el componente A comprende anticuerpos como dominio de unión para las estructuras de superficie extracelulares que se internalizan tras la unión del componente A de dicho complejo, y quinasas que promueven la muerte, que consisten en la proteína quinasa asociada a la muerte (DAP-quinasa, DAPk) o la quinasa del factor 2 de elongación eucariota (eEF-2k) como componente B, que tiene una actividad quinasa catalítica constitutiva y realiza la biosíntesis/señalización celular que incluye la muerte celular después de la internalización.
2. Complejo según la reivindicación 1, en el que los anticuerpos son anticuerpos policlonales, anticuerpos monoclonales, anticuerpos humanizados, anticuerpos monocatenarios, Fab, F (ab’) 2, Fv, y otros fragmentos que conservan la función de unión al antígeno y la especificidad del anticuerpo parental.
3. Complejo según la reivindicación 1 ó 2, de manera que el componente B comprende DAP-quinasa 2 (DAPk2) .
4. Complejo según las reivindicaciones 1 a 3, que comprende uno o más componentes complementarios S que regulan la biosíntesis de proteínas a nivel de la transcripción y/o de la traducción, y/o permiten la purificación y/o la detección del complejo, y/o facilitan la translocación de por lo menos el componente B en la célula diana, y la activación y/o la separación intracelular del componente B, de manera que el componente S se selecciona del grupo de los promotores inducibles, las secuencias líder, los marcadores de afinidad, los marcadores His, un dominio de translocación, las secuencias anfipáticas y una progranzima B sintética.
5. Complejo según cualquiera de las reivindicaciones 1 a 4, que tiene las secuencias de la SEC ID Nº: 2 o la SEC ID 25 Nº:4 y lSEC IDNº:6.
6. Molécula de ácido nucleico que codifica para el complejo según cualquiera de las reivindicaciones 1 a 5 o para los componentes individuales del mismo para la preparación de tal complejo, y/o un vector que comprende dicha molécula de ácido nucleico.
7. Célula u organismo no humano después de haber sido transformado o transfectado con el vector o la molécula de ácido nucleico según la reivindicación 6, y/o un sistema de traducción in vitro que sintetiza el complejo completo según cualquiera de las reivindicaciones 1 a 5 o los componentes individuales del mismo.
8. Organismo o célula según la reivindicación 7, de manera que el organismo sea un procariota, o un eucariota inferior, un eucariota superior no humano, y la célula sea una célula de mamífero primaria o cultivada, tal como una célula humana recién aislada excepto las células embrionarias humanas, o una línea celular eucariota.
9. Uso de un complejo endógeno soluble sintético formado a partir de por lo menos un componente A y de por lo menos un componente B, de manera que el componente A comprende anticuerpos como dominio de unión para las estructuras de superficie extracelulares que se internalizan tras la unión del componente A de dicho complejo, y quinasas que promueven la muerte, que consisten en la proteína quinasa asociada a la muerte (DAP-quinasa, DAPk) o la quinasa del factor 2 de elongación eucariota (eEF-2k) como componente B, que tiene una actividad quinasa catalítica constitutiva y que realiza la biosíntesis/señalización celular que incluye la muerte celular después 45 de la internalización, para la preparación de un medicamento para el tratamiento de las enfermedades proliferativas, tales como las enfermedades proliferativas cancerosas o no cancerosas, las alergias, las enfermedades autoinmunes, y/o la inflamación crónica.
10. Uso según la reivindicación 9 en el que los anticuerpos son anticuerpos policlonales, anticuerpos monoclonales, 50 anticuerpos humanizados, anticuerpos monocatenarios, Fab, F (ab’) 2, Fv, y otros fragmentos que conservan la función de unión al antígeno y la especificidad del anticuerpo parental.
11. Medicamento que comprende un complejo endógeno soluble sintético formado a partir de por lo menos un componente A y d por lo menos un componente B, de manera que el componente A comprende anticuerpos como 55 dominio de unión para las estructuras de superficie extracelulares que se internalizan tras la unión del componente A de dicho complejo, y quinasas que promueven la muerte, que consisten en la proteína quinasa asociada a la muerte (DAP-quinasa, DAPk) o la quinasa del factor 2 de elongación eucariota (eEF-2k) como componente B, que tiene una actividad quinasa catalítica constitutiva y que realiza la biosíntesis/señalización celular que incluye la muerte celular después de la internalización.
12. Medicamento según la reivindicación 11 en el que los anticuerpos son anticuerpos policlonales, anticuerpos monoclonales, anticuerpos humanizados, anticuerpos monocatenarios, Fab, F (ab’) 2, Fv, y otros fragmentos que conservan la función de unión al antígeno y la especificidad del anticuerpo parental.
Patentes similares o relacionadas:
Cadena ligera de enteroquinasa modificada, del 22 de Julio de 2020, de NOVO NORDISK A/S: Un análogo de la cadena ligera de la enteroquinasa bovina que comprende una secuencia de aminoácidos establecida en la SEQ ID NO: 1, en donde dicho análogo comprende […]
Detección de interacciones proteína a proteína, del 15 de Julio de 2020, de THE GOVERNING COUNCIL OF THE UNIVERSITY OF TORONTO: Un método para medir cuantitativamente la fuerza y la afinidad de una interacción entre una primera proteína de membrana o parte de la misma y una […]
Métodos y composiciones para ingeniería genómica, del 3 de Junio de 2020, de Sangamo Therapeutics, Inc: Una pareja de nucleasas de dedo de zinc (ZFN) que comprende una ZFN izquierda y una ZFN derecha, comprendiendo cada ZFN un dominio de escisión […]
Métodos y composiciones para escisión dirigida y recombinación, del 20 de Mayo de 2020, de Sangamo Therapeutics, Inc: Un método in vitro para la escisión selectiva de un gen HLA clase I, un gen HLA que codifica una proteína de clase 1 del Complejo de Histocompatibilidad Mayor (MHC) […]
Antígenos de coagulasa estafilocócica y métodos para su uso, del 13 de Mayo de 2020, de UNIVERSITY OF CHICAGO: Una composición inmunógena que comprende al menos dos dominios 1-2 de coagulasa estafilocócica diferentes, en donde cada uno de los al menos dos dominios […]
Reconocimiento de unión a diana celular mediante un agente bioactivo usando transferencia de energía de resonancia de bioluminiscencia intracelular, del 6 de Mayo de 2020, de PROMEGA CORPORATION: Un sistema de ensayo que comprende: (a) una biblioteca de agentes bioactivos, cada uno de los cuales está fijado a un fluoróforo; (b) una diana celular fusionada a […]
Etiqueta de epítopo y método de detección, captura y/o purificación de polipéptidos etiquetados, del 15 de Abril de 2020, de ChromoTek GmbH: Péptido epítopo aislado que tiene de 12 a 25 aminoácidos, en donde la secuencia de aminoácidos comprende una secuencia según se define en SEQ ID NO: 32 (X1X2RX4X5AX7SX9WX11X12), […]
Utilización diagnóstica de un polipéptido de fusión que comprende una proteína vírica y un enzima MGMT, del 15 de Abril de 2020, de INSTITUT PASTEUR: Utilización in vitro de un polipéptido de fusión que comprende una proteína vírica y i) el enzima 6-metilguanina-ADN-metiltransferasa (MGMT, EC 2.1.1.63) o un homólogo […]