INGENIERIA DE GLICOSILACION DE ANTICUERPOS PARA LA MEJORA DE LA CITOTOXICIDAD CELULAR DEPENDIENTE DE ANTICUERPOS.
Un procedimiento in vitro o ex vivo para la producción de un anticuerpo recombinante que presenta mayor citotoxicidad celular mediada por Fc,
que comprende:
(i) proporcionar una célula huésped de mamífero que sea capaz de expresar un anticuerpo recombinante que comprende una región Fc de IgG que contiene oligosacáridos unidos por N y modificación genética de la célula huésped para regular la mayor expresión de al menos un enzima seleccionado del grupo constituido por: ß(1,4)-N-acetilglucosaminiltransferasa III, ß(1,4)-N-acetilglucosaminiltransferasa V y manosidasa II, con lo que se altera el modelo de glicosilación del anticuerpo;
(ii) cultivo de la célula huésped resultante (i) en condiciones que permitan la producción de dicho anticuerpo recombinante; y
(iii) aislamiento de dicho anticuerpo recombinante;
en el que dicho anticuerpo recombinante presenta una proporción mayor de residuos de GlcNAc en la región Fc respecto a la proporción de residuos de fucosa y presenta mayor citotoxicidad celular mediada por Fc en comparación con el anticuerpo correspondiente producido con la misma célula huésped que no se ha modificado genéticamente como en la etapa (i)
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/US99/08711.
Solicitante: UMANA, PABLO
JEAN-MAIRET, JOEL
BAILEY, JAMES E.
Nacionalidad solicitante: Suiza.
Dirección: MILCHBRUCKSTRASSE 3,8057 ZURICH.
Inventor/es: BAILEY, JAMES E., UMANA,PABLO, JEAN-MAIRET,JOEL.
Fecha de Publicación: .
Fecha Concesión Europea: 17 de Febrero de 2010.
Clasificación Internacional de Patentes:
- C07K16/28U
- C07K16/30L
- C12P21/00B
Clasificación PCT:
- C07K16/00 QUIMICA; METALURGIA. › C07 QUIMICA ORGANICA. › C07K PEPTIDOS (péptidos que contienen β -anillos lactamas C07D; ipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina diones-2,5, C07D; alcaloides del cornezuelo del centeno de tipo péptido cíclico C07D 519/02; proteínas monocelulares, enzimas C12N; procedimientos de obtención de péptidos por ingeniería genética C12N 15/00). › Inmunoglobulinas, p. ej. anticuerpos mono o policlonales.
- C07K16/28 C07K […] › C07K 16/00 Inmunoglobulinas, p. ej. anticuerpos mono o policlonales. › contra receptores, antígenos celulares de superficie o determinantes celulares de superficie.
- C07K16/30 C07K 16/00 […] › de células tumorales.
- C12N15/85 C […] › C12 BIOQUIMICA; CERVEZA; BEBIDAS ALCOHOLICAS; VINO; VINAGRE; MICROBIOLOGIA; ENZIMOLOGIA; TECNICAS DE MUTACION O DE GENETICA. › C12N MICROORGANISMOS O ENZIMAS; COMPOSICIONES QUE LOS CONTIENEN; PROPAGACION, CULTIVO O CONSERVACION DE MICROORGANISMOS; TECNICAS DE MUTACION O DE INGENIERIA GENETICA; MEDIOS DE CULTIVO (medios para ensayos microbiológicos C12Q 1/00). › C12N 15/00 Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K). › para células animales.
- C12N9/10 C12N […] › C12N 9/00 Enzimas, p. ej. ligasas (6.); Proenzimas; Composiciones que las contienen (preparaciones para la limpieza de los dientes que contienen enzimas A61K 8/66, A61Q 11/00; preparaciones de uso médico que contienen enzimas A61K 38/43; composiciones detergentes que contienen enzimas C11D ); Procesos para preparar, activar, inhibir, separar o purificar enzimas. › Transferasas (2.) (ribonucleasas C12N 9/22).
Clasificación antigua:
- A61K38/43 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › A61K 38/00 Preparaciones medicinales que contienen péptidos (péptidos que contienen ciclos beta-lactama A61K 31/00; dipéptidos cíclicos que no tienen en su molécula ningún otro enlace peptídico más que los que forman su ciclo, p. ej. piperazina 2,5-dionas, A61K 31/00; péptidos basados en la ergolina A61K 31/48; que contienen compuestos macromoleculares que tienen unidades aminoácido repartidas estadísticamente A61K 31/74; preparaciones medicinales que contienen antígenos o anticuerpos A61K 39/00; preparaciones medicinales caracterizadas por los ingredientes no activos, p. ej. péptidos como soportes de fármacos, A61K 47/00). › Enzimas; Proenzimas; Sus derivados.
- A61K39/395 A61K […] › A61K 39/00 Preparaciones medicinales que contienen antígenos o anticuerpos (materiales para ensayos inmunológicos G01N 33/53). › Anticuerpos (aglutininas A61K 38/36 ); Inmunoglobulinas; Inmunosuero, p. ej. suero antilinfocitario.
- C07H21/04 C07 […] › C07H AZUCARES; SUS DERIVADOS; NUCLEOSIDOS; NUCLEOTIDOS; ACIDOS NUCLEICOS (derivados de ácidos aldónicos o sacáricos C07C, C07D; ácidos aldónicos, ácidos sacáricos C07C 59/105, C07C 59/285; cianohidrinas C07C 255/16; glicales C07D; compuestos de constitución indeterminada C07G; polisacáridos, sus derivados C08B; ADN o ARN concerniente a la ingeniería genética, vectores, p. ej. plásmidos o su aislamiento, preparación o purificación C12N 15/00; industria del azúcar C13). › C07H 21/00 Compuestos que contienen al menos dos unidades mononucleótido que tienen cada una grupos fosfato o polifosfato distintos unidos a los radicales sacárido de los grupos nucleósido, p. ej. ácidos nucleicos. › con desoxirribosilo como radical sacárido.
- C12N15/00 C12N […] › Técnicas de mutación o de ingeniería genética; ADN o ARN relacionado con la ingeniería genética, vectores, p. ej. plásmidos, o su aislamiento, su preparación o su purificación; Utilización de huéspedes para ello (mutantes o microorganismos modificados por ingeniería genética C12N 1/00, C12N 5/00, C12N 7/00; nuevas plantas en sí A01H; reproducción de plantas por técnicas de cultivo de tejidos A01H 4/00; nuevas razas animales en sí A01K 67/00; utilización de preparaciones medicinales que contienen material genético que es introducido en células del cuerpo humano para tratar enfermedades genéticas, terapia génica A61K 48/00; péptidos en general C07K).
Fragmento de la descripción:
Ingeniería de glicosilación de anticuerpos para la mejora de la citotoxicidad celular dependiente de anticuerpos.
I. Campo de la invención
La presente invención se refiere al campo de la ingeniería de glicosilación de proteínas. De forma más particular, la presente invención se refiere a la ingeniería de glicosilación para generar proteínas con propiedades terapéuticas mejoradas, que incluyen anticuerpos con mejor citoxicidad celular dependiente del anticuerpo.
II. Antecedentes de la invención
Las glicoproteínas median muchas funciones esenciales en seres humanos, otros organismos eucarióticos y algunos procarióticos, incluyendo catálisis, señalización, comunicación célula-célula, y reconocimiento y asociación molecular. Estas constituyen la mayor parte de las proteínas no citosólicas en organismos eucarióticos. Lis y Sharon, 1993, Eur. J. Biochem. 218: 1- 27. Se han explotado muchas glicoproteínas para fines terapéuticos, y durante las últimas dos décadas han sido un producto principal de la industria biotecnológica versiones recombinantes de glicoproteínas secretadas de origen natural. Ejemplos incluyen eritropoyetina (EPO), anticuerpos monoclonales terapéuticos (mAbs terapéuticos), activador tisular del plasminógeno (tPA), interferona-ß (IFN-ß), factor de estimulación de las colonias de granulocitos-macrófagos (GM-CSF) y gonadotrofina coriónica humana (hCH). Cumming y col., 1991, Glycobiology 1:115-130.
El componente oligosacárido puede afectar de forma significativa a las propiedades relevantes para la eficacia de una glicoproteína terapéutica, incluyendo estabilidad física, resistencia al ataque de proteasa, interacciones con el sistema inmune, farmacocinéticos, y actividad biológica específica. Tales propiedades pueden depender no sólo de la presencia o ausencia, sino también de las estructuras específicas, de oligosacáridos. Se pueden hacer algunas generalizaciones entre estructura de oligosacárido y función de glicoproteína, por ejemplo, ciertas estructuras de oligosacáridos median el aclaramiento rápido de la glicoproteína en el torrente sanguíneo mediante interacciones con proteínas de unión a carbohidratos específicos, mientras que otras se pueden unir con anticuerpos y desencadenar reacciones inmunes no deseadas. Jenkins y col., 1996, Nature Biotechn. 14:975-981.
Las células de mamíferos son los huéspedes preferidos para la producción de glicoproteínas terapéuticas, debido a su capacidad para glicosilar proteínas en la forma más compatible para la aplicación en seres humanos. Cumming, 1991, véase anteriormente; Jenkins y col., 1996, véase anteriormente. Las bacterias muy raramente glicosilan proteínas, y como otros tipos de huéspedes comunes, tales como levaduras, hongos filamentosos, células de insectos y plantas, dan modelos de glicosilación asociados con el rápido aclaramiento en el torrente sanguíneo, interacciones inmunes no deseadas y en algunos casos específicos, actividad biológica reducida. Entre las células de mamíferos se han usado ampliamente células de ovario de hámster chino (CHO) durante las dos últimas décadas. Además de dar modelos de glicosilación adecuados, estas células permiten la generación coherente de líneas celulares clonales altamente productivas, genéticamente estables. Estas se pueden cultivar con altas densidades en biorreactores sencillos usando medio sin suero, y permiten el desarrollo de bioprocesos seguros y reproducibles. Otras células animales de uso común incluyen células de riñón de hámster cría (BHK), células de mieloma de ratón NS0- y SP2/0. Más recientemente se ha probado también la producción en animales transgénicos. Jenkins y col., 1996, véase anteriormente.
Se puede diseñar la glicosilación de proteínas terapéuticas recombinantes producidas en células animales mediante sobreexpresión de genes de glicosiltransferasa en células huésped. Bailey, 1991, Science 252:1668-1675. Sin embargo, trabajos previos en este campo han usado sólo expresión constitutiva de los genes de glicosiltransferasa que modifica la glicoproteína, y se ha prestado poca atención al nivel de expresión.
El documento WO 97/30087 se refiere a una preparación de anticuerpo en la que un sitio de N-glicosilación del dominio Fc del anticuerpo está sustituido con un oligosacárido biantenario, en el que al menos el 20% de la preparación comprende moléculas de anticuerpo que presentan un oligosacárido que contiene al menos un residuo de galactosa.
III. Sumario de la invención
La presente invención se refiere a procedimientos para la generación de proteínas que presentan un modelo de glicosilación alterado que da lugar a la mejora de valores terapéuticos.
La presente invención proporciona un procedimiento in vitro o ex vivo para la producción de un anticuerpo recombinante que presenta mayor citotoxicidad celular mediada por Fc, que comprende:
en el que dicho anticuerpo recombinante presenta una proporción mayor de residuos de GlcNAc en la región Fc respecto a la proporción de residuos de fucosa y presenta mayor citotoxicidad celular mediada por Fc en comparación con el anticuerpo correspondiente producido por la misma célula huésped que no se ha modificado genéticamente como en la etapa (i).
La invención se basa, en parte, en el descubrimiento de los inventores de que hay un intervalo óptimo de expresión de glicosiltransferasa que modifica la glicoproteína para la maximización de oligosacáridos unidos por N de tipo complejo que porta GlcNAc de bisección.
De forma más específica, la presente invención se refiere a un procedimiento para la producción de glicoformas alteradas de proteínas que presentan valores terapéuticos mejorados, por ejemplo, un anticuerpo que tenga una mejor citotoxicidad celular dependiente de anticuerpo (ADCC), en una célula huésped.
IV. Breve descripción de los dibujos
La figura 1 ilustra la representación de estructuras de oligosacárido asociado a Fc típicas.
La figura 2 ilustra un análisis por inmunotransferencia (Western blot) de expresión regulada por tetraciclina de GnT III en dos clones de CHO que producen tTA diferentes. Las células CHOt2 (líneas A y B) y CHOt17 (líneas C y D) se transfectaron con el vector de expresión pUDH10-3GnTIIIm y se cultivaron durante 36 horas en ausencia (líneas A y C) o presencia de tetraciclina, a una concentración de 400 ng/ml (líneas B y D). Se prepararon luego lisados celulares para análisis por imnunotransferencia probando con un anticuerpo (9E10), que reconoce de forma específica la etiqueta c-myc añadida a GnT III en su término carboxi.
La figura 3 ilustra la determinación del intervalo de concentraciones de tetraciclina donde se puede controlar la expresión de GnT III etiquetado con myc. Se transfectaron células CHOt17 con el vector de expresión pUDH10-3-GnTIIIm y se cultivaron luego durante 48 horas en presencia de las concentraciones indicadas de tetraciclina. Se compararon los niveles de GnT III en lisados celulares de estos cultivos usando análisis por inmunotransferencia. Se detectó GnT III mediante la etiqueta c-myc usando anticuerpo 9E10.
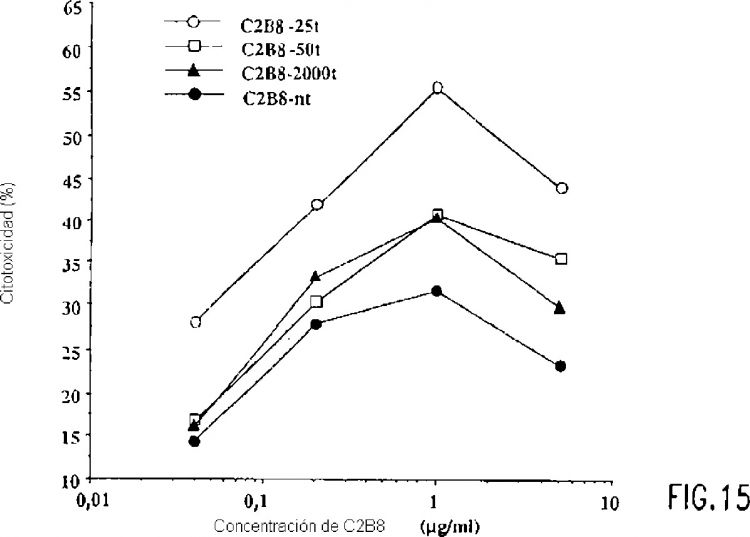
Las figuras 4A a 4B ilustran el rastreo de clones de CHO para expresión estable regulada por tetraciclina de GnT V (figura 4A) o glicosiltransferasas GnT III etiquetadas con myc (figura 4B) por análisis de inmunotransferencia. Se co-transfectaron células CHOt17 con un vector para expresión de resistencia a puromicina (pPUR) y se seleccionaron pUHD10-3GnTV (figura 4A) o pUDH-10-3GnTIIIm (figura 4B) y clones estables de CHO para resistencia a puromicina (7,5 µ/ml), en presencia de tetraciclina (2 µg/ml). Se cultivaron ocho clones (1 a 8) para cada glicosiltransferasa durante 48 horas en ausencia o presencia (+) de tetraciclina...
Reivindicaciones:
1. Un procedimiento in vitro o ex vivo para la producción de un anticuerpo recombinante que presenta mayor citotoxicidad celular mediada por Fc, que comprende:
en el que dicho anticuerpo recombinante presenta una proporción mayor de residuos de GlcNAc en la región Fc respecto a la proporción de residuos de fucosa y presenta mayor citotoxicidad celular mediada por Fc en comparación con el anticuerpo correspondiente producido con la misma célula huésped que no se ha modificado genéticamente como en la etapa (i).
2. Un procedimiento de acuerdo con la reivindicación 1, en el que dicha modificación genética aumenta la expresión del citado al menos un enzima.
3. Un procedimiento de acuerdo con la reivindicación 2, en el que el citado al menos un enzima es ß(1,4)-N-acetilglucosaminiltransferasa III.
4. Un procedimiento de acuerdo con la reivindicación 2, en el que el citado al menos un enzima es manosidasa II.
5. Un procedimiento de acuerdo con la reivindicación 2, en el que el citado al menos un enzima es ß(1,4)-N-acetilglucosaminiltransferasa III y manosidasa II.
6. Un procedimiento de acuerdo con la reivindicación 3, en el que se aumenta la expresión de dicho ß(1,4)-N-acetilglucosaminiltransferasa II.
7. Un procedimiento de acuerdo con la reivindicación 4, en el que se aumenta la expresión de dicha manosidasa II.
8. Un procedimiento de acuerdo con la reivindicación 5, en el que se aumenta la expresión de los dos citados ß(1,4)-N-acetilglucosaminiltransferasa III y manosidasa II.
9. Un procedimiento de acuerdo con la reivindicación 1, en el que la citada modificación genética comprende la introducción en la citada célula huésped de al menos un polinucleótido que codifica un enzima seleccionado del grupo constituido por: ß(1,4)-N-acetilglucosaminiltransferasa III, ß(1,4)-N-acetilglucosaminiltransferasa V y manosidasa II.
10. Un procedimiento de acuerdo con la reivindicación 1, en el que la citada célula huésped cultivada se selecciona del grupo constituido por una célula CHO diseñada por glicosilación, una célula de BHK diseñada por glicosilación, una célula NS0 diseñada por glicosilación y una célula SP2/0 diseñada de glicosilación.
11. Un procedimiento de acuerdo con la reivindicación 10, en el que la citada célula huésped es una célula CHO diseñada por glicosilación.
12. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo recombinante presenta una mayor proporción de oligosacáridos no fucosilados en la región Fc como un resultado de dicha modificación en comparación con el anticuerpo correspondiente producido por la misma célula huésped que no se ha modificado.
13. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo recombinante es un anticuerpo quimérico.
14. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo recombinante es un anticuerpo humanizado.
15. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo recombinante es un fragmento de anticuerpo que contiene una región Fc.
16. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo recombinante es una proteína de fusión que incluye una región Fc de una inmunoglobulina.
17. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo es un anticuerpo terapéutico.
18. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo se une de forma selectiva a un antígeno expresado por una célula cancerígena.
19. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo es un anticuerpo monoclonal.
20. Un procedimiento de acuerdo con la reivindicación 17, en el que el citado anticuerpo se selecciona del grupo constituido por: un anticuerpo anti-CD20, un anticuerpo de neuroblastoma anti-humano, un anticuerpo de carcinoma de células renales anti-humano, un anticuerpo anti-HER2, un colon anti-humano, pulmón, y anticuerpo de carcinoma de mama, un anticuerpo de antígeno 17-1 A anti-humano, un anticuerpo tumoral colorrectal anti-humano humanizado, un anticuerpo de melanoma anti-humano, y un anticuerpo de carcinoma celular escamoso anti-humano.
21. Un procedimiento de acuerdo con la reivindicación 1, en el que la mayoría de los oligosacáridos unidos a N en dicha región Fc de dicho anticuerpo producido por dicha célula huésped modificada son bisectados, no fucosilados.
22. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado al menos un enzima es GnT III de rata.
23. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado al menos un enzima es GnT V humano.
24. Un procedimiento de acuerdo con la reivindicación 1, en el que la citada modificación genética comprende la manipulación genética de dicha célula huésped de modo que la citada célula huésped presenta un nivel alterado de expresión del citado al menos un enzima.
25. Un procedimiento de acuerdo con la reivindicación 1, en el que la citada región Fc de IgG que contiene oligosacáridos unidos por N comprende una región Fc de IgG completa.
26. Un procedimiento de acuerdo con la reivindicación 1, en el que el citado anticuerpo recombinante que comprende una región Fc de IgG que contiene oligosacáridos unidos a N comprende un fragmento de IgG con una región Fc.
27. Un procedimiento de acuerdo con la reivindicación 26, en el que el citado fragmento de IgG comprende un dominio de CH2.
28. Un procedimiento de acuerdo con la reivindicación 1, en el que la citada célula huésped se modifica genéticamente para expresar el citado anticuerpo recombinante que comprende una región Fc de IgG que contiene oligosacáridos unidos por N después de que la citada célula huésped se ha modificado genéticamente para regular la mayor expresión del citado al menos un enzima.
Patentes similares o relacionadas:
SÍNTESIS DEL ÁCIDO SIÁLICO EN PLANTAS, del 21 de Noviembre de 2011, de MEDICAGO INC. CENTRE NATIONAL DE LA RECHERCHE SCIENTIFIQUE UNIVERSITE DE ROUEN: Un método para sintetizar el ácido siálico que comprende, i) cultivo de una planta transgénica que comprende una secuencia de nucleótidos codificadora de la sintasa del […]
MEJORA DE LA CALIDAD DEL PRODUCTO EN PROCEDIMIENTOS DE CULTIVO DE CÉLULAS DE MAMÍFERO PARA LA PRODUCCIÓN DE PROTEÍNAS, del 16 de Marzo de 2011, de BRISTOL-MYERS SQUIBB COMPANY: Un procedimiento de cultivo celular para la producción de una molécula de CTLA4 soluble, que comprende: a) cultivar células CHO que producen […]
 PROTEÍNAS N-GLICOSILADAS RECOMBINANTES DE CÉLULAS PROCARIOTAS, del 7 de Marzo de 2011, de ETH ZURICH: Un método para producir proteínas glicosiladas N-enlazadas, que comprende: a) proporcionar ácidos nucleicos que codifican al menos una proteína diana recombinante, […]
PROTEÍNAS N-GLICOSILADAS RECOMBINANTES DE CÉLULAS PROCARIOTAS, del 7 de Marzo de 2011, de ETH ZURICH: Un método para producir proteínas glicosiladas N-enlazadas, que comprende: a) proporcionar ácidos nucleicos que codifican al menos una proteína diana recombinante, […]
MÉTODO PARA FABRICACIÓN DE GLICOPROTEÍNAS QUE TIENEN GLICOSILACIÓN DE TIPO HUMANO, del 17 de Enero de 2011, de PHYTON HOLDINGS, LLC: Un método de expresar una glicosiltransferasa y una glicoproteína exógena que tienen una cadena de azúcar de tipo humano en una célula de planta transformada, […]
 TRANSPORTADOR DE FUCOSA, del 26 de Noviembre de 2010, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Célula de hámsteres chino DXB11 en la que se destruye un gen transportador de fucosa
TRANSPORTADOR DE FUCOSA, del 26 de Noviembre de 2010, de CHUGAI SEIYAKU KABUSHIKI KAISHA: Célula de hámsteres chino DXB11 en la que se destruye un gen transportador de fucosa
SIALIDASA RECOMBINANTE DE CELULA CHO, del 21 de Octubre de 2010, de GENENTECH, INC.: UNA LINEA CELULAR RECOMBINANTE TIENE UNA SIALIDASA CONSTITUTIVA CUYA EXPRESION FUNCIONAL SE INTERRUMPE POR EJEMPLO POR RECOMBINACION HOMOLOGA O UTILIZANDO RNA ANTI-SENTIDO. LA […]
GLICOINGENIERIA EN SETAS, del 6 de Mayo de 2010, de PLANT RESEARCH INTERNATIONAL B.V.: Un método para producir una glicoproteína en una célula huésped recombinante, que comprende permitir la expresión de dicha glicoproteína en un huésped […]
MOLÉCULAS DE UNIÓN A CD20, del 16 de Noviembre de 2011, de APPLIED MOLECULAR EVOLUTION, INC: Una composición que comprende una molécula de unión a CD20, en la que dicha molécula de unión a CD20 tiene una afinidad de unión (Kd) por CD20 humana de 5,0 x 10 -10 M […]