IMPLANTES SUBCUTANEOS QUE LIBERAN UN PRINCIPIO ACTIVO DURANTE UN PERIODO DE TIEMPO PROLONGADO.
Implantes subcutáneos obtenidos mediante extrusión que contienen un ingrediente activo dispersado en una matriz de PLGA,
de los cuales dicha matriz se obtiene al moler un producto extrudido de una mezcla de: - Como mínimo dos PLGA con proporciones molares diferentes de ácido láctico / ácido glicólico y pesos moleculares medios diferentes, o - un PLGA y un PLA con pesos moleculares medios diferentes, de los cuales dicho ingrediente activo se selecciona de entre el grupo que comprende: Un péptido, un ingrediente activo capaz de aumentar la densidad ósea escogido de entre: ácidos bisfosfónicos farmacéuticamente aceptables y sus sales, vitamina D y hormonas sexuales, un principio activo analgésico-narcótico, una hormona esteroide para tratamientos hormonales durante la menopausia y para la anticoncepción
Tipo: Patente Internacional (Tratado de Cooperación de Patentes). Resumen de patente/invención. Número de Solicitud: PCT/EP2007/057967.
Solicitante: MEDIOLANUM PHARMACEUTICALS LIMITED.
Nacionalidad solicitante: Irlanda.
Dirección: 7TH FLOOR, HUME HOUSE BALLSBRIDGE,DUBLIN 4.
Inventor/es: MARION, PIERRE, MAURIAC, PATRICE.
Fecha de Publicación: .
Fecha Concesión Europea: 23 de Junio de 2010.
Clasificación Internacional de Patentes:
- A61K9/00M5D
Clasificación PCT:
- A61K9/00 NECESIDADES CORRIENTES DE LA VIDA. › A61 CIENCIAS MEDICAS O VETERINARIAS; HIGIENE. › A61K PREPARACIONES DE USO MEDICO, DENTAL O PARA EL ASEO (dispositivos o métodos especialmente concebidos para conferir a los productos farmacéuticos una forma física o de administración particular A61J 3/00; aspectos químicos o utilización de substancias químicas para, la desodorización del aire, la desinfección o la esterilización, vendas, apósitos, almohadillas absorbentes o de los artículos para su realización A61L; composiciones a base de jabón C11D). › Preparaciones medicinales caracterizadas por un aspecto particular.
Fragmento de la descripción:
CAMPO DE LA INVENCIÓN
La presente invención se refiere a un implante subcutáneo que libera un principio activo durante un período de tiempo prolongado, y que contiene un ingrediente activo dispersado a lo largo de una matriz polimérica de PLGA, obtenida al moler un producto extrudido de una mezcla de como mínimo dos PLGA que contienen proporciones molares diferentes de ácido láctico / ácido glicólico y pesos moleculares medios diferentes, o un PLGA y un PLA con pesos moleculares medios diferentes y el proceso correspondiente para preparar dichos implantes. ESTADO DE LA TÉCNICA
Gran cantidad de agentes terapéuticos son rápidamente metabolizados y eliminados por el organismo, tanto en humanos como en mamíferos y, por lo tanto, requieren una administración frecuente del fármaco con el objetivo de mantener una concentración terapéutica adecuada.
La ventaja de utilizar implantes que contienen fármacos de liberación controlada es de sobras conocida entre los expertos en la materia.
De entre los numerosos implantes subcutáneos conocidos en la técnica, aquellos descritos en la solicitud de patente WO00/33809 representan una mejora neta con respecto a los anteriores implantes subcutáneos que contienen, como principio activo, un polipéptido dispersado a lo largo de una matriz de ácido polilácticoglicólico, ya que tienen la capacidad de liberar el principio activo mencionado anteriormente en 6 meses. Los implantes subcutáneos descritos en dicha solicitud de patente anterior también difieren en que presentan un perfil esencialmente trifásico y no bifásico, concretamente una liberación por difusión pura, difusión controlada tras una hinchazón y liberación debido a una degradación polimérica.
Por tanto, esta progresión permite una extensión de los tiempos de liberación. De hecho, cuando se introducen estos implantes en un medio acuoso, el agua se difunde a través de la matriz polimérica y alcanza las partículas peptídicas más próximas a la superficie y, posteriormente, las zonas interiores.
El implante se mantiene esencialmente sin cambios durante unas 6 semanas y, durante este período, libera aproximadamente un 30% del péptido.
La duración de esta etapa de difusión pura está fundamentalmente determinada por el nivel de heterogeneidad de las dimensiones del péptido, y la velocidad está fundamentalmente determinada por el contenido de partículas en la matriz de PLGA.
Debido a que el principio activo presenta partículas heterogéneas de dimensiones, tras la primera etapa de disolución queda una cantidad suficiente de péptido que puede ser liberado en las sucesivas etapas mencionadas, es decir, liberación por difusión e hinchazón y liberación por degradación del polímero.
Todos los implantes subcutáneos, incluso los mencionados anteriormente, adolecen de un inconveniente causado esencialmente por el hecho de que, una vez dichos implantes se administran en el organismo humano, mayoritariamente en los primeros días liberan una cantidad diaria total de principio activo considerablemente elevada (en algunos casos, decididamente mayor que la dosis diaria máxima permitida).
Esto es debido, esencialmente, a una disolución inmediata del principio activo, este fenómeno, que no se agota durante los días subsiguientes sino que a veces aumenta en una progresión escalar, se conoce como la “ráfaga” inicial. Por lo tanto, en estos casos, se puede verificar que la cantidad de fármaco liberado de tales sistemas, aunque es baja si se compara con la cantidad de principio activo total contenido en los implantes subcutáneos administrados, puede en algunos casos considerarse peligrosa si, con tal ráfaga inicial, se aproxima o excede la dosis diaria máxima permitida de este tipo de fármaco.
Los implantes subcutáneos con una liberación inicial limitada del principio activo, y como consecuencia, una liberación con variación lineal del mismo, están constituidos por:
- un núcleo (i) que comprende un principio activo dispersado a lo largo de una matriz polimérica de copolímero de ácido poliláctico-glicólico (PLGA),
- una capa en forma de película (ii), que esencialmente comprende un copolímero de ácido láctico-glicólico, y los procesos correspondientes para preparar dichos implantes, descritos en la solicitud de patente WO 2005/000278 A1. SUMARIO DE LA INVENCIÓN
El Solicitante ha encontrado, inesperadamente, formulaciones de los implantes subcutáneos basados en PLGA que superan el inconveniente mencionado anteriormente, es decir, la falta de linealidad del perfil de liberación y la importante liberación inicial o liberación por “ráfaga”, sin necesidad de recubrir dichos implantes tal como se impone en la solicitud de patente WO 2005/000278 A1 mencionada anteriormente.
Por lo tanto, la presente invención se refiere a implantes subcutáneos obtenidos mediante extrusión que contienen un ingrediente activo dispersado a lo largo de una matriz de PLGA, donde dicha matriz se obtiene al moler un producto extrudido de una mezcla de:
- como mínimo dos PLGA que contienen proporciones molares diferentes de ácido láctico / ácido glicólico y pesos moleculares medios diferentes, o
- un PLGA y un PLA con pesos moleculares medios diferentes.
Tales implantes provocan una liberación del ingrediente activo de manera bastante lineal o, en términos generales, de una manera que podría encajar con un conjunto específico de criterios para un propósito de formulación concreto (por ejemplo, aumentar la duración de liberación total limitando la liberación por “ráfaga” inicial).
DESCRIPCIÓN DE LAS FIGURAS
La figura 1 representa, en las ordenadas, el perfil de liberación total del ingrediente activo expresado en mg frente a, en las abscisas, el tiempo expresado en días tras la inmersión en el medio acuoso de los implantes subcutáneos preparados tal y como se describe en el ejemplo 1.
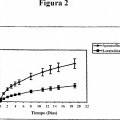
La figura 2 representa, en las ordenadas, la liberación total de ingrediente activo expresada en % frente a, en las abscisas, el tiempo expresado en días tras la inmersión en el medio acuoso del único implante subcutáneo 1#3 preparado tal y como se describe en el ejemplo 1.
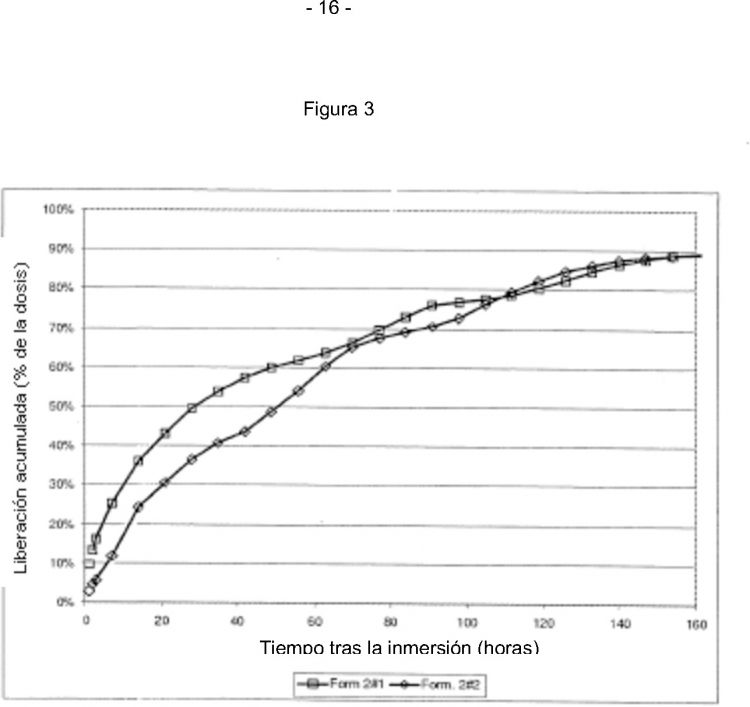
La figura 3 representa, en las ordenadas, el perfil de liberación total del ingrediente activo expresado en mg frente a, en las abscisas, el tiempo expresado en días tras la inmersión en el medio acuoso de los implantes subcutáneos preparados tal y como se describe en el ejemplo 2.
La figura 4 representa, en las ordenadas, la liberación total del ingrediente activo expresada en mg frente a, en las abscisas, el tiempo expresado en días tras la inmersión en el medio acuoso de los implantes subcutáneos preparados tal y como se describe en el ejemplo 3.
La figura 5 representa, en las ordenadas, la liberación total del ingrediente activo expresada en mg frente a, en las abscisas, el tiempo expresado en días tras la inmersión en el medio acuoso de los implantes subcutáneos preparados tal y como se describe en el ejemplo 4.
La figura 6 representa, en las ordenadas, la liberación total del ingrediente activo expresada en mg frente a, en las abscisas, el tiempo expresado en días tras la inmersión en el medio acuoso de los implantes subcutáneos preparados tal y como se describe en el ejemplo 5.
DESCRIPCIÓN DETALLADA DE LA INVENCIÓN Los implantes subcutáneos de la presente invención contienen principios activos escogidos del grupo que comprende: un
péptido, un principio activo capaz de incrementar la densidad ósea, un principio activo analgésico-narcótico, una hormona esteroide, para tratamientos hormonales durante la menopausia y como anticonceptivo.
Preferiblemente, dicho péptido se escoge de entre: avorelina, triptorelina, goserelina y leuprorelina.
El ingrediente activo con capacidad de incrementar la densidad ósea se escoge de entre: ácidos bisfosfónicos farmacéuticamente aceptables y sus sales, vitamina D y hormonas sexuales.
De estos ácidos bisfosfónicos y sus sales relacionadas farmacéuticamente aceptables, se mencionan por ejemplo los compuestos con la fórmula general (I):
**(Ver fórmula)**
en la que M1, M2, M3 y M4 son cationes monovalentes y/o H, donde dichos cationes monovalentes se escogen de entre metales alcalinos, o...
Reivindicaciones:
1. Implantes subcutáneos obtenidos mediante extrusión que contienen un ingrediente activo dispersado en una matriz de PLGA, de los cuales dicha matriz se obtiene al moler un producto extrudido de una mezcla de:
- Como mínimo dos PLGA con proporciones molares diferentes de ácido láctico / ácido glicólico y pesos moleculares medios diferentes, o
- un PLGA y un PLA con pesos moleculares medios diferentes, de los cuales dicho ingrediente activo se selecciona de entre el grupo que comprende:
Un péptido, un ingrediente activo capaz de aumentar la densidad ósea escogido de entre: ácidos bisfosfónicos farmacéuticamente aceptables y sus sales, vitamina D y hormonas sexuales, un principio activo analgésico-narcótico, una hormona esteroide para tratamientos hormonales durante la menopausia y para la anticoncepción.
2. Implantes subcutáneos según la reivindicación 1, de los cuales dicho péptido se selecciona de entre el grupo que comprende avorelina, triptorelina, goserelina y leuprorelina.
3. Implantes subcutáneos según la reivindicación 1, de los cuales dichas sales de ácido bisfosfónico se seleccionan de entre etidronato disódico, alendronato disódico y pamidronato disódico.
4. Implantes subcutáneos según la reivindicación 1, de los cuales dichas hormonas sexuales se seleccionan de entre el grupo que comprende: estrógenos y progestinas androgénicas.
5. Implantes subcutáneos según la reivindicación 4, de los cuales dichos estrógenos se escogen de entre la clase que comprende el estradiol, el valerato de estradiol, el cipionato de estradiol, la estrona, el sulfato de estrona o estrógenos de tipo no esteroide.
6. Implantes subcutáneos según la reivindicación 4, de los cuales dichas progestinas androgénicas se escogen de entre la clase que comprende la noretindrona, el noretinodrel, el norgestrel, el desogestrel, el norgestimato.
7. Implantes subcutáneos según la reivindicación 1, de los cuales dicho ingrediente activo con actividad narcótica y analgésica se selecciona de entre el grupo que comprende la morfina y los morfinanos, y los agonistas del receptor µ.
8. Implantes subcutáneos según la reivindicación 7, de los cuales dichos agonistas del receptor µ son fenilpiperidinas seleccionadas de entre el grupo que comprende: meperidina, fentanil y sales relacionadas farmacéuticamente aceptables, congéneres del
fentanil seleccionados de entre el sufentanil, el alfentanil, el lofentanil, el carfentanil, el remifentanil y sus sales farmacéuticamente aceptables.
9. Implantes subcutáneos según cualquiera de las reivindicaciones 1 a 8, de los cuales el ingrediente activo que contienen posee una distribución de tamaños de partículas homogénea o heterogénea.
10. Implantes subcutáneos según la reivindicación 9, de los cuales, cuando el ingrediente activo es un péptido, muestra una distribución de tamaños de partículas heterogénea, comprendida entre 1 y 63 µm o entre 1 y 100 µm.
11. Implantes subcutáneos según la reivindicación 10, de los cuales el PLGA extrudido mezclado resultante tiene una proporción molar de ácido láctico / ácido glicólico comprendida entre 50/50 y 90:10 y un peso molecular medio comprendido entre 50,000 y 150,000.
12. Un proceso para preparar dichos implantes subcutáneos según cualquiera de las reivindicaciones 1 a 11 que comprende los siguientes pasos
a) Mezclar como mínimo dos PLGA que poseen pesos moleculares medios diferentes y proporciones molares de ácido láctico / ácido glicólico diferentes,
b) extrudir la mezcla en polvo procedente del paso
(a) y luego moler la mezcla extrudida de PLGA, obteniendo de esta manera gránulos de PLGA mezclado extrudido,
c) mezclar en seco el ingrediente activo en forma de partículas con los gránulos de PLGA mezclado extrudido obtenido en el paso (b), o (c') granular en húmedo las partículas de dicho ingrediente activo y los gránulos de PLGA mezclado extrudido procedentes del paso (b) en presencia de un disolvente adecuado, como por ejemplo agua o alcohol diluido,
d) secar el producto granulado procedente de la granulación en húmedo del paso (c'), obteniendo de esta manera un residuo cuyo contenido máximo de líquido es de entre 0,1 y 3%.
e) extrudir la mezcla en seco obtenida en el paso (c)
o el producto granulado secado del paso (d).
Patentes similares o relacionadas:
AGENTES PARA EL TRATAMIENTO DE LA RETINOPATÍA GLAUCOMATOSA Y DE LA NEUROPATÍA ÓPTICA, del 30 de Diciembre de 2011, de NOVARTIS AG: Composición para el tratamiento de la retinopatía glaucomatosa o de la neuropatía óptica en un sujeto en la que la composición proporciona una concentración […]
SISTEMA PARA LA ADMINISTRACIÓN DE SUSTANCIAS BIOLÓGICAMENTE ACTIVAS QUE COMPRENDE POLI-EPSILÓN-CAPROLACTONA, POLOXAMINA Y UNA O VARIAS SUSTANCIAS ACTIVAS, del 13 de Diciembre de 2011, de UNIVERSIDAD DE SANTIAGO DE COMPOSTELA: La presente invención se refiere a un sistema para la administración de sustancias biológicamente activas que comprende poli-{ep}-caprolactona, poloxamina y […]
BIO-MATERIALES FORMADOS POR REACCIÓN DE ADICIÓN NUCLEÓFILA A GRUPOS INSATURADOS CONJUGADOS, del 24 de Noviembre de 2011, de EIDGENOSSISCHE TECHNISCHE HOCHSCHULE ZURICH UNIVERSITAT ZURICH: Un método para hacer un biomaterial, que comprende dicho método combinar un primer componente precursor que comprende al menos dos neoclófilos con […]
FORMULACIÓN PARA LA LIBERACIÓN CONTROLADA DE FÁRMACOS MEDIANTE LA COMBINACIÓN DE AGENTES HIDRÓFILOS E HIDRÓFOBOS, del 23 de Noviembre de 2011, de ALLERGAN, INC.: Un implante para su uso en un método de tratamiento de afecciones oculares por inserción de dicho implante en la cámara posterior del ojo, siendo dicho implante […]
MICROCÁPSULAS ESFÉRICAS O NO ESFÉRICAS QUE COMPRENDEN PÉPTIDOS GLP-1, SU PRODUCCIÓN Y SU USO, del 17 de Agosto de 2011, de BIOCOMPATIBLES UK LIMITED: Microcápsula esférica que comprende como mínimo un revestimiento superficial y un núcleo, en la que el como mínimo un revestimiento superficial comprende […]
LIBERACIÓN SOSTENIDA DE SUSPENSIONES MICROCRISTALINAS DE PÉPTIDOS, del 6 de Julio de 2011, de MEDICAL RESEARCH COUNCIL TECHNOLOGY: Un método para evitar la formación de gel de teverelix (Ac-D-Nal-D-Cpa-D-Pal-Ser-Tyr-D-Hci-Leu-llys-Pro DAla-NH2) que comprende poner en contacto teverelix con un […]
 DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA, del 30 de Mayo de 2011, de TITAN PHARMACEUTICALS, INC.: Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica […]
DISPOSITIVO POLIMÉRICO IMPLANTABLE PARA LIBERACIÓN SOSTENIDA DE AGONISTA DE DOPAMINA, del 30 de Mayo de 2011, de TITAN PHARMACEUTICALS, INC.: Un dispositivo implantable para la administración de un agonista de dopamina a un mamífero que lo necesita, que comprende un agonista de dopamina y una matriz polimérica […]
 REDUCIR LAS EXPERIENCIAS ADVERSAS ASOCIADA CON LA TERAPIA DE OXIBUTININA, del 28 de Abril de 2011, de WATSON PHARMACEUTICALS, INC.: El uso de oxibutinina para la preparación de un parche de matriz transdérmico para la administración a un mamífero para proporcionar un área de plasma por […]
REDUCIR LAS EXPERIENCIAS ADVERSAS ASOCIADA CON LA TERAPIA DE OXIBUTININA, del 28 de Abril de 2011, de WATSON PHARMACEUTICALS, INC.: El uso de oxibutinina para la preparación de un parche de matriz transdérmico para la administración a un mamífero para proporcionar un área de plasma por […]